水盐代谢相关激素在梅尼埃病发病中的作用
陈姿 郭明丽 屈永涛
梅尼埃病(meniere’s disease, MD)临床表现为反复发作的眩晕、波动性感音神经性听力下降和耳鸣等,发病率为10/10万~157/10万[1]。MD病因不明,主要病理变化为膜迷路积水,发病机制未明确,研究显示,水盐代谢相关激素与内淋巴液生成、吸收平衡有关,激素失衡、离子转运通道蛋白功能障碍或缺陷,可能导致内淋巴积水[2-5]。本研究检测MD患者外周血抗利尿激素(antidiuretic hormone,ADH)、醛固酮(aldosterone,ALD)、糖皮质激素(glucocorticoid,GC)水平,探讨ADH、ALD、GC在内淋巴稳态中可能的作用机制。
1 资料与方法
1.1 一般资料 选取2019年5~12月在河北省人民医院耳鼻咽喉科门诊及病房诊断为MD患者47例为试验组,同期不伴有耳、鼻疾病史的健康志愿者、耳鼻咽喉科门诊和住院患者19例为对照组。试验组47例,其中男19例,女28例;年龄24~77岁,平均年龄(54.39±12.39)岁。对照组19例,其中男12例,女7例;平均年龄(49.1±13.18)岁。2组年龄、性别比差异无统计学意义(P>0.05),具有可比性。
1.2 纳入与排除标准 (1)试验组均符合《梅尼埃病诊断和治疗指南(2017)》诊断标准[1];(2)1个月内未使用过糖皮质激素、镇静药物;(3) 2周内无急性感染;(4)无重大疾病史,患有慢性病者(如糖尿病、高血压等)病情控制稳定;(5)无内分泌系统代谢障碍性疾病(如抗利尿激素分泌失调综合征、库欣综合征、多发性内分泌腺瘤病等)。
1.3 方法 试验组发作期标本于眩晕发作后48 h内采血,间歇期标本于末次发作症状缓解4周以后采血。受试者均采用促凝真空采血管抽取晨起空腹外周血5 ml。标本于室温放置2~4 h,待其自然凝固后放置于离心机中,转速为 3 600 r/min,离心10 min后收集血清2 ml,置于EP管内,对EP管编号,登记编号信息后将血清置于-80℃冰箱保存,采用酶联免疫吸附法测定血清中ALD、ADH、GC的水平,对样本的处理、实验步骤及最终浓度的计算,均严格按照使用说明书进行操作。
2 结果
2.1 2组血清中ADH、ALD、GC水平比较 试验组血清中ADH和ALD水平均高于对照组,差异有统计学意义(P<0.05);试验组血清中GC水平略低于对照组,但差异无统计学意义(P>0.05)。见表1。

表1 2组血清中ADH、ALD、GC水平比较
2.2 试验组发作期与对照组血清中ADH、ALD、GC水平比较 试验组发作期血清中ADH、ALD水平均高于对照组(P<0.05);血清中GC水平略低于对照组,但差异无统计学意义(P>0.05)。见表2。
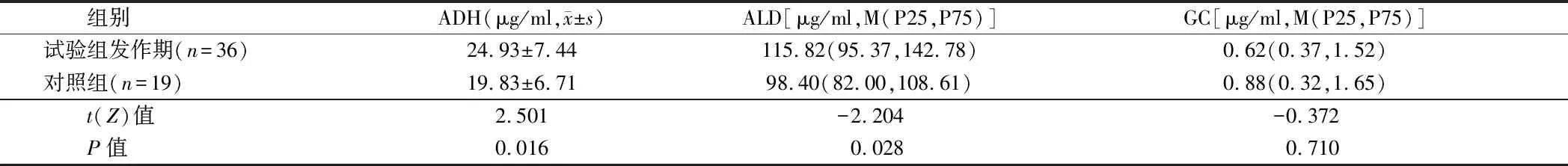
表2 试验组发作期与对照组血清中ADH、ALD、GC水平比较
2.3 试验组发作期与间歇期血清中ADH、ALD、GC水平比较 试验组发作期血清中ADH和ALD水平略高于间歇期,但差异无统计学意义(P>0.05);间歇期血清中GC水平高于发作期(P<0.05)。见表4。

表3 试验组发作期与间歇期ADH、ALD、GC水平比较
3 讨论
MD是耳科常见病[6],1938年Hallpike等[7]第一次提出了MD以膜迷路积水为主要病理基础,但膜迷路积水的机制至今尚不明确,学者关注到水盐代谢相关激素与MD的发生可能有关,本研究观察受试者血清中ADH、ALD和GC的水平并分别讨论。
3.1 ADH与MD:ADH又称血管加压素(vasopressin,VP),由下丘脑视上核和视旁核的神经内分泌细胞合成,通过与血管加压素1受体(vasopressin 1 receptor,V1R)、血管加压素2受体(vasopressin 2 receptor,V2R)结合发挥作用,其中V2R与水盐代谢有关[8,9]。
内耳存在ADH受体以及水通道蛋白[10],且MD患者内淋巴囊中AQP2 mRNA表达明显高于对照组,V2R和AQP2 mRNA 表达水平显著正相关[11]。本研究结果显示,试验组、试验组发作期血清中ADH水平均高于对照组(P<0.05)。Kitahara等[9]报道MD患者内淋巴囊V2RmRNA表达上调,使细胞膜内的AQP2无法向细胞质转移,细胞膜表面存有大量AQP2,ADH升高即可导致膜迷路积水。其他学者也认为,ADH引起血管纹中AQP2 mRNA表达上调,增加水从外淋巴进入到血管纹,再增加水向内淋巴的渗透,导致内淋巴产生增加[12,13]。除上述通路外,ADH还可作用于内淋巴囊中上皮钠通道,上调其功能,导致膜迷路积水[14]。本研究结果中,试验组发作期ADH水平高于对照组,推测可能原因ADH水平升高是MD患者症状发作的原因之一。
3.2 ALD与MD的关系: ALD由肾上腺皮质球状带分泌,为盐皮质激代表。盐皮质激素的主要生理作用是促进肾小管重吸收钠而保留水,并排泄钾。
ALD可通增强ENaC表达,ENaC在豚鼠耳蜗中表达部位包括血管纹、螺旋韧带、前庭膜、螺旋神经节、螺旋器及螺旋缘等[15],加速Na+泵出细胞、K+泵入细胞,导致细胞内与小管液之间的K+浓度差变大,促进K+的分泌[16,17]。ALD还可通过增加ENaC表达来增加 Na+运输,增加水吸收,导致内淋巴液量增加[18]。Qin等[19]将ALD注射至豚鼠腹腔内,可以引起内耳膜迷路积水,说明体内ALD含量升高可导致MD同样的内耳病理变化,也就有可能导致MD同样临床症状。
本研究结果显示,试验组、试验组发作期血清中,ALD水平均高于对照组(P<0.05)。推测MD患者ALD基础水平即高于对照组,当某种因素导致体内ALD浓度升高,ENaC表达增强,增加了Na+运输,同时造成了膜迷路积水。
研究表明,ADH、ALD的分泌又受AngⅡ的调节,AngⅡ不仅可促进神经垂体释放ADH,还可以合成和分泌ALD,血液中ADH、ALD水平增高后会导致MD的发作[20]。当MD患者因生活习惯、情绪问题导致血液中AngⅡ含量升高,可刺激下丘脑ADH基因表达和垂体释放ADH[21]。AngⅡ还可以经过血管紧张素酶A生成AngⅢ[22],AngⅡ和AngⅢ均可刺激肾上腺皮质球状带合成和分泌ALD[23],使Na+和水的重吸收增强,最终导致MD患者的病情发作[24]。AngⅡ可以调节ADH、ALD的分泌,后者可以通过多种机制作用于内耳,调节内耳膜迷路水盐代谢,当各种原因导致二者体内水平升高,使得内耳膜迷路水盐代谢异常,导致MD患者出现膜迷路积水,并表现出相应的临床症状,本试验结果与上述推测相符。
3.3 GC与MD的关系 GC由肾上腺皮质束状带分泌,其中90%为皮质醇,10%为皮质酮[8]。GC在人体中的主要作用是参加糖代谢、蛋白质纸代谢、脂肪代谢、水和电解质代谢[25]。试验组发作期血清中GC水平略低于对照组,但差异无统计学意义(P>0.05);试验组间歇期GC水平高于发作期(P<0.05)。
研究发现,内耳组织中存在糖皮质激素受体(glucocorticoid receptor,GR)[26]。Echisen等[27]对Na+,K+-ATPase在内耳的分布以及GC对Na+,K+-ATPase的调节作用研究显示,利用免疫组织化学(immunofluorescence,IHC)发现小鼠内耳存在Na+,K+-ATPase,同时发现在小鼠生长发育过程中,GR表达的时间和量与Na+,K+-ATPase的表达有一致性,作者推测GC可能通过调节Na+,K+-ATPase表达的方式来调节内耳电解质平衡。
GC还通过调控AQP实现对内耳水代谢的调节。Nevoux等[28]进一步研究,发现AQP3在内耳将水运输到内淋巴液中,证实地塞米松对AQP3表达和水流量的调节有关。Nevoux等[28]也观察到AQP3在人和小鼠内耳中分布并高度表达,发现地塞米松对小鼠的前庭细胞的AQP3的表达具有刺激作用,证实地塞米松可以刺激内耳中内淋巴液的再吸收。这一结果对维持内淋巴稳态有重要意义。
目前临床上MD治疗中应用的GC类药物主要有地塞米松、甲泼尼龙琥珀酸钠等,其可与内耳中GR结合,可能通过调节内耳Na+、K+-ATPase、AQP3活性,实现对内耳电解质和水代谢的调控,另外,GC还可有效阻止异常免疫反应、抑制炎性介质释放、降低炎性反应,从而减轻膜迷路积水,缓解MD患者临床症状。
综上所述,MD发作期血清中GC水平低于间歇期(P<0.05)。试验组与对照组、MD发作期与对照组,差异无统计学意义(P>0.05)。说明MD间歇期受试者体内GC的水平升高,这可能是促进MD患者临床症状缓解的因素之一,这一结果为临床应用GC治疗MD提供了理论依据。

