胃癌肝转移患者的临床特征及相关危险因素分析
王培培, 韩敏, 吴志军
胃癌主要是指发生在胃黏膜上皮细胞的恶性肿瘤,胃癌发病率、死亡率在全球恶性肿瘤中居第五位和第三位,在中国恶性肿瘤中居第四位和第二位[1]。胃癌早期多无明显临床症状,确诊时多已中晚期,5年生存率30%左右[2]。胃癌肝转移是指胃癌细胞不断向外浸润生长,随着血液回流进入肝脏,在肝脏位置长出一个或多个转移癌灶,且转移癌灶和胃癌原发灶的组织病理类型一样[3]。胃癌肝转移患者的5年生存率在15%左右[4]。胃癌肝转移是是胃癌患者治疗失败和死亡的重要原因[5-6]。了解胃癌肝转移的临床特征及相关的危险因素,为胃癌肝转移的早期预测提供依据,有助于预后的改善,提高胃癌肝转移患者的生存率。本研究主要探讨胃癌肝转移的临床病理特征及相关危险因素,研究结果报道如下。
1 资料与方法
1.1 临床资料 回顾性分析马鞍山市人民医院2017年1月至2021年12月收治的胃癌患者256例。经术前CT检查、术后病理活检证实胃癌肝转移患者98例,胃癌无肝转移患者158例。胃癌肝转移患者年龄39~74岁,平均(60.32±6.78)岁;同时性肝转移(胃癌患者初诊或者第一次手术时诊断出肝转移,或者胃癌手术后1年内新出现的肝转移,且肝转移灶来源于胃癌的原发病灶)60例,异时性肝转移(胃癌术后1~2年出现的肝转移或者未行胃癌根治手术的肝转移)38例[7]。胃癌无肝转移患者年龄38~75岁,平均(60.38±6.82)岁。
1.2 纳入及排除标准 纳入标准:①经内镜、术后病理诊断为胃癌;②经增强CT、磁共振等影像学检查或术后病理证实有肝转移;③临床病例资料完整;④配合随访。排除标准:①合并其他原发性肿瘤;②随访过程中发生死亡,但死亡原因为非肿瘤因素。
1.3 方法 通过查阅患者的病案、随访记录等方式收集胃癌患者的临床病理资料,主要包括:年龄、性别、原发病灶部位、病灶直径、组织学类型、分化程度、TNM分期、浸润深度、脉管癌栓有无、淋巴结转移有无、血清癌胚抗原(CEA)水平、血清甲胎蛋白(AFP)水平等。根据胃癌是否发生肝转移进行分组,比较不同分组的临床病理资料,归纳并总结胃癌肝转移患者的临床特征及相关危险因素。
1.4 统计学方法 采用SPSS 19.0软件进行统计学分析。计量资料用均数±标准差表示,两组间比较采用独立样本t检验;计数资料采用[例(%)]表示,两组间比较采用独立样本卡方检验,将胃癌肝转移患者临床病理因素进行单因素分析;筛选出差异有统计学意义的因素进行Logistics多因素回归分析。P<0.05为差异有统计学意义。
2 结果
2.1 胃癌肝转移患者临床病理因素单因素分析 对胃癌肝转移患者的临床病理特征进行单因素分析,结果显示,病灶直径大小(χ2=59.552,P<0.001)、分化程度(χ2=56.215,P<0.001)、TNM分期(χ2=47.744,P<0.001)、浸润深度(χ2=46.806,P<0.001)、有无脉管癌栓(χ2=10.022,P=0.002)、有无淋巴结转移(χ2=46.640,P<0.001)、血清CEA水平(χ2=55.163,P<0.001)、血清AFP水平(χ2=40.760,P<0.001)与胃癌发生肝转移有关(P<0.05)。性别、年龄、原发病灶部位、组织学类型与胃癌发生肝转移无相关性(P>0.05)(见表1)。

表1 胃癌肝转移患者临床病理因素单因素分析(例)
2.2 胃癌肝转移患者相关危险因素二元Logistic回归分析 以有无发生肝转移为因变量,将单因素分析中差异有统计学意义的危险因素:病灶直径大小、分化程度、TNM分期、浸润深度、有无脉管癌栓、有无淋巴结转移、血清CEA水平、血清AFP水平作为自变量纳入Logistic多因素回归分析,具体赋值见表2。二元Logistic回归分析结果显示:病灶直径大小(P=0.037)、分化程度(P=0.013)、TNM分期(P=0.027)、脉管癌栓有无(<0.001)、淋巴结转移有无(P=0.046)、血清CEA水平(P=0.039)是胃癌肝转移的独立危险因素。见表3。

表2 因变量和自变量赋值
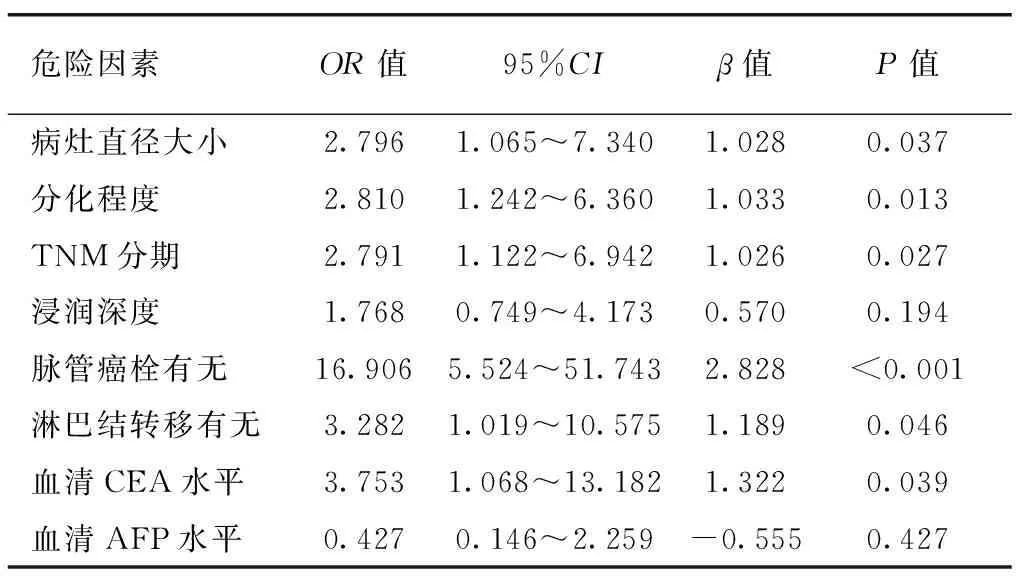
表3 胃癌肝转移相关危险因素的多因素分析
3 讨论
近年来,随着医疗水平的发展和人们健康意识的提高,胃癌早诊、早治,生存率显著提高,生存质量显著改善[8]。但中晚期胃癌,特别是胃癌伴随肝脏等器官转移的患者,往往预后差[9]。胃癌发生肝转移并非是由单一或者孤立的血管/微环境因素,或者生化因素引起,而是多种诱发因素和转移机制相互作用引发,转移方式主要有血液、淋巴,或原发癌细胞直接浸润/侵犯等[10]。有研究发现,肿瘤分化程度、TNM分期、浸润深度、脉管癌栓有无、淋巴结转移有无、血清CEA水平等多种因素与胃癌肝转移密切相关[11-12]。很多胃癌患者确诊时已经存在器官远处转移,尤其是肝转移多见,胃癌肝转移患者预后较差,5年生存率较低[13-14]。探讨胃癌患者肝转移的主要临床特征,总结发生胃癌患者肝转移的相关危险因素,可作为胃癌肝转移患者的临床诊断依据,从而达到早诊断、早治疗,改善患者生存质量的目的。
本研究单因素分析结果显示,病灶直径大小、分化程度、TNM分期、浸润深度、有无脉管癌栓、有无淋巴结转移、血清CEA水平、血清AFP水平与胃癌肝转移相关(P<0.05)。性别、年龄、原发病灶部位、组织学类型与胃癌肝转移无关(P>0.05)。Logistic多因素回归分析结果显示,病灶直径大小、分化程度、TNM分期、脉管癌栓有无、淋巴结转移有无、血清CEA水平是胃癌肝转移的独立危险因素(P<0.05)。肿瘤病灶直径越大,分化程度越差,胃癌患者发生器官转移的概率越大,预后越差[15]。TNM分期越晚,胃癌患者肝转移的风险越大[4]。这与本研究结果一致。CEA在健康人体中无表达或者及少量表达,但在多种肿瘤患者血清中表达升高[16]。刘毅等[17]研究发现,胃癌患者血清中CEA水平明显升高,可以作为癌细胞的血液循环载体,促进肿瘤的血行转移,大大增加了肝转移的风险。伴有淋巴结转移的胃癌患者,其淋巴结转移癌细胞侵犯门静脉,有可能导致血行转移,胃癌肝转移的风险增加。Kyriadilis等[18]在研究不同类型胃癌的微血管结构时发现,乳头状腺癌的胃癌,其癌细胞紧密附着在血管壁上,或者血管壁的周围,因此,认为脉管浸润也是胃癌肝转移的独立危险因素。这与Saiura等研究结果,胃癌细胞侵犯脉管,形成脉管癌栓是胃癌肝转移发生的危险因素相一致[19-21]。Kunieda等[22]研究显示,胃癌原发病灶浸润比较深时,其侵犯血管的概率越大,癌细胞通过血管/血液转移的可能性越高,因此,认为胃癌的浸润深度也是影响胃癌发生肝转移的重要因素。但Marrelli等[23]研究结果显示,胃癌发生肝转移与肿瘤浸润深度无明显相关性,与Kunieda等研究结果相反。本研究Logistic多因素回归分析结果也显示肿瘤浸润深度不是胃癌发生肝转移的独立危险因素,本研究结果与Marrelli等研究结果一致。在肿瘤浸润深度是否为胃癌发生肝转移的相关危险因素方面,仍需要进一步统计分析临床数据。
综上,胃癌肝转移的发生率虽然不高,但其预后非常差,死亡率高,胃癌肝转移的发生、发展较为复杂,受多种因素的影响。本研究通过分析胃癌患者多项临床病理指标,结果显示,病灶直径大小、分化程度、TNM分期、脉管癌栓有无、淋巴结转移有无、血清CEA水平是胃癌肝转移的独立危险因素。在临床工作中,合并相关危险因素的胃癌患者应注意肝转移的排查,提高胃癌肝转移诊断准确率,改善患者生存质量。本研究样本量有限,且为单中心,有一定的局限性,仍需要大样本、多中心的数据分析以总结更准确的危险因素。

