梯棱羊肚菌补充2次外源营养的栽培技术*
罗祥英 ,李梦杰 ,曹 瑶 ,杨林雷 ,沈真辉 ,李 健 ,李文芝 ,陆青青 ,杨晓君 ,李荣春 **
(1.云南菌视界生物科技有限公司,云南 昆明 651708;2.昆明市[食用菌]企业工程技术中心,云南 昆明 651708)
羊肚菌(Morchella spp.)隶属于子囊菌门(Ascomycota)盘菌纲(Discomycetes)盘菌目(Pezizales)羊肚菌科(Morchellaceae)羊肚菌属(Morchella)[1]。目前,羊肚菌属共有78个系统发育学物种,分别由黄色羊肚菌支系、黑色羊肚菌支系和变红羊肚菌支系3个类群构成;其中,黑色羊肚菌支系中的9个物种以及1个变红羊肚菌物种已实现了人工栽培[2-3]。
1982年Ower[4]在人工控制条件下成功栽培出羊肚菌,这是羊肚菌人工栽培历史上的一项重大成果,对羊肚菌产业发展产生了深远影响。此后,国内许多学者也纷纷展开了羊肚菌的研究,自此羊肚菌栽培研究进入了快速发展期。2005年美国DNP(Diversified Natural Products)公司进行羊肚菌商业化室内栽培,但于2008年停产[5]。2000年~2003年,四川省林业科学院研究团队将外源营养袋添加技术应用到羊肚菌的大田栽培,并取得成功,有效推动了我国羊肚菌商业化栽培的发展[6]。2012年开始,我国步入羊肚菌大田商业化栽培时代,到2020年,栽培面积从200 hm2增至1.4万公顷~1.5万公顷,我国成为了羊肚菌生产和出口第一大国[7-8]。随着营养袋应用技术越来越成熟,羊肚菌大田栽培技术越来越完善,羊肚菌的产量和稳定性较之前大幅度提高。
然而,在目前的规模化栽培过程中仍然存在很多问题,如大面积绝收、低产、产量不稳定等。造成这些问题的原因主要是基础科学研究滞后,栽培品种、栽培技术单一,对羊肚菌的营养特性、生活史、生态适应性方面没有完全掌握,对外源营养袋的作用机理不清楚等[5,9-10]。因此,目前除了不断加强基础研究,选育高产、适应性强、稳定性好的品种以外,还应通过探索新的栽培技术来推动羊肚菌产业稳健、快速发展。外源营养袋的应用是羊肚菌栽培技术中最重要的组成部分,也是羊肚菌大田商业化栽培成功的关键技术,但目前对其作用机理尚不清楚,栽培技术难以提升。
尽管已经有一些学者探索了新的栽培技术,但着重论证技术的可行性,并没有深入研究新技术对产量的影响[11-12]。前期通过15N同位素示踪技术,研究了羊肚菌人工栽培过程中外源氮素营养的运输机制,证明了外源营养中的氮素营养能够通过土壤中的菌丝网络,有效运输到羊肚菌子实体中供其生长发育;同时,阐明了营养袋的时(摆放时间)空(有效距离)有效性问题[13]。在此基础上,此次试验通过同位素示踪技术跟踪第2次外源营养的运输,探明补充第2次外源营养对产量的影响,深入探索羊肚菌补充2次外源营养的栽培技术,为羊肚菌产业发展提供参考。
1 材料与方法
1.1 供试菌株和同位素
梯棱羊肚菌(Morchella importuna)菌株JSJM15,由云南菌视界生物科技有限公司提供。15N-铵态硝酸铵,购自上海化工研究院。
1.2 培养基配方
母种培养基:马铃薯(去皮)200 g、葡萄糖20 g、磷酸二氢钾0.5 g、硫酸镁0.5 g、维生素B110 mg、琼脂粉18 g,加蒸馏水至1 000 mL,pH为6.0。
原种培养料:小麦70%、谷壳15%、麦麸5%、土壤8%、轻质碳酸钙1%、磷酸二氢钾0.5%、硫酸镁0.5%,含水量为45%。
栽培种培养料:麦粒56%、木屑12%、谷壳14%、土壤15%、蔗糖1%、轻质碳酸钙1%、磷酸二氢钾1%,含水量为45%。
营养袋:麦粒46%、木屑17%、谷壳18%、土壤18%、轻质碳酸钙1%,含水量为45%。
1.3 羊肚菌栽培管理
试验在云南菌视界生物科技有限公司基地进行,播种时间为2020年11月10日,从播种到采收周期为90 d。
原种和栽培种的制作参照参考文献[14]的方法。
清除土壤上的杂物,用石灰调土壤pH至6~7[15]。播种前先挖出宽10 cm、深5 cm的播种沟,再进行土壤预湿。将准备好的栽培种揉碎,以每平方米500 g的播种量,将菌种均匀撒在播种沟内,立即覆盖土壤,覆土厚度为3 cm~5 cm。播种10天后摆放营养袋。
菌丝培养阶段,保持土壤含水量为25%~30%,空气湿度为60%~75%;原基诱导阶段将土壤含水量增加至30%~40%;幼菇生长发育阶段将土壤含水量降低至25%~30%,空气湿度为80%~95%。
1.4 同位素示踪技术
氮素营养是羊肚菌生长发育的主要营养元素之一,研究证明,以硝酸铵为氮源时羊肚菌菌丝生长较好[16-18]。因此,试验采用15N-铵态硝酸铵同位素示踪技术,研究外源营养的运输。羊肚菌栽培管理方法同1.3所述。试验中外源营养补充及15N同位素标记情况详见图1。
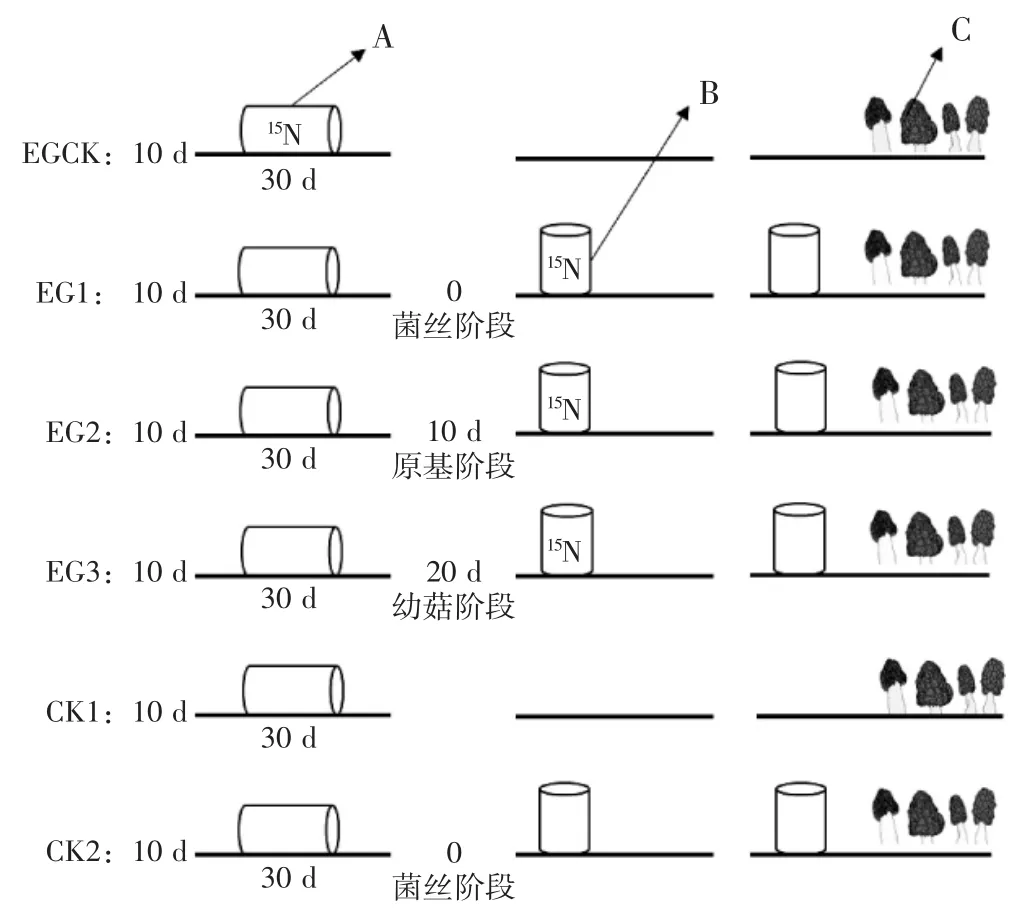
图1 外源营养补充及15N同位素标记示意图Fig.1 Schematic diagram of the supplement exogenous nutrition and15N isotope labeling
如图1所示,以只补充1次外源营养作为对照组(编号:EGCK),在播种后第10天开始补充1次外源营养,在外源营养中添加0.2 g·mL-1的15N-铵态硝酸铵溶液500 μL,并做好标记;以添加等量无菌水为对照组的空白对照(编号:CK1)。试验组处理为:在播种后第10天开始补充第1次外源营养,第1次外源营养袋内不添加15N-铵态硝酸铵溶液,营养袋摆放30 d后撤去第1次外源营养,同时分别在撤去第1次外源营养的当天(即播种后第40天,图1中时间记为0,编号EG1)、第10天(即播种后第50天,编号EG2)、第20天(即播种后第60天,编号EG3)补充新的外源营养(第2次外源营养),分别在第2次外源营养中添加0.2 g·mL-1的15N-铵态硝酸铵溶液500 μL,并做好标记;以添加等量无菌水为试验组的空白对照(编号:CK2)。每个处理均设置3个重复。
待羊肚菌菌盖表面蜂窝状凹陷充分伸展时即可开始采收,分别取距离营养袋边缘0~10 cm的新鲜子实体为样品,每个样品1.5 g(含菌盖和菌柄各0.75 g),重复取样10次。将样品混合、烘干、粉碎后送上海化工研究院检测15N丰度,具体方法参照国家标准《稳定性同位素15N无机标记化合物》(GB/T 20622-2006)[19]。
1.5 补充2次外源营养对羊肚菌产量的影响
对照组(编号:EGCK):在播种后第10天开始补充1次外源营养,每个营养袋湿质量为430 g,每平方米补充6袋,摆放至第30天时撤去外源营养。试验组:播种后第10天开始补充第1次外源营养,摆放至第30天撤去第1次外源营养;同时分别在撤去第1次外源营养的当天(即播种后第40天,编号EG1)、第10天(即播种后第50天,编号EG2)、第20天(即播种后第60天,编号EG3)补充新的外源营养。第2次外源营养采用350 mL广口瓶为容器,营养料湿质量为200 g/瓶,每平方米补充6瓶。每个处理均设置3个重复。羊肚菌栽培管理方法同1.3所述。以各个处理的原基发生时间、原基数量、幼菇成活率(2 cm以上幼菇生长发育为成熟菇的比例)、产量等为指标进行观测和统计,综合评价羊肚菌补充2次外源营养的栽培技术。
测量统计方法:播种后每天观察羊肚菌生长发育过程,以第1次发现原基为其原基发生时间;在原基发生后第5天统计原基数量。
2 结果与分析
2.1 外源营养的物质运输
待羊肚菌子实体成熟后,分别取距离营养袋边缘0~10 cm的子实体为样品,测定其15N丰度。不同处理下子实体中15N的丰度值详见图2。

图2 不同处理下成熟子实体中15N的丰度Fig.2 The15N abundance in mature fruit bodies under different treatments
如图2所示,对照组EGCK(0.815%)羊肚菌成熟子实体中15N的丰度值显著高于空白对照CKI(0.369%)。试验组EG1、EG2、EG3成熟子实体中15N的丰度值依次为1.330%、0.865%、0.386%,均高于空白对照CK2(0.373%);其中,EG1子实体中15N的丰度极显著高于空白对照CK2,EG2子实体中15N的丰度显著高于空白对照CK2。结果表明,2次补充的外源营养中的氮素营养均通过土壤中的菌丝网络吸收、运输到羊肚菌子实体中;在本试验条件下,在撤去第1次外源营养后10天内(此时处于菌丝阶段和原基阶段)补充第2次外源营养较佳。
2.2 补充第2次外源营养对羊肚菌产量的影响
分别在第1次营养袋撤离后的当天(EG1,菌丝阶段)、第10天(EG2,原基阶段)以及第20天(EG3,幼菇阶段)补充第2次外源营养。不同处理原基发生时间、数量、幼菇成活率及产量情况详见表1、图3和图4。
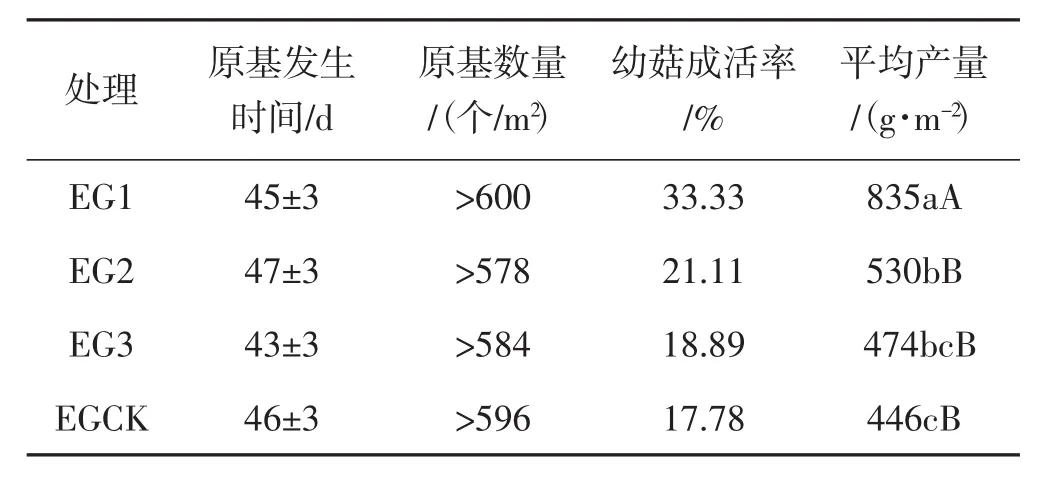
表1 不同处理中梯棱羊肚菌的生长情况Tab.1 The growth of Morchella importuna in different treatments
如表1、图3和图4所示,不同处理下原基发生时间均为40 d~50 d,与对照组EGCK相比差异不显著;原基数量与对照组EGCK之间差异不显著。试验组EG1、EG2、EG3幼菇成活率依次为33.33%、21.11%、18.89%,均高于对照组EGCK(17.78%);平均产量依次为 835 g·m-2、530 g·m-2、474 g·m-2,均高于对照组EGCK(446 g·m-2)。其中处理EG1的平均产量极显著高于对照EGCK;处理EG2的平均产量显著高于对照EGCK;处理EG3的产量与对照差异不显著。在出菇阶段,处理EG1及EG2羊肚菌成熟子实体的密度显著大于对照组EGCK。
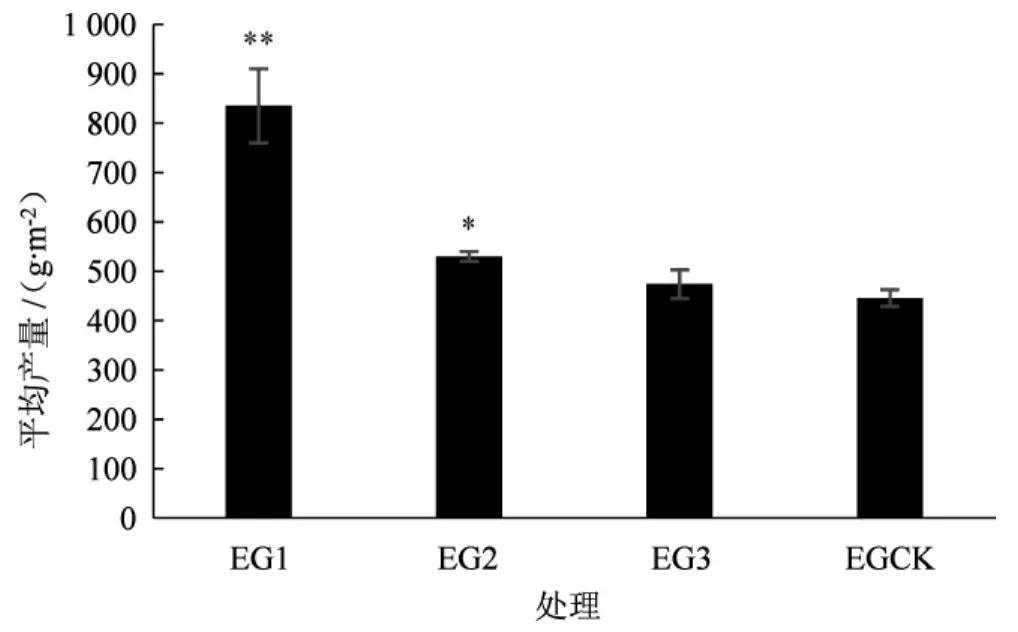
图3 不同处理下梯棱羊肚菌的平均产量Fig.3 Average yield of Morchella importuna under different treatments

图4 不同处理下梯棱羊肚菌的出菇情况图Fig.4 The figure of Morchella importuna.fruiting under different treatments
综上所述,在本试验条件下,梯棱羊肚菌播种后第40天~第50天(此时处于菌丝阶段和原基发生阶段)补充第2次外源营养效果最佳,其外源营养中的氮素营养物质能够有效运输到子实体中,并显著提高产量。
3 结论与讨论
羊肚菌是目前人工栽培食用菌中较特殊的一类大型真菌,也是为数不多的成功实现商业化栽培的子囊菌之一。羊肚菌为兼性(腐生和菌根)真菌,各品种在不同生境下经历着不同的演化过程,一些种类具有确定的菌根型生态类型,而另一些种类又具有完整的腐生型生态类型[20-22]。随着羊肚菌产业的不断发展,理论基础研究的进一步深入,对羊肚菌的生活史逐渐明晰。杜习慧等[23]认为羊肚菌有性生殖模式以异宗配合为主,还包括了假同宗配合和同宗配合;刘伟等[24-25]认为梯棱羊肚菌有“同宗结合”现象,又通过出菇试验和交配型基因分析证明梯棱羊肚菌为异宗结合真菌;贺新生等[26]指出羊肚菌完全能够单孢出菇;柴红梅等[27]推测梯棱羊肚菌是一种特殊的假同宗子囊菌。
在羊肚菌栽培技术研究方面,目前大规模商业化栽培仍然以依托外源营养袋进行室外大田、大棚栽培为主,栽培技术上基本没有很大的创新,且实践中仍然存在大面积栽培区域不出菇或产量低的情况,栽培风险高,虽然也探索了一些新的栽培模式,但尚未进行大规模商业化栽培推广及验证[2,6,11-12]。
不断完善羊肚菌外源营养栽培技术,解析外源营养的作用机制可有效保证羊肚菌实现稳产、高产。但目前对羊肚菌外源营养的作用机制研究较少。唐昊等[28]对梯棱羊肚菌分解利用外源营养袋的过程进行多组学结合生理生化分析,认为营养袋的主要作用是向土壤中的羊肚菌菌丝提供碳源,却几乎不向土壤产生氮的净输出。试验前期通过15N同位素示踪技术研究了羊肚菌人工栽培过程中外源氮素营养的运输机制,证明了外源氮素营养能够有效运输到子实体中供其生长发育,同时,阐明了营养袋的时(摆放时间)空(有效距离)有效性问题。本研究在此基础上进一步研究了梯棱羊肚菌补充2次外源营养的栽培技术。结果表明,第1次及第2次补充的外源营养中的氮素营养都能够被土壤中的菌丝网络吸收,并运输到羊肚菌子实体中;试验条件下,在梯棱羊肚菌播种后的第40天~第50天(此时处于菌丝阶段和原基发生阶段)补充第2次外源营养,其外源氮素营养物质能够有效运输到羊肚菌子实体中,并显著提高产量。这一结论将为羊肚菌产业发展提供更多的参考,为羊肚菌栽培技术创新、有效实现稳产和高产方面提供一定的理论依据。
羊肚菌栽培技术的研究,特别是在外源营养的作用机制、营养生长向生殖生长转变的因素、羊肚菌与土壤和环境的适应性等方面的研究还比较薄弱,在今后的研究中需进一步加强。试验过程中还发现羊肚菌在完成采收后,土壤自然恢复1个星期,再重新补充外源营养能够促进土壤中的菌丝再次萌发和聚集,在环境条件适宜时能够形成原基并分化成幼菇。这些现象同样表明在环境适宜时连续补充外源营养能够连续收获子实体,但补充外源营养的次数、时间、数量、方式等还有待进一步深入研究。

