尿液10项肾损伤标志物检测试剂的性能评价
张婵媛,徐珊珊,王学晶
(1.民航总医院检验科,北京 100123;2.北京利德曼生化股份有限公司技术服务部,北京 102600)
肾损伤标志物对于肾脏损伤的早期诊断、鉴别诊断和病情评估非常重要,尿清蛋白(albumin,u-Alb)是应用最广泛的肾损伤标志物[1],其在不同检测系统间的一致性在中间浓度范围内(20~400 mg/L)较为理想[2]。此外,还有其他临床常用的尿液标志物,如有反映肾小球滤过屏障损伤的尿液转铁蛋白(transferrin,u-Trf)、免疫球蛋白G(immunoglobulin G,u-IgG),反映肾小管细胞损伤的中性粒细胞明胶酶相关脂质运载蛋白(neutrophil gelatinase-associated lipocalin,u-NGAL)、N-乙酰-β-D-氨基葡萄糖苷酶(N-Acetyl-β-D-glucosaminidase,u-NAG),反映肾小管重吸收功能损伤的α1微球蛋白(α1-microglobulin,u-α1MG)、视黄醇结合蛋白(retinol binding protein,u-RBP)、β2微球蛋白(β2-microglobulin,u-β2MG)、半胱氨酸蛋白酶抑制剂C(cystatin C,u-CysC)等。尿液物质浓度个体间差异非常大,可达上万倍,故准确检测需要了解检测试剂的线性范围以制定科学的前处理方法。此外,肾脏疾病常出现血尿等干扰检测的情况,故验证抗血红蛋白干扰的性能也非常重要。截至目前,较为全面系统的评价尿液常见标志物性能的研究报道尚不多[3-4]。此外,检测系统间的可比性研究也较少。随着标志物在泌尿系统疾病诊断、监测和评估中的作用越来越重要,制定基于这些标志物的临床共识或指南也迫在眉睫,这就需要检测结果的可比性及互认性。
本研究拟系统评估北京利德曼公司尿液10项肾损伤标志物检测系统的性能,观察其临床适用性及与另外较为公认检测系统的一致性。
1 材料与方法
1.1标本来源
1.1.1性能评估 收集2021年7月至12月民航总医院患者和体检健康者新鲜尿液标本。
1.1.2比对 收集2021年7月至12月民航总医院无血、脓的新鲜尿液标本40份。
1.2仪器与试剂 7600全自动生化分析仪(日本日立公司)上装载u-α1MG、u-TP、u-IgG、u-Alb、u-NGAL、u-CysC、u-RBP、u-β2MG、u-NAG、u-Trf(北京利德曼公司)和u-NAG(柏定生物工程公司)检测试剂。IMMAGE 800特种蛋白分析仪(美国贝克曼库尔特公司)上装载u-α1MG、u-IgG、u-Alb、u-Trf检测试剂。校准品和质控品均为与试剂配套产品。
1.3性能验证
1.3.1正确度 依据美国临床和实验室标准协会(CLSI) EP15-A3文件[5]所提供方案,通过检测参考物质的偏倚来评价各试剂的正确度。复融ERM-DA470k、ERM-DA471、B2M-NIBSC等参考物质及纯度物质(见表1),重复检测3次,计算偏倚。

表1 尿液10项肾损伤标志物的参考物质及纯度物质
1.3.2不精密度 依据CLSI EP15-A3文件[5]所提供方案,分别检测高、低2个水平的质控品,连续检测5 d,每天检测4次。计算各水平重复性及室内不精密度。
1.3.3线性范围 其中8项尿液蛋白质(u-α1MG、u-Alb、u-NGAL、u-RBP、u-β2MG、u-NAG、u-Trf、u-TP)用一份低浓度混合尿液(L)、一份高浓度混合尿液(H)及生理盐水(S),按0.25L∶0.75S、0.5L∶0.5S、1.0L、0.1H∶0.9L、0.2H∶0.8L、0.3H∶0.7L、0.4H∶0.6L、0.5H∶0.5L、0.6H∶0.4L、0.7H∶0.3L、0.8H∶0.2L、0.9H∶0.1L、1.0H,配成13个浓度梯度的混合样本。其预期浓度按照公式:x=(CL×VL+CH×VH)/(VL+VH)计算,其中C为浓度,V为体积。从低到高各测3次,记录检测结果。按照CLSI EP06[6]文件提供的方案初步检查数据,检查离群值,判断重复性,之后进行多元线性回归,将结果分别拟合1次、2次、3次多项式,并绘制散点图进行评价[7-8]。因高浓度u-IgG、u-CysC尿液留取较难,故是用一份低浓度混合尿液(L)、一份高浓度混合尿液(添加≤2%血清)配制而成,其余操作与上文一致。
1.3.4稀释验证试验 1份混合标本用生理盐水进行系列稀释(1∶2、1∶4、1∶8、1∶16),双份检测,计算均值乘以稀释倍数的结果与原倍血清检测结果的偏差百分比。
1.3.5干扰试验 参考CLSI EP07[9]文件提供的方案,将不同浓度血红蛋白加入到高、低浓度的两份尿液中,观察干扰物对检测结果的影响。尿液中血红蛋白终浓度分别为8、4、2、1、0.5、0.25、0.125 g/L。以原始样本结果为准,以超过±10%为标准判断是否存在干扰。
1.3.6方法学比对 分别用本实验室现用检测试剂和北京利德曼公司试剂检测40份患者新鲜尿液5种尿液标志物(u-α1MG、u-IgG、u-Alb、u-NAG、u-Trf)。其中,本实验室现用检测试剂包括贝克曼试剂(u-α1MG、u-IgG、u-Alb、u-Trf)和柏定生物试剂(u-NAG)。参考CLSI EP09文件[10]提供的方案,评估不同检测系统间检测结果的一致性。
1.4统计学分析 用Microsoft Excel 2020及SPSS 20.0软件进行。采用K-S正态分布检验检查数据正态性。正态分布的数据用均数±标准差表示;相关性分析采用Pearson相关分析,线性回归采用简单线性回归分析;以P<0.05为有统计学意义。
2 结果
2.1正确度 见表2。测定10项尿液标志物低、中、高值标准物质的偏倚分别为-2.69%~4.67%、-3.60%~3.33%、-2.38%~3.02%。
表2 尿液10项肾损伤标志物试剂正确度验证结果
2.2不精密度 见表3。尿液10项肾损伤标志物的重复性以不精密度表示,低值的不精密度为1.90%~5.43%,高值为0.63%~2.42%;低值的室内不精密度为2.27%~5.63%,高值为1.09%~3.41%之间;均小于试剂盒声明的不精密度。

表3 尿液10项肾损伤标志物试剂不精密度验证结果
2.3线性范围和稀释验证试验 尿液10项肾损伤标志物线性检测理论值与实测值拟合方程中斜率a在0.98~1.08之间,截距b在-25.00~0.09之间,相关系数(r)为0.992~0.999之间,均大于0.975,说明线性良好。尿液10项肾损伤标志物试剂最大稀释倍数除u-Trf为8倍,其他均为16倍,每种标志物的线性范围和临床可报告范围见表4。

表4 尿液10项肾损伤标志物试剂线性范围和稀释度验证
2.4干扰试验 尿液中血红蛋白终浓度≤8 g/L时对u-α1MG、u-Alb未产生明显干扰,≤4 g/L时对u-β2MG、u-Trf未产生明显干扰,≤2 g/L时对u-CysC未产生明显干扰,≤1 g/L时对u-NAG未产生明显干扰,而血红蛋白终浓度≥0.125 g/L时,u-TP、u-IgG、u-RBP、u-NGAL即受干扰。
2.5一致性评估 Bland-Altman偏倚图见图1。不同检测试剂u-Trf、u-NAG、u-Alb、u-IgG、u-α1MG结果间差值的平均偏倚(95%置信区间)为-26.9%(-68.4%~14.6%)、48.3%(-9.5%~106.0%)、1.0%(-34.3%~36.3%)、-12.6%(-72.7%~47.6%)、142.8%(108.5%~177.0%)。
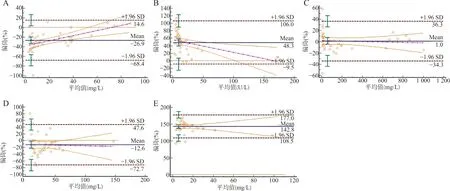
注:A~E分别为u-Trf、u-NAG、u-Alb、u-IgG、u-α1MG。图1 本室现用检测试剂与北京利德曼公司试剂检测5种尿液标志物的一致性的Bland-Altman偏倚图
3 讨论
目前市面上的尿液检测试剂盒种类繁多,标准化程度不一,线性范围参差不齐,因而有必要在使用试剂盒前进行性能评价,尤其是正确度、精密度、线性范围和抗干扰性能,以保证检测结果准确。尿液10项肾损伤标志物在高、低浓度下的不精密度均≤5.63%,说明目前国产试剂盒稳定性良好。正确度评价中,u-Trf、u-IgG、u-Alb、u-CysC、u-β2MG、u-TP项目选取了国际有证参考物质ERM-DA470k、ERM-DA471、B2M-NIBSC、SRM-927,u-α1MG、u-NGAL、u-RBP项目选取了α1-MG、NGAL、RBP纯品,正确度评价结果满足临床要求。采用国际标准物质所获得的正确度可靠性高,良好的一致性和可比性容易达到,有助于国家卫生健康委结果互认的推进。然而,部分项目因缺乏可靠的溯源方法,其系统间检测结果的差异比较大。本研究中不同检测系统间比对也验证了这一点,溯源至ERM-DA470k的u-IgG、u-Alb一致性良好,u-Trf在中间范围内一致性良好;而没有标准物质可溯源的u-α1MG和u-NAG一致性较差。
尿液标志物浓度变化非常大,要求检测系统的线性范围至少要涵盖大部分临床常见的浓度范围。我院实验室信息系统数据显示,一段时间内u-IgG的检测结果范围为0~993 mg/L,u-α1MG为0~99.4 mg/L,u-Trf为0~757 mg/L,u-NAG为0~180.5 U/L,u-Alb为0~11 240 mg/L,评估结果显示,上述尿液标志物的线性范围较宽,可以涵盖绝大多数病理生理状态下的尿蛋白浓度水平,可稀释倍数也较高,能够满足高值样本准确测量的要求。然而,u-Alb浓度范围0~11 240 mg/L、u-Trf浓度范围0~757 mg/L,提示临床常见浓度很容易超出试剂的检测上限。建议测量u-Alb和u-Trf前,先用磺柳酸定性,再选择合适的稀释倍数稀释后测量。
血尿在肾病患者中较为常见,因此本研究重点评价了血红蛋白的干扰。研究表明,u-Alb检测时尿中血红蛋白和胆红素对u-Alb检测均呈负干扰[11]。本研究试剂多采用免疫比浊法或胶乳免疫比浊法,对于血红蛋白产生的颜色效应的抗干扰能力较强。本研究发现,u-α1MG、u-Alb、u-β2MG、u-Trf、u-CysC、u-NAG未见明显血红蛋白的干扰。之前研究报道尿红细胞或尿血红蛋白对尿蛋白检测存在干扰,但多数是对u-Alb的定性检测结果的评价[12],尿液蛋白定量检测前可通过离心去除红细胞干扰,本研究发现当血红蛋白浓度为0.125 g/L时,仍然对u-TP、u-IgG、u-RBP检测结果存在明显干扰,且随血红蛋白浓度的增加呈正干扰,而对u-NGAL检测结果呈负干扰。干扰的主要原因可能来自于血红蛋白的色源干扰,并且还与红细胞的组成有关,由于干扰实验的血红蛋白是通过溶解红细胞得到的,可能红细胞膜和内部结构物质会对检测造成一定影响。本研究的缺陷在于仅评价了血红蛋白的干扰,下一步将对总蛋白、单克隆免疫球蛋白和浊度等其他物质的干扰进行分析。
综上所述,10种尿液标志物检测试剂正确度和精密度良好,线性范围宽,稀释准确性满足临床需要,大部分试剂抗血红蛋白干扰能力较强。一致性方面,不同检测系统间尿液标志物测量结果存在一定差异。实验室在使用前应重点评估试剂盒的正确度、线性范围和抗干扰能力,以保证检验结果一致化和标准化,为相关指南和共识提供一致可比的实验室信息。

