高效液相色谱-串联质谱法在检测绝经后妇女血清中雌激素及其代谢物中的应用
杨娜,陈捷,李美娟,葛佳佳,张潇莉,王敏,朱怀军,成晓亮,顾林,葛卫红
(1.南京大学医学院附属鼓楼医院药学部,南京 210008;2.南京市妇幼保健院妇科内分泌科,南京 210001;3.南京品生医疗科技有限公司研发中心技术部,南京 210032)
雌激素是一种类固醇激素,在体内由上游雄激素通过芳香化酶代谢生成并通过细胞色素P450酶[1]、甲基转移酶[2]、葡萄糖醛酸转移酶[3]、磺基转移酶等酶类进一步发生下游代谢,如图1。除雌二醇(estradiol,E2)外,多种雌激素代谢物均具有生物学活性,并与相关疾病的发生发展密切相关[4-5]。

注:E1,雌酮(estrone);E2,雌二醇(estradiol);E3,雌三醇(estriol);16-keto-E2,16-酮雌二醇(16-ketoestradiol);16Epi,16-表雌三醇(16-epiestriol);17Epi,17-环雌三醇(17-epiestriol);2OHE1,2-羟基雌酮(2-hydroxyestrone);4OHE1,4-羟基雌酮(4-hydroxyestrone);16OHE1,16α-羟基雌酮(16α-hydroxyestrone); 2OHE2,2-羟基雌二醇(2-hydroxyestradiol);4OHE2,4-羟基雌二醇(4-hydroxyestradiol);2MeOE1,2-甲氧基雌酮(2-methoxyestrone);4MeOE1,4-甲氧基雌酮(4-methoxyestrone);2MeOE2,2-甲氧基雌二醇(2-methoxyestradiol); 4MeOE2,4-甲氧基雌二醇(4-methoxyestradiol);-G/S,各类雌激素葡萄糖醛酸结合/硫酸结合型代谢物。图1 雌激素代谢网络
绝经期妇女卵巢功能衰退导致雌激素水平显著下降(可低至1 pg/mL以下),可进一步影响机体神经系统[6]、心血管系统[7]和骨代谢系统[8]进而诱发绝经期综合症。研究发现,绝经期雌激素及代谢物的水平与并发症的发生风险密切相关[9]。E2水平低于5 pg/mL的绝经后妇女髋部和椎骨骨折风险增加2.5倍[10]。绝经后患骨关节炎妇女血清中2-羟基雌二醇(2-hydroxyestradiol,2OHE2)水平显著高于无骨关节炎妇女[11]。同时,血清雌激素2位碳和4位碳羟基化代谢产物、甲基化代谢产物水平与绝经后妇女子宫内膜癌发病风险密切相关[12]。因此,建立可同时检测雌激素及其代谢物的高灵敏度测定方法对于监测绝经后妇女体内雌激素整体水平、研究及预判相关并发症的发病风险、寻找并发症生物学标志物以及实施激素替代疗法后风险与获益的评估均具有重要意义。
然而现阶段免疫测定法最常用于类固醇的检测,其灵敏度低、特异性差、测定种类少[13]。本研究基于柱前衍生化前处理技术建立了一种高灵敏度的高效液相色谱-串联质谱法(liquid chromatography tandem mass spectrometry, LC-MS/MS),直接检测雌激素代谢通路中包括羟化、甲基化等13类游离型雌激素代谢物,结合酶解法分别检测各类雌激素在血清中的总量,间接计算13类葡萄糖醛酸结合/硫酸结合型雌激素代谢物(-glucuronide/sulfate,-G/S),并在绝经后妇女血清样本中进行验证。
1 材料与方法
1.1主要仪器与试剂 Waters UPLC Ⅰ-Class/Xevo TQS超高效液相质谱联用仪、Waters BEH C18 columns(美国Waters公司);DW-HL340超低温冰箱(美国Thermo Fisher公司);TGL-16.5M冷冻离心机(上海卢湘仪离心机仪器公司);CV200真空浓缩仪(北京吉艾姆科技公司);XMTD-8222恒温水浴锅(上海精宏实验设备公司)。雌酮(estrone,E1,批号:00849-200501)、E2(批号:100182-201205)、雌三醇(estriol,E3,批号:100934-201302)购自中国食品药品检定研究院(纯度均大于96%);16-表雌三醇(16-epiestriol,16Epi,纯度96%,批号:29-AZC-158-2)、17-环雌三醇(17-epiestriol,17Epi,纯度95%,批号:20-THT-39-2)、2-羟基雌酮(2-hydroxyestrone,2OHE1,纯度98%,批号:3-SBT-43-2)、16α-羟基雌酮(16α-hydroxyestrone,16OHE1,纯度97%,批号:3-CGF-67-6)、2OHE2(纯度96%,批号:6-SBT-57-6)、2-甲氧基雌酮(2-methoxyestrone,2MeOE1,纯度98%,批号:2-AKS-176-1)、4-甲氧基雌酮(4-methoxyestrone,4MeOE1,纯度97.72%,批号:1-SRE-175-1)、2-甲氧基雌二醇(2-methoxyestradiol,2MeOE2,纯度98%,批号:1-GNM-86-4)、4-甲氧基雌二醇(4-methoxyestradiol,4MeOE2,纯度98%,批号:4-YKZ-7-1)、雌酮-d4(estrone-d4,E1-d4,纯度98.4%,批号:2-RVK-138-4)购自加拿大TRC公司;4-羟基雌酮(4-hydroxyestrone,4OHE1,纯度90%,批号:MKCG7392)、丹磺酰氯(批号:03641)、L-抗坏血酸(批号:SLBM0850V)、β-葡萄糖醛酸苷酶/芳基硫酸酯酶液(来自Helix pomatia,Type HP-2,批号:50783523)购自美国Sigma公司;醋酸钠、叔丁基甲醚购自阿拉丁公司;甲醇、乙腈(色谱纯)购自德国Merck公司。
1.2方法
1.2.1储备液和工作液配制 分别精密称取E1、E2、E3、16Epi、17Epi、2OHE1、4OHE1、16OHE1、2OHE2、2MeOE1、4MeOE1、2MeOE2、4MeOE2及内标E1-d4的对照品粉末各2 mg,分别置入20 mL容量瓶中,加入含5 mmol/L L-抗坏血酸的甲醇溶液定容,颠倒摇匀配成各类雌激素及内标终浓度为100 μg/mL的储备液后,将各类雌激素储备液混合,制成混合标准曲线工作液。内标储备液采用含L-抗坏血酸的甲醇溶液逐级稀释至0.2 ng/mL,-20 ℃储存。
1.2.2血清样品处理 200 μL血清样品置于1.5 mL EP管中,加入20 μL内标工作液,涡旋5 s,加入900 μL叔丁基甲醚,振荡5 min,然后21 530×g离心5 min;转移EP管中的上清液750 μL至1.5 mL EP管中,氮气吹干,加入50 μL硼酸缓冲液(pH 10.0),再加入丙酮溶解的丹磺酰氯衍生化溶液50 μL(1 mg/mL)。涡旋10 s,然后将样品放置在65 ℃烘箱中5 min衍生化反应,完成后室温放置,21 530×g离心3 min,吸取70 μL上清液于进样小瓶中待进样。
1.2.3血清β-葡萄糖醛酸苷酶/芳基硫酸酯酶水解 配制0.15 mol/L醋酸钠缓冲液(pH 4.1),并用该缓冲液配制含4 mg/mL抗坏血酸缓冲液。取2 mL EP管,于200 μL血清样品中加入198 μL上述含抗坏血酸缓冲液以及2 μL β-葡萄糖醛酸苷酶/芳基硫酸酯酶液,充分混匀,振荡样品后于37 ℃水浴锅温浴20 h。酶解后样品测定结果为总雌激素,“1.2.2项”未酶解样品测定结果为游离型雌激素,计算两者差值可得葡萄糖醛酸结合/硫酸结合型雌激素(-G/S)。
1.2.4色谱条件 对液相条件进行优化,结果显示Waters BEH C18 columns(2.1 mm×100 mm,1.7 μm)色谱柱对各类雌激素具有较好的分离效果。流动相A相为含有0.05%甲酸和2 mmol/L甲酸铵的水溶液,流动相B相为含有0.05%甲酸和2 mmol/L甲酸铵的甲醇溶液,流速为0.3 mL/min。梯度洗脱程序为0.0~4.1 min:78% B相;4.1~4.2 min:78%~81% B相;4.2~5.0 min:81% B相;5.00~5.01 min:81%~78% B相;5.01~7.0 min:78% B相。柱温为50 ℃,整个运行时间为7 min,进样体积为10 μL。
1.2.5质谱条件 UPLC Ⅰ-Class/Xevo TQS液质联用系统;离子源:电喷雾离子源正离子模式(ESI+);多重反应监测(MRM);毛细管电压为1 kV;源温度:150 ℃;雾化气温度:400 ℃;雾化气流速:800 L/h;锥孔气流速:150 L/h。分别对13种雌激素及内标的母离子、子离子、锥孔电压和碰撞能量进行逐一优化和确认,使目标化合物具有最高灵敏度,见表1。

表1 MRM离子参数
1.3方法性能评价
1.3.1标准曲线和定量下限(LOQ) 参考内源性物质测定方法[14],配制终浓度为1、2、4、10、20、100、200、500 pg/mL标准曲线,按“1.2.2血清样品处理”操作后进行质谱定量分析。采用TargetLynx软件分别以各种雌激素浓度为横坐标(X),目标峰面积与内标峰面积比值为纵坐标。最小二乘法进行线性回归(权重1/X)。选择最低浓度样品,同时满足3个批次且每个批次平行6份样品,总相对标准偏差(relative standard deviation,RSD)<20%、准确度<15%且信噪比>10则为本方法的LOQ。
1.3.2精密度 配制低、中、高3个水平血清基质混合质控样品,每个批次每个浓度平行6个样品,连续测定3个批次(3 d),样品总数共54份,按“1.2.2血清样品处理”操作后进行质谱定量分析,计算每个浓度同一批次内6个样品(批内)和3个批次(批间)的RSD,若RSD<15%则满足测定要求。
1.3.3加标提取回收率 参考临床检测方法的开发与验证[15],选取一份已知浓度的血清基质样品作为原始样品,分别向该样品中加入低、中、高浓度的混合雌激素对照品溶液,制备3个浓度的加标样品,原始样品及每个浓度加标样品平行6份,每份重复测定3次,按“1.2.2血清样品处理”后进行质谱定量分析,计算各个浓度下的加标回收率,若加标回收率在±15%内,则本方法正确度符合要求。
1.3.4稳定性 配制低、中、高3个水平的血清基质混合质控样品,按“1.2.2血清样品处理”操作,分别考察血清样品处理前在室温放置2、4、6 h的稳定性,血清样品处理前在4 ℃冰箱放置24、36、48 h的稳定性,血清样品处理前反复冻融3次(-80 ℃→25 ℃)稳定性,血清样品处理后进样盘放置12、24 h稳定性,其中每个浓度平行3个样品,分别计算每个浓度样品在上述相应处置方式下的稳定性。
1.4绝经后妇女血清样品分析 收集2021年于南京市鼓楼医院和南京市妇幼保健院体检的绝经后妇女血清样品29份,每份1 mL。纳入标准:(1)年龄为55~65周岁;(2)绝经1年以上;(3)近3个月未使用激素类药品;(4)子宫、卵巢与乳腺无恶性疾病;(5)心肝肾功能检查均正常。排除标准:(1)有精神类疾病;(2)糖尿病、甲状腺功能亢进、心脑血管疾病患者。将收集的血清样品按“1.2.2血清样品处理”操作进行质谱定量分析。
1.5统计学分析 采用SPSS 25.0统计软件进行。绝经后妇女血清样品结果采用Shapiro-Wilk法进行正态性检验,非正态性数据用M(P25,P75)表示。
2 结果
2.1雌激素及代谢物的代表色谱图 各类激素的峰形保留时间见图2,分别为3.95 min(E1)、4.38 min(E2)、2.28 min(E3)、2.83 min(16Epi)、3.01 min(17Epi)、5.72 min(2OHE1)、6.05 min(4OHE1)、2.34 min(16OHE1)、6.15 min(2OHE2)、3.50 min(2MeOE1)、3.84 min(4MeOE1)、3.94 min(2MeOE2)、4.08 min(4MeOE2)。各类雌激素峰形良好。其中,2MeOE2与4MeOE2是同分异构体,结构特性接近,在多种型号规格的色谱柱上分离度相对较弱,本法采用的液相色谱条件为现阶段摸索最优色谱条件,重叠峰的交点位于小峰的半峰高之下,定量产生的误差相对较小,相关方法性能评价结果满足定量要求。此外,其他各类同分异构体在此条件下均有相对较好的分离,且相互未产生干扰。经验证各类雌激素在该方法下特异性良好。

注:A、B为E1、E2色谱图,C为E3、16Epi、17Epi色谱图,D为2OHE1、4OHE1色谱图,E、F为16OHE1、2OHE2色谱图,G为2MeOE1、4MeOE1色谱图,H为2MeOE2、4MeOE2色谱图。图2 LC-MS/MS测定13种雌激素色谱图
2.2标准曲线和定量下限 E1、E2、16Epi、4OHE1、16OHE1、2MeOE1、4MeOE1、4MeOE2的定量下限为1 pg/mL,E3、17Epi、2OHE1、2OHE2、2MeOE2的定量下限为2 pg/mL。在线性范围内,13种雌激素线性关系良好,且相关系数(r)均大于0.99,定量下限6次平行样本测定RSD均<20%。
2.3精密度 本方法下测定的各类雌激素批内和批间精密度RSD均在15%以内(表2),满足生物样本测定相关要求。
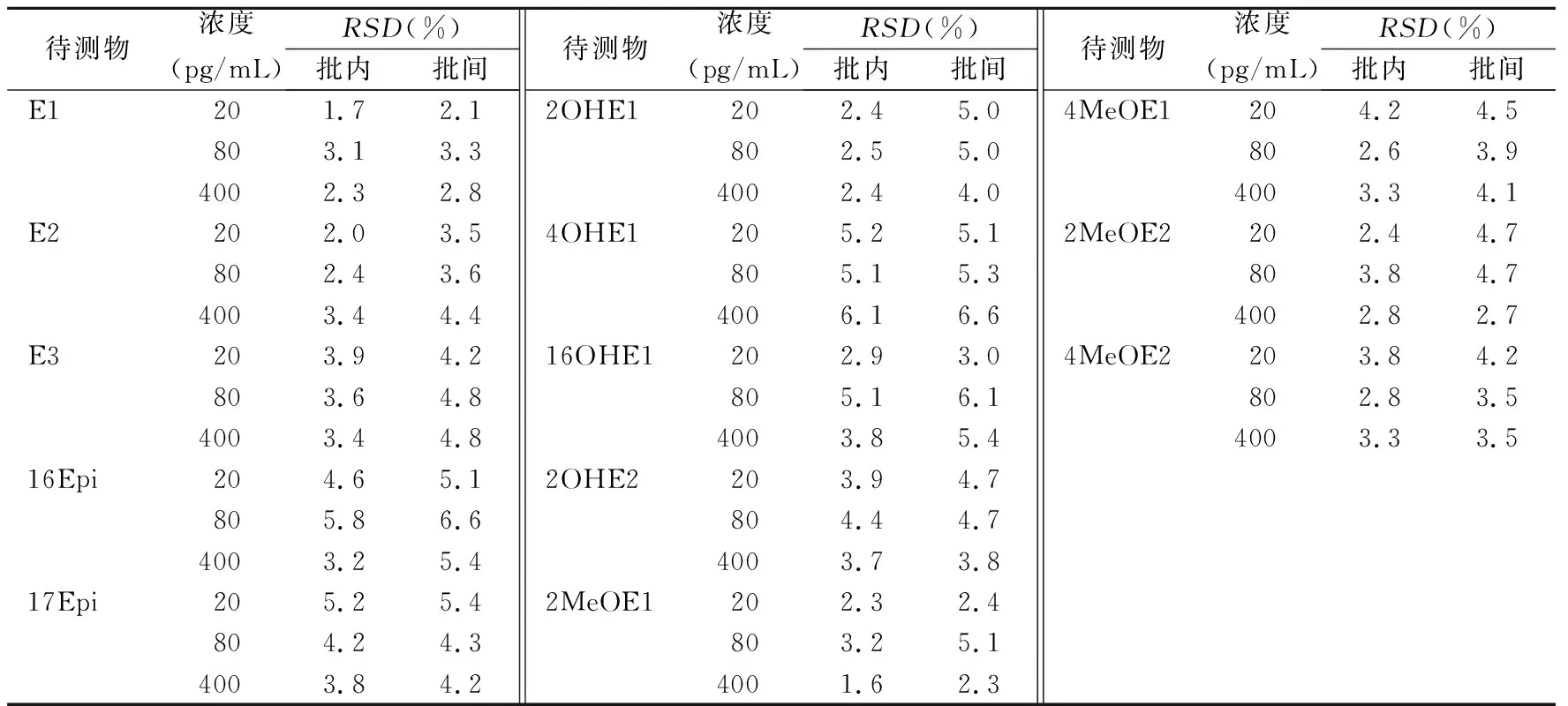
表2 各类雌激素批内/批间精密度
2.4加标提取回收率 各雌激素平均回收率均在90.3%~111.3%之间,见表3,说明该方法准确性较高。
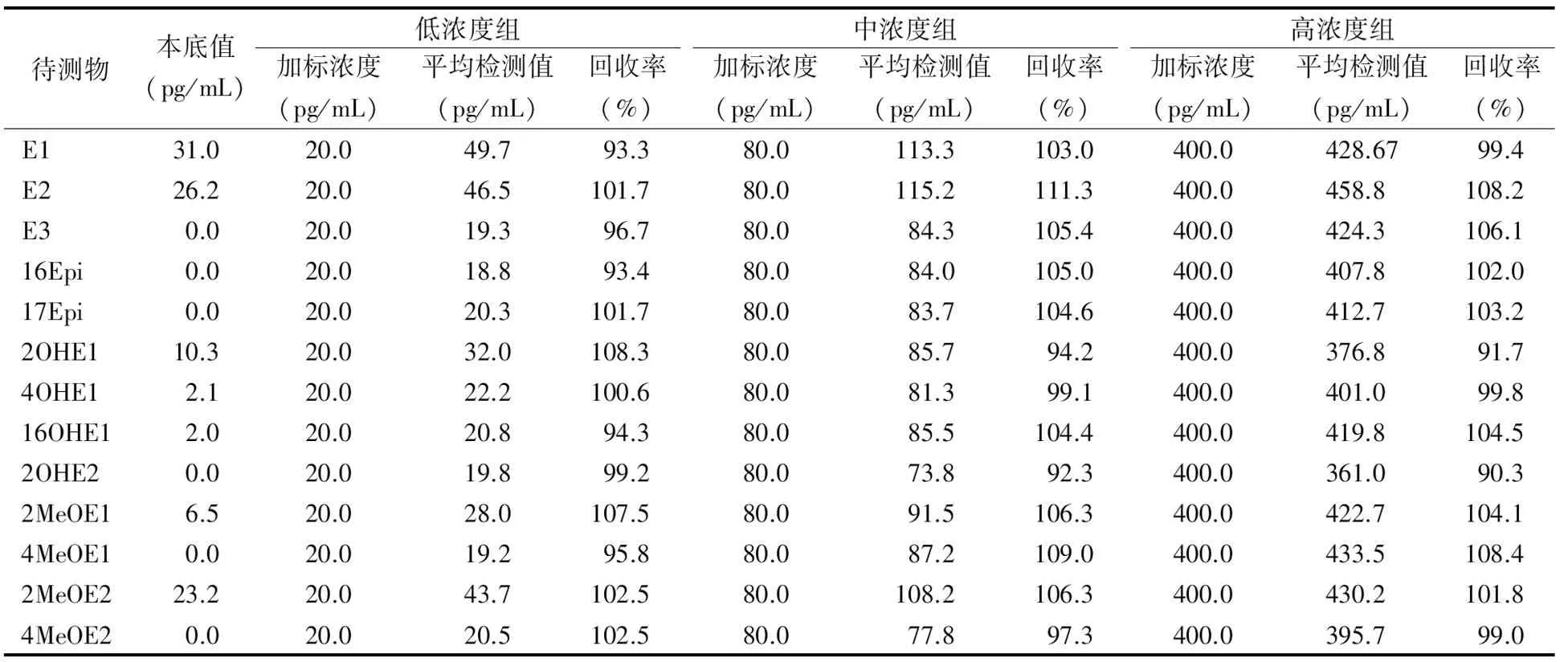
表3 各类雌激素加标提取回收率
2.5稳定性 含各类雌激素低、中、高浓度的血清样品衍生化处理前在室温放置2、4、6 h,或血清样品处理前在4 ℃冰箱放置24、36、48 h以及血清样品处理前反复冻融3次(-80 ℃→25 ℃)均稳定,RSD不超过±15%。血清样品处理后进样盘放置12、24 h均稳定,RSD均不超过±15%。
2.6绝经后妇女血清样品分析 见表4。结果显示,绝经后妇女血清中E2处于较低水平,E1-G/S中位浓度为158.7 pg/mL,在所有雌激素中水平最高,且为游离型的14倍。16OHE1-G/S中位水平仅次于E1-G/S。2-羟化和16-羟化代谢通路占较高代谢比例,远高于4-羟化代谢通路,16-位羟化和2-位羟化代谢通路代谢物总和中位浓度分别是4-位羟化代谢通路的27.5倍和19.5倍。各类雌激素葡萄糖醛酸/硫酸结合型水平均不低于其游离型水平,16Epi、17Epi、2OHE1、16OHE1、2OHE2和4MeOE1的游离型在所有样品中均未检出,提示雌激素在体内较易形成活性较低的Ⅱ相代谢物。各类雌激素代谢物水平个体差异明显,其中2OHE1-G/S显示出最为显著的个体差异。虽然,绝经后妇女临床重要雌激素指标E2处于较低水平,但本法测定的结果显示血清雌激素总量远高于E2,中位水平为E2的149.4倍。

表4 绝经后妇女血清各类雌激素水平分析[M(P25,P75),n=29]
3 讨论
由于缺乏对照品,本方法采用酶解法同时对雌激素葡萄糖醛酸结合和硫酸结合型代谢物的水平进行间接测定,完成雌激素及下游Ⅰ相、Ⅱ相代谢物水平的整体描绘。
本法中2MeOE2与4MeOE2由于是同分异构体,结构特性非常接近,分离较为困难,在实验过程中使用Waters C18、Waters T3、Agilent C18等多种型号色谱柱均未实现完全基线分离。后续研究还需进一步寻找更优分离条件。本法采用丹磺酰氯衍生化技术,极大地提高了雌激素检测的灵敏度,因此本法的线性范围适用于绝经后女性体内低水平雌激素的测定。绝经前女性雌激素水平较高,且由于月经周期的变化,不同时期水平变化较大[16],实际检测中存在一定数量患者超出线性范围的情况,故未做对比研究。
本研究中,虽然前体雌激素E1游离型及结合型水平均高于E2,但其与雌激素受体(ERα和ERβ)亲和活性显著低于E2,因此其雌激素样生物学活性低于E2。研究表明,雌激素代谢物具有一定程度的生理活性或致病性,如2-OHE2可以减弱肥胖的发展,改善肾功能并以独立于雌激素受体的方式抑制子宫内膜细胞的增殖[17];2OHE1/16OHE1比值与乳腺癌风险呈负相关等[18]。虽然绝经后妇女体内雌激素整体水平降低,但诸多研究已证实绝经后相关并发症的发生与体内雌激素代谢物的水平具有密切关联。本法测定的结果显示血清雌激素总量远高于临床常规指标E2,提示绝经后女性体内仍还有一定水平的雌激素代谢通量,对绝经后活性雌激素代谢物水平的研究具有重要意义。本研究结果还显示,绝经后妇女血清雌激素代谢物存在较大个体差异,其原因不仅与E2等上游雌激素水平相关,还与下游代谢酶在脂肪等性腺外组织中表达水平差异性相关[19],因此,诸多疾病本身也会造成雌激素代谢物水平的变化。综上,本方法具有较高灵敏度,可同时检测多种雌激素及代谢物,为监测绝经后妇女体内雌激素整体及局部水平、确定参考值区间、研究相关并发症的发病风险因子以及实施激素替代疗法后风险与获益的评估提供技术支撑,但尚需扩大样本量以进一步研究。

