改良缝挂法构建小鼠胃原位移植瘤模型及评估
程 蝶,左彦珍,鲁艳杰,张雯惠,李祥伶,庞佳昱,李玉红
胃癌在消化系统肿瘤中致死率位居第3位[1-2],早期通常无明显症状,多数患者发现时病情已进展到中晚期[3]。尽管胃癌已在多模式治疗方面取得进展,但复发依然常见[4]。目前,胃癌体内研究常采用动物皮下移植瘤模型,但因胃癌具有特殊的肿瘤微环境[5],其内多种基质细胞、生长因子相互作用直接或间接地影响肿瘤的发生和发展[6],因此关于胃癌的研究不能脱离肿瘤微环境及神经内分泌系统等独立进行瘤体组织研究。皮下移植瘤模型不能有效模拟胃癌原发器官的肿瘤微环境,已不能满足胃癌研究领域的新需求,胃癌相关基础研究的深入挖掘要求构建更高效稳定、更贴合临床的动物原位肿瘤模型。本实验首先种植两种人胃癌细胞株MGC803和MKN45/luc,构建皮下移植瘤,再将皮下瘤组织块用改良缝挂法构建胃原位移植瘤模型,通过手术解剖和动物活体成像系统检测裸鼠胃原位移植瘤的成瘤效果及生长情况。
1 材料与方法
1.1 材料
1.1.1实验动物 BALB/c(nu)裸鼠,4~5周龄,体重15~18 g,购自北京市华阜康实验动物公司,实验动物生产许可证号:SCXK(京)2020-0004。2只裸鼠用于两种胃癌细胞皮下移植瘤构建,15只裸鼠用于改良缝挂法构建胃原位移植瘤。本实验经承德医学院伦理委员会的批准。
1.1.2人胃癌细胞株 人胃癌细胞MGC803购自上海吉凯基因公司,人胃癌细胞MKN45/luc购自宁波明舟生物公司。
1.1.3实验试剂及主要仪器 PBS缓冲液(购自Biological Industries)、RPMI 1640培养基(购自Biological Industries)、胰蛋白酶(购自Biological Industries)、胎牛血清(购自普诺赛公司)。
1.2 方法
1.2.1胃皮下移植瘤模型的构建 构建人胃癌细胞株MGC803以及能够稳定表达荧光素酶的人胃癌细胞株MKN45/luc裸鼠皮下移植瘤:体外培养细胞至对数生长期,胰酶消化,1 000 r/min离心5 min,PBS洗涤3次,PBS重悬成浓度为每毫升1×108个细胞悬液,将0.2 mL细胞悬液注射于裸鼠背部皮下,棉签按压针孔数秒,待成瘤。
1.2.2胃癌原位移植瘤模型的建立 约1周后,皮下荷瘤小鼠注射部位可见皮下瘤形成,周围有血管生成,待瘤体直径长至1 cm,取出皮下瘤体,制备成体积1 mm3的肿瘤组织块。5只裸鼠用于构建MGC803原位移植瘤模型,10只裸鼠用于构建MKN45/luc原位移植瘤模型。改良缝挂法构建裸鼠胃原位移植瘤模型。操作如下:术前禁食禁水6 h,麻醉消毒后使裸鼠仰卧位于操作台,于剑突下方约5 mm处沿腹中线左侧1 cm纵向逐层暴露腹腔,种瘤位置选择胃大弯近幽门毛细血管丰富部位,手术缝线于此部位浆膜层行第一针固定,将制备好的1 mm3肿瘤块挂到手术线上,使用“8”字缝合法将瘤块包入浆膜中(图1),闭合腹腔待小鼠恢复自主活动后放回饲养笼。

图1 胃原位移植瘤组织瘤块种植位置、手法
1.2.3荷瘤小鼠胃原位移植瘤的成瘤效果解剖检测 MGC803细胞构建的胃原位移植瘤模型建立3周后,手术解剖小鼠,探查成瘤效果及瘤体大小。
1.2.4荧光成像技术检测荷瘤小鼠胃原位移植瘤的成瘤效果 MKN45/luc细胞构建的胃原位移植瘤模型建立3周后,腹腔注射荧光素酶底物D-荧光素钾盐(150 mg/kg),使用IVIS Lumina XRMS SeriesⅢ动物活体成像系统拍照。
1.2.5荷瘤小鼠胃原位移植瘤组织的病理检测 解剖取材,取胃肿瘤组织及瘤旁正常胃组织,经10%中性福尔马林固定,行HE染色及免疫组化染色。

2 结果
2.1 裸鼠胃原位移植瘤的成瘤情况及肿瘤大小构建裸鼠MGC803细胞胃原位移植瘤模型后,饲养3周处死,对成瘤情况及肿瘤大小进行检测和测量发现:用改良缝挂法构建的胃原位移植瘤模型全部成瘤,肿瘤生长良好、大小均一(图2),5只裸鼠胃原位移植瘤体积(mm3)中位数为216、四分位距为102、均值为224.4、标准差为108.5、标准误为48.52,不存在离群值(Median±2IQR)和极端值(Median±3.5IQR),正态性检验结果显示各数值在组内接近正态分布(P>0.05),胃原位移植瘤均一性较好。

ABCD
2.2 裸鼠胃原位移植瘤的动物活体成像情况对10只种植MKN45/luc细胞的原位移植瘤裸鼠行动物活体成像系统拍照,结果显示:10只均造模成功(图3)。样本中不存在离群值(Median±2IQR)和极端值(Median±3.5IQR),独立样本t检验显示,雌性裸鼠瘤体荧光数值低于雄性的平均水平,两组的差值为-1.4E+09,95%CI为-4.0E+09~12E+09,差异无统计学意义(t=-1.263,P>0.05),正态性检验结果显示各数值在组内接近正态分布(P>0.05),提示本方法构建的胃原位移植瘤均一性较好。

图3 小动物活体成像系统生物荧光拍照图:A.雄性;B.雌性
2.3 裸鼠胃原位移植瘤组织的HE染色病理结果正常胃组织切片显示:胃黏膜固有腺体形态规则,壁细胞和主细胞排列整齐。胃原位移植瘤组织切片显示:细胞大小不等、形态不一,异型性明显,核大深染,可见病理性核分裂象,符合胃癌的病理特征(图4)。

AB
2.4 裸鼠胃原位移植瘤组织中CD45、vimentin和CK19的表达情况免疫组化结果显示:CD45和vimentin在胃原位移植瘤组织中低表达或不表达,CK19在胃原位移植瘤组织中高表达(图5);提示肿瘤为上皮来源,胃原位移植瘤造模成功。
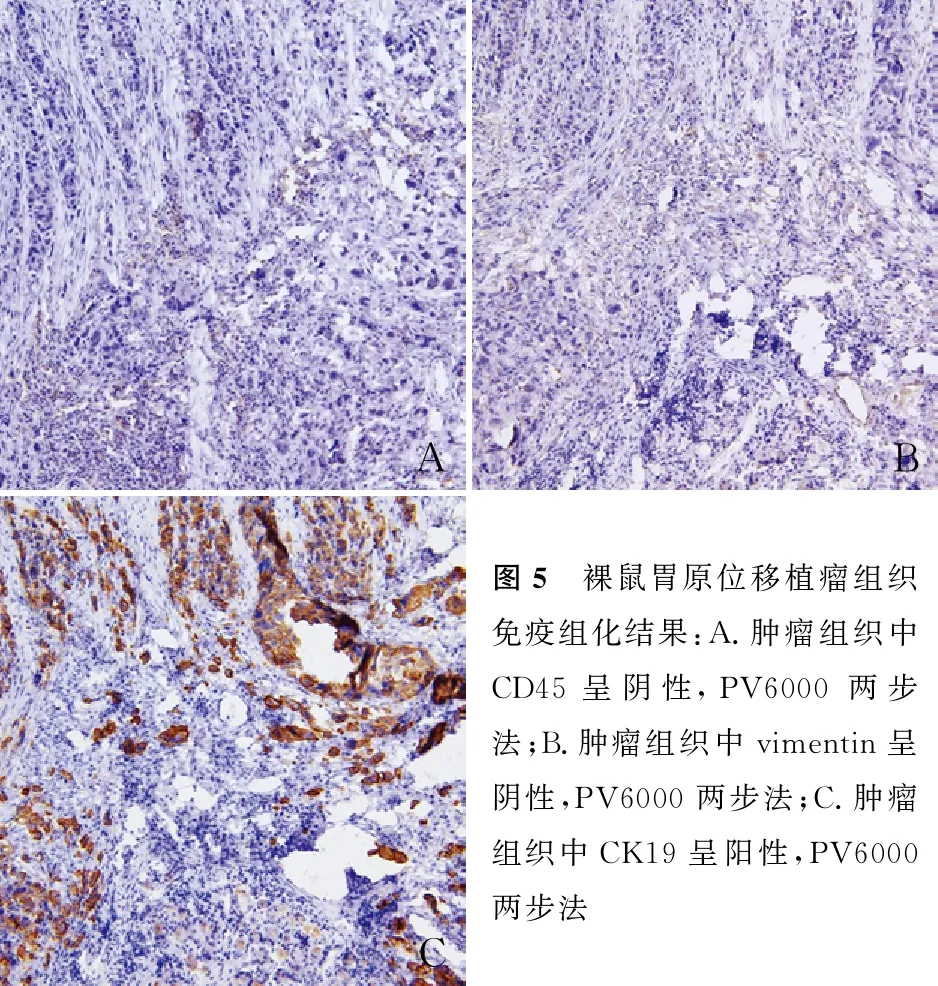
ABC图5 裸鼠胃原位移植瘤组织免疫组化结果:A.肿瘤组织中CD45呈阴性,PV6000两步法;B.肿瘤组织中vimentin呈阴性,PV6000两步法;C.肿瘤组织中CK19呈阳性,PV6000两步法
3 讨论
在过去十几年中,胃癌的患病率显著下降,但每年仍有大量患者死亡[7]。裸鼠是先天性胸腺缺陷的突变小鼠,是多种肿瘤模型构建常用动物[8-10]。目前,胃癌研究常用裸鼠皮下移植瘤[11]和裸鼠原位移植瘤。虽然皮下移植瘤操作方便,但其不容易模拟临床上胃癌侵袭和转移,且无法构建胃癌特殊的肿瘤微环境[12]。因此,构建稳定的动物胃原位移植瘤模型是基础科研亟需解决的难题。
构建胃原位移植瘤常用缝挂法、细胞注射法、胃囊法和OB胶黏合法[13]。传统缝挂法瘤体易掉落腹腔;细胞注射法操作时细胞悬液易随针道外漏;胃囊法这类创面较大的缝合易造成梗阻;OB胶黏合法则是将瘤组织块埋入血管丰富的胃浆肌层后[14],使用OB胶黏合创口,虽然OB胶具有可吸收性,但其强效的黏合功能对胃功能运动和胃组织表面血管也有限制及影响,且易与相邻器官粘连[15]。综上,目前常用的构建胃原位移植瘤方法均存在不同程度的缺陷,有待改良。
本研究对传统缝挂法实施进一步改良,较于其他构建方法具有以下优越性:(1)不需大量培养细胞;(2)操作仅在胃浆膜层,刺激小,不易造成梗阻,成活率高;(3)瘤体不易脱落且不影响小鼠胃肠正常功能;(4)种植在毛细血管分布丰富的胃大弯近幽门处,成瘤率高;(5)均一性好、可重复性高。此外,本研究结合动物活体成像系统,用荧光素酶标记人胃癌细胞株构建胃原位移植瘤,对动物体内肿瘤生长情况的动态监测进行初步尝试[16]。改良后的缝挂法构建胃原位移植瘤的成功,不仅为胃癌领域基础研究提供了优质的动物肿瘤模型,也为胃癌的临床治疗研究奠定了模型基础。

