血浆同型半胱氨酸、血尿酸在帕金森病中表达水平的研究
赵丽丽,张 硕,陈 莹,姜立刚
(吉林医药学院附属医院 神经内科二疗区,吉林 吉林132000)
帕金森病(Parkinson’s disease,PD)是一种神经系统退行病变,发病率仅次于痴呆,位居于第二位[1],我国早在1986年开始就对全国帕金森病的覆盖城市进行了相关统计,分别统计不同地区,不同年龄阶段的患病率,其中65岁以上老年人为1.7%,接近于国际水平[2]。随着我国步入老龄化,帕金森病做为典型老年疾病,其患病人数将会越来越多,可能维持在高水平。最近的一项研究显示中国有200万帕金森病患者,占世界上15个国家最多的48%,而到2030年我国患帕金森病人数将达到500万[3-4]。PD一方面给患者造成了身心损害,另一方面也给社会带来了沉重的经济负担。
PD的临床症状包括运动和非运动两类,前者包括静止性震颤、肌强直、运动迟缓、姿势步态障碍,后者包括睡眠障碍、嗅觉减退、直立性低血压、认知功能障碍等。PD的发生、发展是十分复杂并且很可能涉及遗传、环境或其相互作用的结果[5-17]。但具体的发病机制至今尚未完全阐明。近年来相关研究发现同型半胱氨酸(Homocysteine,Hcy)水平可能与PD的发生有关,而尿酸(Uric acid;UA)作为一种天然抗氧化剂,相关研究报道UA与PD的发生呈负相关,对其发病呈保护作用。本研究在临床工作中拟设计回顾性分析PD为病例组、与其相匹配的同期体检的健康人群为对照组,分别检测各组的Hcy、UA表达水平,比较在两组人群中上述指标的差异,探讨Hcy、UA是否与PD的发生、发展存在一定的关系,现报道如下。
1 材料与方法
1.1 研究对象
本研究选择收集2016年10月至2020年10月期间就诊于吉林医药学院附属医院神经内科二疗区及北华大学附属医院神经内科帕金森专病门诊及疗区住院帕金森病60例患者作为病例组(PD组),选择同一期间与PD组相匹配的就诊于北华大学体检中心的60例健康人群作为对照组。其中PD组:男性患者33人,女性患者27人,年龄46-82岁;对照组:男性患者33人,女性患者27人,年龄48-81岁。
1.2 纳入及排除标准
PD组 纳入标准:①符合帕金森中国帕金森病的诊断标准;②签署知情同意书。排除标准:①帕金森叠加综合征及继发性帕金森综合征;②原发性震颤;③进行性核上性麻痹;④橄榄脑桥小脑萎缩;⑤既往颅脑外伤、颅内感染及占位性病变者;⑥严重肝肾功能不全者;⑦焦虑、抑郁服药者。对照组 纳入标准:签署知情同意书。排除标准:①临床可疑帕金森病患者;②严重的冠心病、高血压病者;③严重的肝肾功能不全者;④严重的血液系统及内分泌系统疾病者;⑤近期服用维生素B12、叶酸等药物者;⑥痛风导致骨关节炎者。
1.3 分组
采用回顾性分析,分为病例组(PD组)及健康对照组。收集各组患者的基本信息,包括年龄、性别、既往病史、家族史。同时收集PD组患者临床症状、辅助检查及治疗措施等相关资料。
1.4 实验方法
血标本的收集:病例组、对照组均执行抽血前一天22:00后禁食、禁水,次日清晨6:30肘静脉采血3 ml,统一送往检验科,将所有样本置于4 000 r/min离心机中离心15 min,取上层血清样品进行检测。同型半胱氨酸检测:检验仪器为BECKMAN COULTER全自动生化分析仪(型号:AU5800)。采用循环酶法、运用纤维蛋白(原)降解产物测定试剂盒进行检测血浆同型半胱氨酸。检验所用试剂为上海市骏实生物科技有限公司生产。血清参考区间:4-15.4 μmol/l。尿酸检测:检验仪器为SIEMENS 型号:ADR3A 2400。采用氧化酶法尿酸测定试剂盒,试剂为上海科华生物工程股份有限公司生产。完全遵照试剂操作流程进行检测,血清参考区间:180-440 μmol/l。
1.5 统计学方法
统计资料采用SPSS17.0软件,计量资料应用,两组间比较用t检验。P<0.05表示差异具有统计学意义。
2 结果
2.1 病患性别与年龄之间的关系
对两组患者进行年龄差异分析(结果见表1),其中PD组60人,男性患者33人,女性患者27人,年龄46-82岁,平均年龄(68.96±8.80);对照组:男性患者33人,女性患者27人,年龄48-81岁,平均年龄(68.96±8.48)岁。
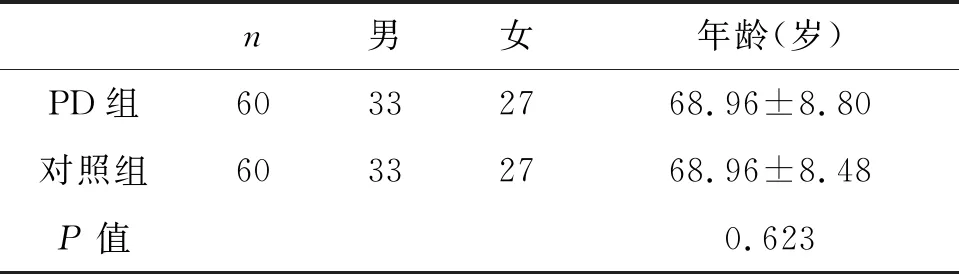
表1 PD组、对照组性别与年龄
2.2 PD组病患性别与病程、Hcy水平之间的关系
对PD组性别、病程和Hcy水平表达的关系进行分析,结果如表2所示。
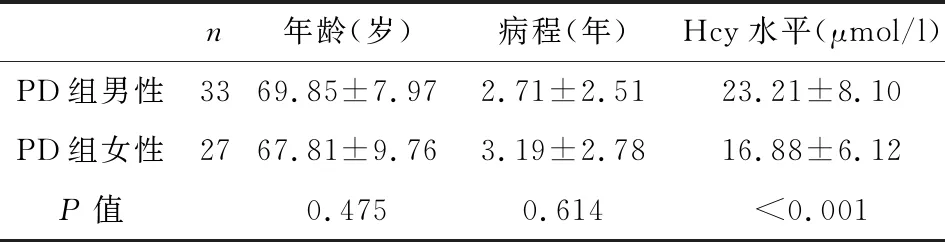
表2 PD组男性与女性Hcy水平的表达
2.3 PD组与对照组病患Hcy、UA表达水平之间的关系
Hcy表达水平PD组明显高于对照组,P<0.01,差异极显著,具有统计学意义。而UA表达水平PD组明显低于对照组,P<0.01,差异显著,具有统计学意义。由此可知,Hcy表达水平在PD患者中明显升高,而UA在PD患者中表达明显降低,结果如表3所示。

表3 PD组与对照组Hcy、UA表达水平
3 讨论
PD的主要病理改变为中枢神经系统多巴胺能神经元的大量变性丢失,尤其以黑质致密部最为明显。当多巴胺能递质减少达70%-80%时即出现不可逆的损伤,从而出现以静止性震颤、肌强直、运动迟缓、姿势运动障碍、认知功能障碍、焦虑、抑郁等为主的临床表现,而PD的发病机制迄今为止尚不是十分清楚。
Hcy是甲硫氨酸去甲基化的过程产物,它具有致动脉粥样硬化、促血栓形成、促氧化、促凋亡、加重骨质疏松、促进神经毒性,引起神经炎症和神经退行性变的作用[18]。近年来越来越多的研究显示Hcy可能与多种神经内科疾病的发生有关,其中包括PD[14]。Ataie A等学者通过向大鼠侧脑室内注射Hcy,建立Hcy大鼠模型,5天后用开放式野外仪测定运动活性,应用免疫组化法检测黑质细胞凋亡情况,结果发现Hcy可显著降低大鼠的运动活性,并可诱导黑质细胞凋亡[19]。Louis ED等进行了关于美国华盛顿地区的横断面队列研究,结果显示在社区居住的轻度PD患者与Hcy的浓度相关[20]。而我国杨玉杰等也通过对江苏省盛泽医院的PD患者和健康人群对照进行研究得出了Hcy可能是PD患病的独立危险因素[21]。本研究同样得出,与健康对照组相比PD患者的Hcy水平明显升高(P<0.01),差异显著,具有统计学意义的结论(表3)。同时本实验得出Hcy水平与患者病的病程与患者年龄无关,差异不显著,无统计学意义的结论(表2)。所以Hcy可能为PD发生的危险因素。
Hcy是一种含硫非必须氨基酸,主要有蛋氨酸代谢生成,为了满足人体对Hcy的需要,蛋氨酸通过三磷酸腺苷(adenosine triphosphate,ATP)活化转化为S-腺苷甲硫氨酸(SAM)。SAM在细胞中充当主要的甲基供体,并在捐赠甲基之后,转化为S-腺苷基同型半胱氨酸(SAH),水解成Hcy。当体内氨基酸代谢不能维持正常平衡时,Hcy水平就会发生变化,相关研究表明Hcy升高考虑与遗传因素、维生素B族、叶酸缺乏有关。Martignoni E等学者[21-22]发现,PD患者Hcy水平升高主要是口服左旋多巴治疗所导致,原因主要是与左旋多巴的甲基化分解代谢相关。本研究并没有将PD服药人群排除在入选标准,只是针对PD组与健康对照组血浆Hcy水平进行检测,旨在使对比更准确,排除大部分干扰因素,实验结果表明PD组Hcy水平明显升高,所以检测Hcy水平并进行有目的的干预希望可以减缓由Hcy升高所导致的PD的临床症状。左旋多巴作为治疗PD的一线用药会导致Hcy水平升高,Hcy浓度升高促进PD的发展,建议服用左旋多巴时可适当补充维生素B12、叶酸、COMT抑制剂等降低Hcy水平,可能对PD的治疗有所帮助。本研究还得出在PD患者中Hcy水平与病程无关,这一发现与Saadat P等[23]的结论相同。
UA是嘌呤类代谢的终产物,以可溶性盐尿酸的形式以接近饱和的状态存在于血浆当中[24]。尿酸的来源主要有两个:内源性,由体内核酸的分解代谢所产生,主要由肝脏通过黄嘌呤氧化酶分解嘌呤产生,约占人体内总尿酸的4/5;外源性,来自富含嘌呤食物的核苷酸分解,约占人体内总尿酸的1/5。尿酸在人体内的排泄主要通过两条途径:70%左右的尿酸经肾脏排泄,其余的尿酸经胃肠道和胆道排泄[25]。UA作为天然抗氧化剂对PD具有保护作用,同样低水平的UA促进PD的临床进展,主要表现在非运动症状。Nakashima A等向小鼠脑室内注射6-OHDA建立PD鼠模型,给PD鼠喂食含有1%UA和2.5%氧嗪酸钾(尿酸酶抑制剂)的饮食以诱导高尿酸血症。在喂食UA饮食的组中发现UA水平显著升高。观察到高UA组PD鼠模型的运动障碍缓解,同时得出UA对多巴胺能神经元丢失,改善运动功能障碍和改善PD发展具有神经保护作用的结论[26]。本研究同样得出与健康对照人群相比PD患者血清UA水平明显降低(表3)。而较低的UA水平促进PD发展,在治疗PD的同时可以检测UA水平,适当增加UA水平可能延缓PD的进程,Crotty GF等研究者提高PD细胞与动物模型中的UA浓度,结果发现高浓度UA可以通过抑制抗氧化应激使多巴胺能的减少下降,同时延缓PD的进程[27]。我们可以通过合理摄入豆制品、牛奶,肉制品等,注意监测UA水平,避免UA过高导致痛风。
4 结论
本研究通过对PD组与健康人群进行对照研究可知:Hcy在PD组中表达水平与病程和年龄无关,而与性别有关;Hcy表达水平在PD患者中明显升高,而UA在PD患者中表达明显降低。由此可知Hcy对PD的发生是危险因素,UA对PD的发生具有保护作用。

