神经酰胺脂质体对灵芝发酵液中大分子极性成分的经皮递送效果研究
汤清涵,高洁,董洁,张启清,陈军
(1.南京中医药大学药学院,江苏 南京 210023;2.江苏省中医外用药开发与应用工程研究中心,江苏 南京 210023;3.上海洁士宝日化集团有限公司,上海 201400)
灵芝(Ganoderma lucidum)是我国的传统中药,是一种药食两用大型真菌,不仅具有极高的药用价值,还具有良好的美容护肤功效[1-2]。灵芝发酵液(Ganoderma lucidum fermentative liquid,GLFL)中含有蛋白多肽、多糖等多种活性成分,具有清除自由基、抗氧化、抗衰老、美白、保湿等护肤功效,将其作为功效成分添加在化妆品中正在成为产品开发的热点[3-4]。然而,GLFL中主要活性物质多具有较强的亲水性以及较大的相对分子质量,从而不易穿过皮肤角质层屏障,皮肤渗透性差,功效得不到充分发挥,是限制其实际应用的瓶颈问题。
神经酰胺脂质体(Cerosomes,CS)是一种新型皮肤局部给药载体,是由磷脂、神经酰胺、胆固醇等组成的具有类脂双分子层结构的脂质体,具有优良的稳定性和皮肤耐受性[5-6]。研究表明,在脂质体双分子层中加入神经酰胺可以显著影响脂质体的经皮递送效果,与普通脂质体(Conventional liposomes,CL)相比,CS能够显著促进药物的经皮渗透[7-8]。
本文选用水溶性大分子荧光素异硫氰酸酯-葡聚糖(Fluorescein isothiocyanate-dextran,FD)作为荧光探针,掺入GLFL中制成FD-GLFL-CS,以考察加入神经酰胺对于脂质体经皮递送效果的影响及其机制,为提高极性大分子的经皮递送效果提供制剂技术。
1 材料
RE-52A旋转蒸发仪(上海亚荣生化仪器厂);DZF-6020真空干燥箱(上海精宏仪器设备有限公司);Zetasizer Nano ZS90激光散射粒径测定仪(英国马尔文仪器有限公司);JY92-Ⅱ超声波细胞粉碎机(浙江宁波新芝生物科技股份有限公司);S-4800扫描电子显微镜(日本Hitachi公司);HH-4数显恒温水浴锅(常州国华电器有限公司);TK-24BL透皮扩散试验仪(上海锴铠仪器设备有限公司);LS55荧光分光光度计(美国PerkinElmer公司);DSC200F3差示扫描量热仪(德国NETZSCH公司);Axio Scope. A1正置荧光显微镜(德国Zeiss公司);VERTEX 70傅里叶变换红外光谱仪(德国Bruker公司)。
灵芝发酵液(批号:20200710,上海洁士宝日化集团有限公司);大豆磷脂(批号:SY-SI-190602,上海艾伟拓医药科技有限公司);胆固醇(批号:B80859,上海艾伟拓医药科技有限公司);油溶性神经酰胺3(批号:201901219,韩国斗山集团);吐温80(化学纯,批号:20190220,上海国药集团);BCA试剂盒(批号:20190910,北京索莱宝科技有限公司);FD(分子量:4 000,批号:46955-500MG-F,美国Sigma公司);其它试剂均为市售分析纯。
雄性SD大鼠,SPF级,体质量(200±20)g,购自浙江维通利华实验动物技术有限公司,合格证号:SCXK(浙)2019-0001。
2 方法
2.1 FD-GLFL脂质体的体外经皮递送研究
2.1.1 FD-GLFL脂质体的制备 采用薄膜分散法制备FD-GLFL脂质体。将2.5 mg FD溶解在5 mL GLFL中得到FD-GLFL,按表1称取处方量大豆磷脂、胆固醇、神经酰胺3,加入5 mL乙醇超声溶解,转移至250 mL茄形瓶中,40 ℃减压旋转蒸发30 min除去有机溶剂至瓶壁形成一层均匀的薄膜后,继续真空旋蒸除尽剩余溶剂,真空干燥过夜,加入5 mL FD-GLFL溶液(含0.5 mg·mL-1FD,0.5%吐温80)水合1 h,得到FD-GLFL-CS[C/S(1∶12)、C/S(1∶6)、C/S(1∶3)]混悬液。同法不加神经酰胺3制成FD-GLFL-CL混悬液。冰水浴条件下探头超声4次(功率60 W,工作2 s,暂停2 s),即得分散均匀的脂质体,置于4 ℃保存。
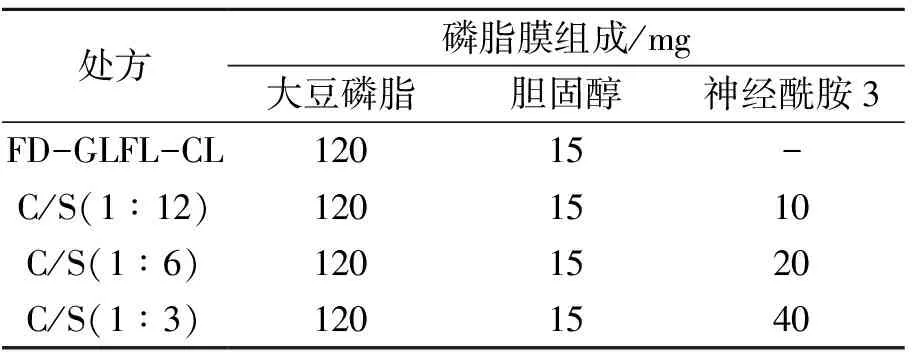
表1 FD-GLFL脂质体的处方
2.1.2 体外经皮递送实验 取2.1.1项下制备的各处方FD-GLFL脂质体,高速离心(4 ℃,20 000 r·min-1,45 min)分离脂质体与游离FD,沉淀用GLFL复溶,得到除去游离FD的各组FD-GLFL脂质体样品。取雄性SD大鼠,麻醉后除去腹部毛发,脱颈处死,剪下无损伤的腹部皮肤,剔除皮下脂肪组织,浸于生理盐水中洗净。将大鼠皮肤角质层朝上固定于透皮扩散池(有效扩散面积3.14 cm2),接收池内加入8.3 mL PBS(pH 7.4)作为接收液,供给室内加入1 mL各组FD-GLFL脂质体样品(FD浓度为25 μg·mL-1),于37 ℃,以400 r·min-1的速度磁力搅拌,避光作用12 h。结束后,取下皮肤,温水清洗、除净表面残留制剂,剪下有效给药部位并剪碎,用甲醇/水(体积比1∶1)提取皮内药物12 h,4 500 r·min-1离心10 min,取上清液过0.45 μm滤膜,以荧光分光光度法(激发波长485 nm,发射波长520 nm)测定皮内药物浓度[F=0.73C+50.16,r2=0.999 4,标准曲线以甲醇/水(体积比1∶1)配制],计算12 h的皮内滞留量。
2.1.3 荧光显微镜法观察皮内药物分布 将大鼠皮肤固定于透皮扩散池,于供给室内分别加入1 mL的FD-GLFL,FD-GLFL-CL和C/S(1∶6)(FD浓度均为25 μg·mL-1),按2.1.2项下方法进行体外经皮递送实验。给药12 h后,从皮肤表面吸除多余的制剂,并用温水洗净皮肤,将有效给药部位的皮肤剪下,固定于冷冻包埋剂中,制备冷冻切片,在荧光显微镜下观察皮肤内药物分布。
2.2 GLFL-CS的制备
根据体外递送实验优选处方,采用薄膜分散法制备GLFL-CS。精密称取大豆磷脂120 mg,胆固醇15 mg和神经酰胺3 20 mg,用适量乙醇超声溶解,并转移至250 mL茄形瓶中,40 ℃减压旋转蒸发除去有机溶剂至瓶壁上形成一层薄膜,放入真空干燥箱过夜除去痕量溶剂,加入5 mL GLFL(含0.5%吐温80)水合1 h,于冰浴条件下探头超声4次(功率60 W,工作2 s,暂停2 s),即得GLFL-CS,置于4 ℃保存。以PBS缓冲液代替GLFL,处方中其他辅料的用量不变,同上法制备空白CS。
2.3 GLFL-CS的理化性质考察
2.3.1 GLFL-CS的形态观察与粒径测定 吸取GLFL-CS加水适当稀释后,均匀黏附于硅片上,置于样品池中,表面减压喷金处理,于扫描电子显微镜(SEM)下观察其形态。吸取GLFL-CS 100 μL,加水稀释到1 mL,混合均匀,采用激光散射粒径测定仪测定其粒径和粒径分布(PDI)。
2.3.2 GLFL-CS的包封率测定 采用离心沉淀-离心超滤法测定GLFL-CS的蛋白多肽类成分的包封率。吸取GLFL-CS和空白CS适量,4 ℃,20 000 r·min-1离心30 min,取上清液加入超滤管中(截留分子量为100 kDa),配平,4 ℃,14 000 r·min-1离心10 min,分离得到游离的蛋白多肽。BCA法测定GLFL-CS中游离的多肽浓度Cf,空白CS的游离浓度Ck以及GLFL中总多肽浓度Ct,计算包封率,包封率=1-(Cf-Ck)/Ct×100%。
2.3.3 GLFL-CS的稳定性考察 制备GLFL-CS,置4 ℃冰箱储存,分别于0、3、7、10、14 d测定脂质体粒径与包封率的变化。
2.4 ATR-FTIR法研究GLFL-CS的经皮递送机制
将大鼠皮肤固定于透皮扩散池,于供给室内分别加入1 mL的GLFL、GLFL-CL和GLFL-CS,按“2.1.2”项下方法进行体外经皮递送实验。给药12 h后取下皮肤,表面用纯水洗涤干净,并用滤纸吸干水分,采用衰减全反射傅里叶变换红外光谱(ATR-FTIR)对皮肤样品进行扫描。ATR-FTIR实验条件:扫描次数为64次,分辨率为1 cm-1,扫描范围为400~4 000 cm-1。
3 结果
3.1 FD-GLFL-CS的体外经皮递送效果
3.1.1 神经酰胺对脂质体经皮递送效果的影响 以FD-GLFL和FD-GLFL-CL作为对照,研究神经酰胺加入量对脂质体体外经皮递送效果的影响。如图1所示,12 h后皮肤中药物滞留量顺序为: C/S(1∶6)>C/S(1∶12)>C/S(1∶3)>FD-GLFL-CL>FD-GLFL,FD-GLFL-CS[即C/S(1∶3)、C/S(1∶6)、C/S(1∶12)]组的皮内滞留量均大于FD-GLFL组和FD-GLFL-CL组,且以C/S(1∶6)的皮内滞留量最高,分别为FD-GLFL及FD-GLFL-CL的2.87倍和1.78倍。

注:与FD-GLFL比较,图1 神经酰胺对脂质体体外经皮递送效果的影响Fig. 1 Effect of ceramide on transdermal delivery of liposomes in vitro
3.1.2 荧光显微镜法观察皮内药物分布 不同FD-GLFL脂质体给药后的皮肤荧光显微镜图结果见图2,可见给药12 h后,皮内FD总荧光从弱到强依次为:FD-GLFL、FD-GLFL-CL、FD-GLFL-CS[C/S(1∶6)],与上述皮内滞留量的定量结果一致。从皮内分布可知,FD-GLFL和FD-GLFL-CL处理后的皮肤FD荧光主要分布在最外层的角质层,少量分布在毛囊中,FD-GLFL-CL在皮肤深层也有少量分布;FD-GLFL-CS[C/S(1∶6)]处理后的皮肤FD荧光在角质层和深层都有大量分布。由此可见,CS可能与皮肤具有较强的亲和力,降低了皮肤的屏障作用,促进更多的药物向皮肤深层渗透[9-10]。
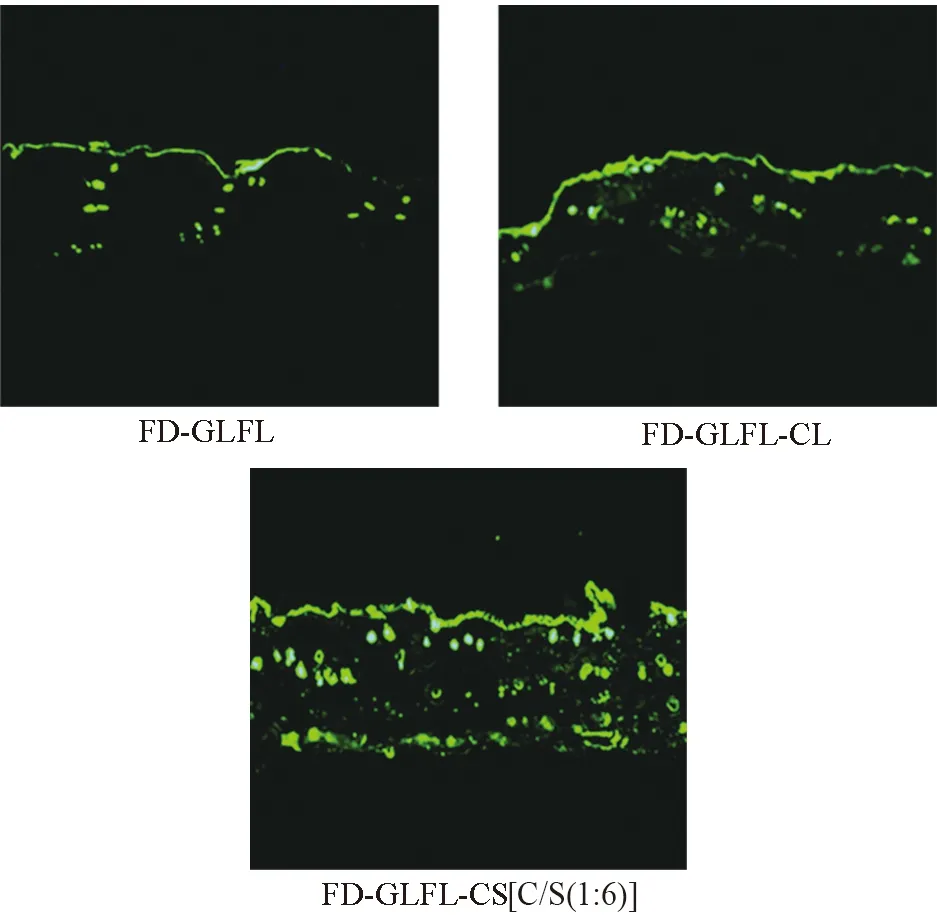
图2 FD-GLFL及其脂质体给药后的皮肤荧光显微镜图Fig. 2 Fluorescence microscopy of skin after the administration of FD-GLFL and its lipidosomes
3.2 GLFL-CS的理化性质
3.2.1 GLFL-CS的外观形态、粒径与包封率 采用扫描电镜(SEM)观察GLFL-CS形态结构,结果如图3所示,GLFL-CS呈类球形,平均粒径为(259.3±16.7)nm,PDI为(0.29±0.03)。前期研究显示GLFL中蛋白多肽为主要成分,因此测定蛋白多肽类成分的包封率,为GLFL-CS的质量评价提供依据,测得包封率为(43.03±0.90)%。

图3 GLFL-CS的扫描电镜图(×60 000)Fig. 3 Scanning electron microscope pictures of GLFL-CS (×60 000)
3.2.2 GLFL-CS的稳定性 通过考察GLFL-CS在4 ℃下贮存14 d过程中,粒径和包封率的变化来评价脂质体的稳定性。粒径和包封率的变化测定结果如图4所示,在14 d内,粒径及包封率几乎均未发生明显变化,表明GLFL-CS在4 ℃下贮存稳定性较好。
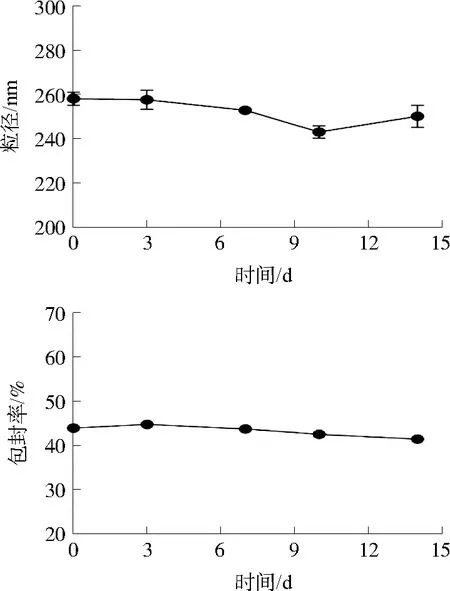
图4 GLFL-CS 14 d内粒径与包封率变化Fig. 4 Changes of particle size and encapsulation ratio of GLFL-CS during 14 d
3.2.3 GLFL-CS的经皮递送机制 应用ATR-FTIR技术检测GLFL-CS作用于大鼠皮肤后角质层脂质和角蛋白的主要特征峰位移及峰面积的变化[11],以判断角质层结构的变化,阐明CS促进GLFL中水溶性大分子成分经皮渗透的机制。皮肤ATR-FTIR图谱如图5所示。
GLFL、GLFL-CL和GLFL-CS作用于皮肤后,角质层OH振动峰分别为3 279.43、3 283.21、3 288.10 cm-1,与GLFL相比,GLFL-CL和GLFL-CS的OH振动峰均向高峰位移动,且峰面积增大,说明脂质体可使角质层水合作用加强,且作用强度排序为GLFL-CS>GLFL-CL>GLFL。
角质层细胞间脂质通路是药物进入皮肤的重要途径,脂质特征峰(CH2非对称振动峰和对称振动峰)的变化与其组成结构直接相关。GLFL、GLFL-CL和GLFL-CS作用后,CH2非对称振动峰和对称振动峰分别为2 916.58 cm-1和2 849.64 cm-1,2 924.82 cm-1和2 852.73 cm-1,2 924.56 cm-1和2 851.19 cm-1,与GLFL相比,GLFL-CL和GLFL-CS的脂质特征峰皆向高峰位移动,且峰面积皆减小,表明脂质体使得角质层脂质的组成结构发生了很大的改变,更利于药物的经皮渗透。
此外,我们还发现脂质体的干预使皮肤角蛋白的结构或构象也发生了变化,GLFL、GLFL-CL和GLFL-CS作用后,NH—C=O的振动Ⅰ峰和振动Ⅱ峰分别为1 641.61 cm-1和1 542.40 cm-1,1 633.03 cm-1和1 549.95 cm-1,1 630.03 cm-1和1 552.27 cm-1,与GLFL相比,GLFL-CL和GLFL-CS的振动Ⅰ峰均向低峰位移动以及振动Ⅱ峰向高峰位移动,且峰面积均略有增大,2组峰作用强度顺序均为GLFL-CS>GLFL-CL>GLFL。
CS可能是通过增强皮肤角质层水合作用及改变角质层脂质和角蛋白的结构或构象,增加角质层脂质双分子层的流动性,降低皮肤屏障作用,从而促进了药物的经皮渗透。

注:A.GLFL;B.GLFL-CL;C.GLFL-CS图5 CS对大鼠皮肤角质层ATR-FTIR图谱的影响Fig. 5 Effects of CS on ATR-FTIR spectra on rat skin cuticle
4 讨论
本文针对中药水溶性大分子成分难以有效递送入皮肤这一问题,将GLFL载入CS中,并对该载体的体外经皮递送效果及机制进行研究,以期为GLFL皮肤外用制剂与化妆品的开发提供研究基础。研究结果表明,与GLFL溶液和GLFL-CL相比,GLFL-CS可以显著提高水溶性大分子物质的皮内滞留量和透皮深度,有望成为新型经皮局部给药载体。
药物自身的理化性质影响脂质体的包封率,采用常用的脂质体制备方法(薄膜分散法、逆相蒸发法、乙醇注入法)制备载亲水性大分子成分的脂质体,包封率一般较低[12]。本文采用薄膜分散法制备了GLFL-CS,主成分蛋白多肽的包封率为(43.03±0.90)%。后续研究表明,CS可以促进游离水溶性大分子物质的经皮渗透,包封率可能不是增强药物皮肤渗透性的重要因素。这可能在一定程度上避免了亲水性大分子物质脂质体包封率普遍偏低以及制备工艺复杂等问题,CS有望推动水溶性成分在外用制剂及化妆品等领域的有效应用。

