中药外用制剂研究概述与展望
陈军,梁秉文,乔鹏丽,严国俊,尹少平,付鹏,王裔惟,曾莉
(1.南京中医药大学江苏省中医外用药开发与应用工程研究中心,江苏 南京 210023;2.南京中医药大学药学院,江苏 南京 210023;3.世界中医药学会联合会经皮给药专业委员会,北京 100101;4.南京中医药大学中医学院·中西医结合学院,江苏 南京 210023;5.南京中医药大学第一临床医学院,江苏 南京 210023)
与传统的口服途径相比,中药外用具有简、便、效、廉的特点。清代“外治之宗”吴尚先在《理瀹骈文》中指出“汤液内治犹在暗室也,膏药外治犹在大庭广众之地也。暗室人所不见,大庭广众之地人皆见之。故内治可蒙,而外治不可蒙,然易于补过在此,不蹈重咎亦在此”[1]6。在国际市场上,外用制剂也发展迅猛,其中仅透皮给药市场预计在2024年就能达到约73.58亿美元[2]。2018年,丁桂儿脐贴获得加拿大天然健康产品上市许可,取得了在加拿大市场销售的资格,提示中药外用制剂可能会成为中药制剂国际化的突破口。
为了更好地发展中药外用制剂,本文介绍了中药外用制剂的含义和分类,回顾了其发展历程,对中药传统外用制剂和现代外用制剂的现状进行了概述,在此基础上,提出了若干中药外用制剂研究关键科学问题和可能解决途径,并对中药外用制剂的研究前景进行了展望。
1 中药外用制剂的含义与分类
中药外用制剂是指在中医药理论指导下,直接给药于皮肤、黏膜、创面等人体表面的中药制剂。根据递送部位,可以将中药外用制剂分为经皮外用制剂、黏膜外用制剂和创面外用制剂。
中药经皮外用制剂可以分为局部作用制剂和全身作用制剂,前者以发挥镇痛、抗炎、止痒等局部作用为主,后者需要活性成分透皮吸收入血后发挥作用。中药黏膜外用制剂可以分为口腔黏膜、鼻腔黏膜、眼黏膜、肺黏膜、直肠黏膜、阴道黏膜等外用制剂。值得一提的是,中药创面外用制剂有着悠久的发展历史和深厚的理论积淀,“煨脓长肉”等治法在糖尿病足溃疡等慢性创面治疗方面具有广阔的应用前景。
2 中药外用制剂的发展历程
中药外用制剂迄今已有约4 000年的发展历程,早在约公元前2 000年前,我国就出现了含有多种中药的膏剂(Plaster)[3],自此之后有关中药外用制剂的主要文献如表1所示。

表1 中药外用制剂的相关文献记载Table 1 Ancient codes and records of external preparations of traditional Chinese medicines
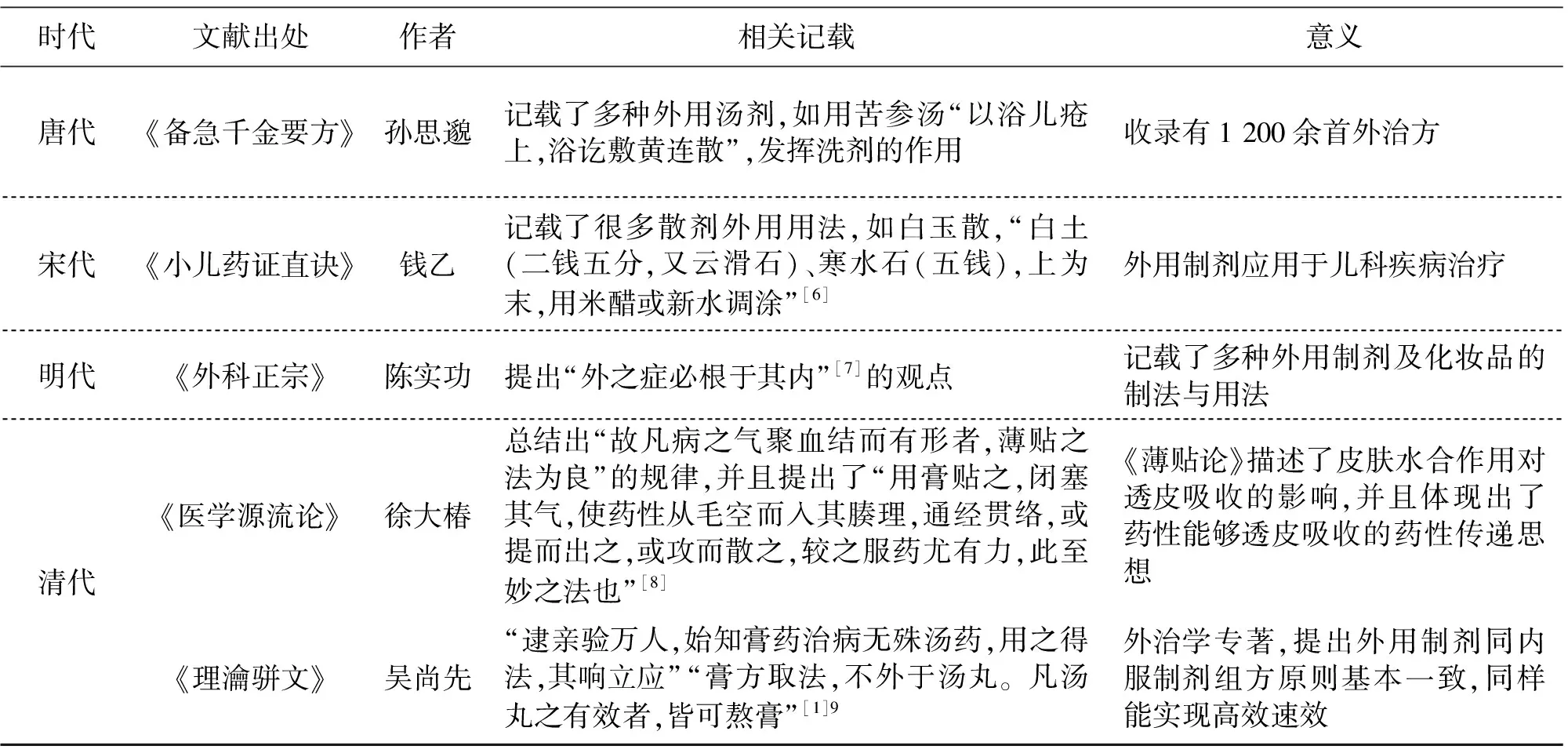
(续表)
近现代以来,中药外用制剂得到了快速发展,橡皮贴膏剂、凝胶贴膏剂、凝胶剂、乳膏剂、喷雾剂、膜剂等一系列现代剂型得到了很好的应用。特别是1981年东莨菪碱贴剂上市以来,经皮吸收制剂的发展也日新月异,微针、超声、离子导入等新型促渗技术得到了广泛应用,靶向递送技术研究也日益深入。据统计,《中国药典》一部收载的中药外用制剂品种逐渐增加,1990版收载31种,1995版收载39种,2000版收载43种,2005版收载51种,2010版收载63种,2015版收载79种[9],现行的2020版又新增了万灵五香膏、苦参软膏、妇宁栓3个品种。但是,与中药口服制剂相比,当前的中药外用制剂无论是剂型还是研究技术的发展都相对滞后。
3 中药传统外用制剂概述
3.1 膏药
膏药系指将饮片、食用植物油与红丹(铅丹)或宫粉(铅粉)炼制成膏料,摊涂于裱背材料上制成的供皮肤贴敷的外用剂型,在中医内、外、妇、产、儿各科广泛使用,前者为黑膏药,后者为白膏药。黑膏药是我国历史最为悠久的剂型之一,但其传统制作需人工操作,可重复性差,且基质中含铅,若“火毒”没有去尽则会刺激皮肤,相关研究表明,黑膏药连续外用的潜在毒性靶器官为肾脏,可能引起早期肾小管损伤[10]。因此,膏药发展的重点在于对其膏体基质的优化,使其既能保留黑膏药的特点,又能避免毒性。如采用松香、氧化锌等代替铅丹制备无铅膏药基质,优选基质无铅化工艺制成不含铅、不污染人体和衣物且能充分发挥载药量大、疗效持久等特色的黑膏药。
3.2 软膏剂
软膏剂是指将原料药物与适宜基质混匀制成的易涂抹于皮肤或黏膜上的半固体外用剂型。软膏剂主要起润滑、保护和局部治疗作用,少数能经皮吸收产生全身治疗作用,多用于慢性皮肤病和疮疡的治疗。传统软膏剂基质多采用麻油与蜂蜡融合作为基质,再与药粉或中药提取物混合而制成。如京万红软膏的组方由黄芩、黄连、紫草、当归、金银花、地榆等30多种中药组成,以蜂蜡、麻油为基质。1项多中心随机、平行对照临床研究结果表明,京万红软膏与复方磺胺嘧啶锌凝胶均有促进糖尿病足创面愈合的作用,且京万红软膏疗效更优[11]。
3.3 洗剂
洗剂在中药传统剂型中也很常见,是以中药饮片为原料,经适宜的方法提取有效成分制成的供外用的液体制剂。其中,中药熏洗剂富有传统特色,是将中药煎煮后趁热于患处熏蒸、淋洗和浸洗的外治疗法。其最早记载于汉代的《五十二病方》,明代的《外科正宗》总结了前代医家的成就,对肛肠病以痔疮、脏毒立论,全面提出了痔的熏洗疗法[7]。中药熏洗剂通过热力与药物的协同作用,行气活血、疏通经络,发挥“温经止痛”功效,是骨伤科疾病治疗的有效手段[12]。
3.4 散剂
散剂系指原料药物或与适宜的辅料经粉碎、均匀混合制成的干燥粉末状制剂。中药散剂可内服也可外用,制备简便,起效迅速,外用对疮面有一定的机械性保护作用。历史上涌现出很多著名品种,如《外科正宗》收录的冰硼散、《急救应验良方》收录的九分散等。为了规范中药外用散剂的临床应用,中国中医药学会信息分会起草了《中药散剂临床外用技术规范(草案)》,全面规范了外用散剂的基本原理、使用原则、适应证、禁忌证、用药前评估、用药前准备、制备与保存、给药方法、给药剂量、换药频率、给药时间和疗程、用药后评估、注意事项、不良反应及应对措施等,以期提高临床疗效,减少不良反应[13]。
3.5 灸剂
灸剂以艾绒为主要原料制成艾头、艾条或艾柱,点燃后在人体穴位或患处熏灸,以达到温通经络、调和气血、祛湿散寒、防病保健、治病强身的作用。灸剂在人体腧穴上或患处近距离烧灼熏烤,借助燃烧产生的温热性刺激及药物的局部透皮吸收、烟气中的药物从呼吸道吸入,达到预防或治疗某种疾病的目的。根据灸剂的原理可以优化中药外用剂型,如采用符合热敏灸疗法特性的自发热材料配方(活性炭、还原铁粉、氯化钠、水)将贴膏剂改造为贴膏灸剂,更加有利于外用治疗痛经[14]。
4 中药现代外用制剂概述
4.1 橡胶贴膏剂
橡胶贴膏剂系指原料药物与橡胶等基质混匀后,涂布于背衬材料上制成的贴膏剂。其具有很强的黏附性,无需加热即可贴于皮肤,携带使用方便,在腰颈椎病、关节炎、肩周炎、风湿痛等疾病治疗方面具有良好的发展前景。但是,由于背衬材料透气透湿性差,N,N'-双水杨醛缩-1,2-丙二胺等生产残留物和橡胶中的水溶性蛋白等因素,橡胶膏剂易导致皮肤产生接触性皮炎和超敏反应,表现为荨麻疹样、多形性红斑样、湿疹样和红皮病样等多种形态。研究发现采用多孔或微孔橡皮膏,开发聚合薄膜等背衬材料可有效改善橡皮膏剂的透气透湿性;应用KH-550改性后Fe3O4磁性粒子等技术使天然橡胶脱蛋白,或将天然橡胶与合成橡胶、苯乙烯类热可塑性弹性体共混,控制橡胶中的蛋白含量,可明显降低橡皮膏剂的皮肤刺激性[15-16]。
4.2 凝胶贴膏剂
凝胶贴膏剂,亦称巴布剂或凝胶贴膏,起源于日本的泥罨剂,系指将原料药物与适宜的亲水性基质混匀后涂布于背衬材料上制成的贴膏剂,多采用水溶性高分子材料如聚丙烯酸钠、聚乙烯醇、聚维酮等作为基质。凝胶贴膏剂载药量大,皮肤相容性高,释药性能好,耐老化,可反复贴敷,是中药现代外用制剂的研究热点之一。早期中药凝胶膏剂主要用于治疗软组织挫伤、关节炎、腱鞘炎、骨质增生、腰椎间盘突出、骨质疏松等外伤和骨病,随着药用高分子材料和现代科学技术的不断发展,其在癌症、肝硬化、哮喘、疟疾等疾病治疗方面的研究也日益增多[17-19]。将电致孔、离子导入、超声导入、微针、热消融等物理促渗技术应用于中药凝胶膏剂,已被证明能够显著促进药物透皮吸收效果,有助于发挥全身作用[20-21]。
4.3 乳膏剂
乳膏剂系指将原料药物溶解或分散于乳剂型基质中制成的均匀半固体制剂。与软膏剂相比,乳膏剂基质对油、水均有一定亲和性,对皮肤正常功能影响较小。有研究对1956—2019年报道的中药乳膏剂文献进行了分析,共分析了148篇文献,发现其在皮肤科(126篇,85.14%)中应用最为广泛,并且以O/W型基质应用最多(83.13%),用药频率以每日2次最为常见,但在临床应用中受患者主观性影响较大,须加以规范[22]。
4.4 靶向制剂
靶向制剂是指将中药提取物、有效部位或活性成分,通过适宜的载体递释使其选择性地浓集于作用部位的制剂。随着中药现代外用制剂的发展,中药外用靶向制剂研究逐渐增多,既可以装载抗炎、抗菌、镇痛等药物治疗皮肤类疾病,也可以装载用于治疗肿瘤、心血管病等的药物通过外用到达病变部位发挥全身作用,有研究报道的中药或中药成分有党参总皂苷、人参皂苷、独活挥发油、紫杉醇、姜黄素、丹参素、黄藤素、补骨脂素、雷公藤内酯、银杏内酯、长春新碱、辣椒碱、马钱子碱、青藤碱、连翘、苦参、地龙等[23]。中药外用靶向制剂的靶向途径也覆盖了被动靶向、主动靶向和物理化学靶向,如Zhang等[24]制备的透明质酸修饰载姜黄素醇质体与普通醇质体相比,可减少药物泄漏,显著提高透皮效率,通过CD44靶向炎症部位,增加皮损部位滞留时间,减轻银屑病模型动物的炎症反应。但是,当前的中药外用靶向制剂主要递送的是中药活性成分单体,难以体现出中药的治疗特色与优势。
4.5 智能响应制剂
智能响应制剂是指将中药提取物、有效部位或活性成分与智能材料制成的能够响应机体或病灶部位微环境刺激(如温度、pH、氧化还原、酶、光等),从而定时、定量、定位递释药物的制剂。中药外用智能响应制剂在生物相容性、安全性和药物释放方面都优于传统制剂,能够显著提高疗效,降低不良反应。如肿瘤组织由于谷胱甘肽蓄积,与正常组织形成还原势能差,可通过在载体中引入二硫键、二硒键等基团构建氧化还原响应制剂。Cheng等[25]通过槲皮素-二硫代二丙酸-低聚透明质酸(Que-DA-oHA)包载姜黄素,制备的载胶束HA复合微针可在6 h内递送74.7%的药物,具有良好的透皮效率,在经皮递送药物治疗黑色素瘤等疾病方面显示出具有巨大应用潜力。又如慢性感染创面中弹性蛋白酶、组织蛋白酶和透明质酸酶等分泌增加,可通过引入酶敏感裂解肽来构建酶响应制剂。Li等[26]以构建的载姜黄素酶响应脂质体水凝胶可在创面渗出液中磷脂酶A2的作用下降解,促进药物在感染性创面的释放,实现按需释放药物。中药外用智能响应制剂还处于起步阶段,存在诸多问题亟待解决,如制剂可控性差、重现性低、无法大规模生产,此外,如何实现中药性质差异较大的诸多活性成分同时智能响应递释也是需要重点考虑解决的问题。
5 中药外用制剂研究面临的关键问题与可能解决途径
中药外用制剂临床疗效确切,但普遍存在质量控制困难、剂量偏大等问题,严重限制了其现代制剂的高效开发。质量控制困难的根本原因在于关键物质基础不明,剂量偏大的根本原因是外用吸收效率太低。在中药创面外用研究中,抗生素大量应用产生的耐药性已引起广泛关注,利用中药外用解决慢性创面难愈合的问题,将会有很好的应用前景。
5.1 关键物质基础不明
与化学药物不同,中药往往成分复杂,很难完全阐明作用物质基础,这就给外用制剂研究带来了非常大的困难。由于关键物质基础不明,无论是质量控制还是吸收效果、作用机制都难以得到充分诠释,从而严重限制了中药外用制剂现代化的进程。近年来,仿生膜技术、原位分析技术的逐渐成熟,为解决该问题提供了可能。
除创面和黏膜外,外用主要是通过皮肤途径扩散吸收。近年来,仿生膜技术发展突飞猛进,已经能够模拟皮肤通透性[27],因此应用仿生膜技术从中药复杂成分中分离出能够透过皮肤的部分,通过分析手段结合药效学评价有望阐明中药外用制剂全身作用的关键物质基础。例如在研制脂质体人工皮肤膜的基础上[28-29],应用该膜分离治疗痛经的香附四物方外用物质基础,结果发现膜分离后有效成分的得率为(18.92±2.12)%(n=3),且膜分离后的有效成分镇痛、抑制子宫收缩活性显著增强,UPLC-TOF/MS从膜分离后的有效成分中分析出20个化合物,其中含量最高的是阿魏酸(占17%),并且其在膜分离后有效成分中的比例是膜分离前的3倍[30]。对于局部经皮外用制剂而言,可以采用皮内分析来确定关键物质基础,例如分析5种热性辛味中药挥发油透皮促渗剂,应用于皮肤后在关键屏障角质层中的成分,结果发现挥发油中的倍半萜类成分能够驻留在角质层中,而单萜类或芳香族类成分则快速吸收,因此证明倍半萜类成分是热性辛味中药挥发油透皮促渗的共性关键物质基础[31]。
5.2 外用吸收效率低
外用以经皮外用为主要方式,皮肤角质层是人体最难通过的屏障,导致中药有效成分外用后吸收效率太低,虽然剂量很大,但真正能够通过角质层屏障的成分非常少。虽然微针、超声导入等物理促渗技术发展迅速,但目前最常用、使用最方便、最经济的途径仍然是添加透皮促渗剂。中药与天然药物的根本区别在于有无中医药理论的指导,其中药性理论是中药理论的核心。在药性理论指导下研究开发高效、具有“药辅合一”特性的中药挥发油透皮促渗剂是解决吸收问题的重要途径。
中药挥发油是一大类透皮促渗剂,具有透皮促渗效果好、安全性高、药效协同三大优势,往往能直接组方入药,据统计,《新编中成药》第二版收载了99种处方中包含中药挥发油的外用制剂。但是,当前主要套用化学促渗剂的研究模式对中药挥发油开展研究,往往单纯通过考察中药挥发油对有效成分的透皮促渗效果进行筛选,中药挥发油品种众多,中药外用有效成分复杂,应用这种研究模式无异于大海捞针。在前期研究基础上,笔者提出了基于药性特征开展中药挥发油透皮促渗作用规律及机制研究的思路[32],发现了“热者易效”的规律[31],并且发现高良姜油可能是高效透皮促渗剂,将其应用于氟比洛芬外用制剂的促渗效果和抗炎药效均显著优于市售制剂[33]。因此,热性辛味中药挥发油可能是中药挥发油透皮促渗剂中值得关注的一类,并且外用以治疗寒证为多,“寒者热之”是中医常用的治疗原则,因此这一类挥发油可能有较好的应用前景。
5.3 慢性创面难以愈合
慢性创面一般是指皮肤伤口超过4周未愈合或者伤口持续复发未有明显愈合倾向的难愈性创面,常发于中老年人群,以糖尿病溃疡最多(约占35%),给患者及其家庭带来极大的经济和心理负担。
慢性创面往往伴随有感染,当前采用抗生素治疗容易导致耐药。研究表明,糖尿病足溃疡患者多重耐药菌感染与抗菌药物暴露史、曾经应用第三代头孢菌素有极显著关联性[34]。并且最新研究表明,细菌可以通过IL-1β信号通路来促进创面愈合和毛囊新生,创面治疗应用抗生素可能反而不利于其愈合[35]。
中医药在创面治疗方面有深厚的历史积淀,“煨脓长肉”已被证明是中药如马勃外用治疗糖尿病足的重要治法[36]。煨脓离不开创面微生态的作用,由此可见,中药调节创面微生态控制感染可能比西药抗生素直接杀灭菌群更有利于慢性创面愈合,研究调节创面微生态平衡与创面愈合效果的相关性可能是中药外用促进慢性创面愈合必须要阐明的主要机制,在此基础上,研制有利于调节创面微生态平衡的中药现代外用制剂有非常好的市场化前景。此外,创面微生态和肠道微生态之间是否存在直接联系,也是非常有前景的研究方向。
6 中药外用制剂研究趋势
6.1 创新材料研究
创新材料是中药外用制剂现代化的基础,如何在尊重中药传统制剂特点的基础上研制创新材料是关键。黑膏药是最有特色的中药传统外用制剂之一,但其基质往往不利于药物的溶出。有报道采用静电纺丝技术将黑膏药与聚乙二醇(PEG)制成复合纤维,溶出度试验结果表明与传统的黑膏药相比,难溶性成分血竭的溶出显著增强,当复合纤维中PEG含量为85%时,溶出量最高[37]。此外,也有报道采用静电纺丝技术和高分子材料还原黑膏药基质微观结构,从而研制出具有与黑膏药载药释药行为一致性的新型经皮给药基质[38]。此外,开发新型生物材料如细菌膜、内源性细胞膜和细胞外囊泡等实现中药外用制剂载体的功能化(如靶向、智能响应等)也是未来可能的热点研究方向。
6.2 创新技术应用
中药复杂成分往往给外用制剂研究带来很多难题。以透皮促渗剂研究为例,传统的研究往往是通过考察透皮促渗剂对有效成分的促渗效果来进行评价,透皮实验和成分分析往往都需要很长时间,实验效率很低,耗时往往需要3~5 d,并且成分复杂给分析带来了很大困难。在中药挥发油透皮促渗剂研究过程中,皮肤电阻动力学技术的出现,可以直接测定应用促渗剂后皮肤电阻随时间的变化过程,1 h内就能完成测定,通过与空白溶剂比较可以计算透皮促渗指标,大大提高了透皮促渗评价效率(图1)。当前,皮肤电阻动力学技术已被证明与皮肤角质层屏障功能具有显著的相关性[39],并且与传统的透皮促渗评价方法具有很好的平行性[40]。因此,对于中药外用制剂研究而言,高通量评价技术的应用将会大大提高制剂的研发效率和制剂水平。
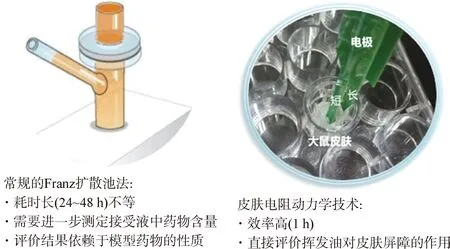
图1 皮肤电阻动力学技术与传统促渗评价技术的比较Fig. 1 Comparison of skin resistance dynamics technique with traditional osmotic evaluation technique
6.3 创新制剂研究
虽然中药现代外用制剂已经发展到了靶向制剂、智能响应制剂,但由于载药效果的限制,往往只能递释中药单体成分,与化学药物制剂已无本质区别,可以考虑采用多元载体技术来解决这一问题。如银屑病是难治性疾病,莪术油具有抗银屑病治疗效果[41],已知机制为抗角质细胞增生[42]和抗血管新生作用[43]。基于环糊精包合物脂质体这一多元载体[44],将莪术油和莪术油环糊精包合物分别载入脂质体的脂质双分子层和内水相制备双重载药脂质体,脂质体在表皮释放出双分子层中的莪术油能够作用于角质形成细胞抑制增生和抗炎,而同时释放出的血管靶向肽cNGR修饰的莪术油环糊精包合物则能够靶向递送发挥抗血管新生作用(图2),从而充分发挥中药多靶点协同起效的优势。
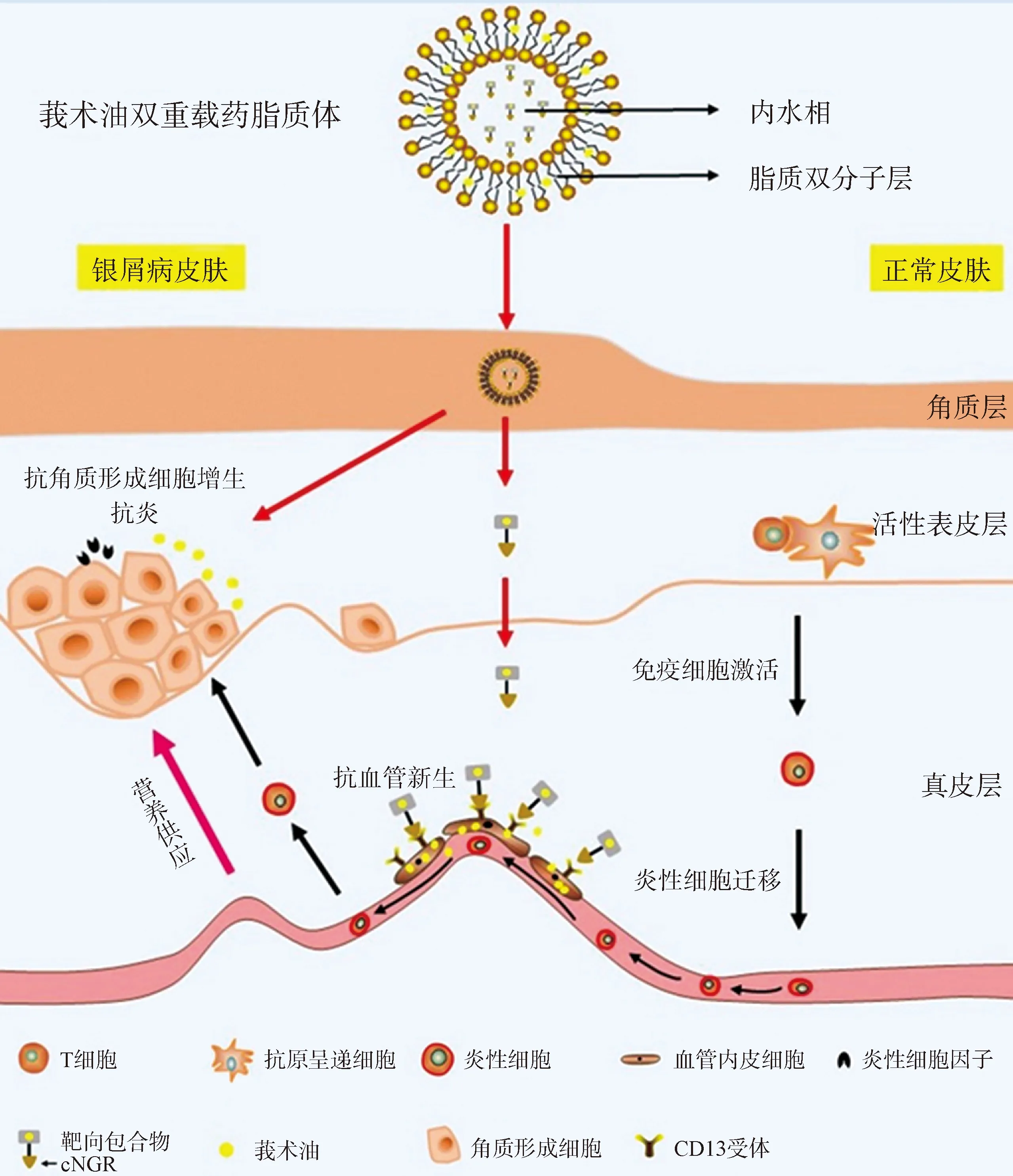
图2 基于环糊精包合物脂质体技术的莪术油经皮外用多靶递送策略Fig. 2 Multi-target transcutaneous delivery strategy of Zedoary turmeric oil based on cyclodextrin inclusion liposome technology
6.4 微生态研究
肠道微生态的研究为阐明口服中药的作用机制提供了全新的视角,使得一系列中药复杂成分的作用机制得到诠释。对于中药外用制剂研究而言,必须要重视创面微生态和皮肤微生态的研究。前者可能是中药外用制剂“煨脓长肉”促进慢性创面愈合的重要机制,其机制研究关系到中药创面外用现代制剂如智能响应制剂的合理设计;后者是近年来的研究新热点,一方面,皮肤微生态的特异性分布可能是穴位敏化的重要机制[45],另一方面皮肤微生态可能与皮肤过敏反应以及肠道微生态之间存在相关性[46]。因此,皮肤微生态的研究对于中药外用制剂的穴位给药机制、避免或减少皮肤不良反应、阐明“外治之理,即内治之理”的科学内涵,可能都具有重要的研究价值。
7 结语
中药外用制剂在中医药的发展史上占有重要地位,到明清时达到鼎盛,“凡汤丸之有效者,皆可熬膏”[1]9,吴尚先采用膏药外用治疗百病,并且系统总结了相关的中医药理论写成《理瀹骈文》一书。但是,近现代以来,中药外用制剂的发展相对于口服、注射制剂严重滞后,2020年版《中国药典》一部共收录1 607种中药制剂,其中外用制剂仅占5.1%,已经到了边缘地位。而在国际市场上,外用制剂发展突飞猛进,有望呈现出与口服、注射制剂“三分天下”的态势。有鉴于此,我们必须直面问题,迎接挑战,坚持中医药理论指导、坚持面向临床应用实际需求、坚持问题导向和交叉创新,把中药外用制剂传承好、发展好。

