基于Wnt/β-catenin信号通路探讨黄芪多糖对脾虚湿困大鼠小肠黏膜损伤修复作用机制
杨彬彬,崔宁,王世军
(1.山东中医药大学健康学院,山东 济南 250355;2.山东中医药大学中医学院,山东 济南 250355)
黄芪入药始载于《神农本草经》,为蒙古黄芪Astragalusmembranaceus(Fisch.) Bge. var. mongholicus (Bge.) Hsiao或膜荚黄芪Astragalusmembranaceus(Fisch.) Bge.的干燥根,列为上品,在我国已有两千多年的药用历史。黄芪味甘、性温,入肺、脾经,具补气升阳、固表止汗、利水消肿、生津养血、行滞通痹、托毒排脓、敛疮生肌等功效,适用于肺脾气虚,输布失常,脾失运化,水湿内停之水肿[1-3]。现代药理学研究表明,黄芪含有黄芪多糖、黄芪皂苷、黄芪黄酮等有效活性成分。其中,黄芪多糖的功效主要为增强免疫功能、抗肿瘤、抗病毒、抗氧化等[4-6]。本课题组前期实验表明,脾虚湿困模型大鼠出现胃肠功能紊乱及小肠黏膜损伤等症状,黄芪多糖可通过调节血清胃泌素、淀粉酶、胆囊收缩素(CCK)、血管活性肠肽(VIP)及尿D木糖排泄率等改善胃肠功能,修复小肠黏膜损伤,但其分子机制尚不清楚[7-8]。因此,本实验通过建立脾虚湿困大鼠模型,进一步观察黄芪多糖通过Wnt/β-catenin信号通路对脾虚湿困大鼠的治疗作用机制。
1 材料与方法
1.1 实验动物
雄性Wistar大鼠60只,体质量(150±10)g,购自北京维通利华实验动物技术有限公司,实验动物许可证号:SCXK(京)2016-0006。饲养于山东中医药大学实验动物中心,SPF级环境喂养,温度23~25 ℃,相对湿度40%~50%,光照时间7:00—19:00。按照国家部属实验动物管理委员会制订的标准饲养并经山东中医药大学实验动物伦理委员会批准(批号:SDUTCM20201029001)。
1.2 药物
黄芪多糖(纯度:90%,Solarbio公司,货号:IA0570),4 ℃保存备用。参苓白术散(山西华康药业股份有限公司,批号:20181204,6 g×8袋)。
1.3 主要试剂、仪器及饲料
大鼠D-乳酸(D-LA)、二胺氧化酶(DAO) ELISA试剂盒(江苏晶美生物科技有限公司,货号:200107KE6、200107KE7);Wnt1、C-MYC、CyclinD1、β-catenin抗体(Abcam公司,货号:ab15251、ab32072、ab40754、ab32572);β-actin抗体(北京中杉金桥生物技术有限公司,货号:TA-09);辣根过氧化物酶标记的山羊抗兔IgG(北京中杉金桥生物技术有限公司,货号:ZB-2301);qPCR试剂盒、RNA提取试剂盒(TaKaRa公司,货号:DRR420B、D9109);PVDF膜、ECL发光试剂盒(Millipore公司,货号:IPVH00010、WBKLS0500)。AIN-76A纯化饲料、高脂低蛋白饲料购自小黍有泰(北京)生物科技有限公司。
TG16W型微量高速离心机(湘仪离心机仪器有限公司);GNP-9080型隔水式恒温培养箱(上海精宏实验设备有限公司);AC8型洗板机(Thermo Labsystems公司);352型酶标仪(Labsystems Multiskan MS公司)。
1.4 方法
1.4.1 造模 大鼠适应性喂养3 d,按照随机数字表法,分为对照组、模型组、黄芪多糖高剂量组、黄芪多糖中剂量组、黄芪多糖低剂量组、参苓白术散(阳性药)组,每组10只。除对照组(不作任何处理,正常饲养)外,其余各组大鼠按照前期课题组模型制备方法造模,具体造模方法为:大鼠每日饲以高脂低蛋白饲料加力竭游泳,连续8周,建立脾虚湿困大鼠模型[7-8],并根据一般状况评分判定造模是否成功,见表1。对照组大鼠饲以AIN-76A纯化饲料。各组大鼠均自由进食、饮水。

表1 脾虚湿困一般状况评分标准Table 1 Scoring standard of general condition of dampness stagnancy due to spleen deficiency
1.4.2 给药 造模成功后,于造模结束后次日黄芪多糖高剂量组按照900 mg·kg-1·d-1、黄芪多糖中剂量组按照600 mg·kg-1·d-1、黄芪多糖低剂量组按照300 mg·kg-1·d-1灌胃[9-10];参苓白术散根据人和大鼠等效剂量系数折算大鼠等效剂量为成人日服剂量的6倍,按照2.5 g·kg-1·d-1灌胃[6],每日1次;每100 g体质量给予1 mL,连续2周,对照组和模型组给予同体积生理盐水灌胃。观察大鼠一般状况并记录大鼠体质量变化情况。
1.4.3 标本采集 各组动物麻醉后,腹主动脉采血,室温静置2 h后低温离心(4 ℃,3 000 r·min-1,10 min,离心半径10 cm),取血清放置于-20 ℃低温冰箱中,备用。取空肠组织于-80 ℃冰箱冷冻保存备用。
1.4.4 血清D-LA、DAO水平检测 按照试剂盒说明,采用ELISA法检测各组大鼠血清D-LA、DAO水平。
1.4.5 小肠推进率检测 脱颈处死大鼠,迅速打开腹腔,摘出小肠,将小肠用生理盐水润湿后置于平板上,不加牵引力使其平铺,分别量取幽门括约肌至色素最前端及幽门括约肌至盲肠距离,以二者之百分比为小肠推进率。小肠推进率=小肠内色素推进距离/全小肠长度×100%。
1.4.6 Western blot法检测小肠Wnt1、β-catenin、CyclinD1、C-MYC蛋白表达 取剪切成小块的小肠组织,匀浆,充分裂解,12 000 r·min-1离心10 min,取上清。BCA法蛋白定量。将提取的蛋白上清加入5×蛋白质凝胶电泳上样缓冲液,混合,95 ℃变性10 min,80 V电压电泳。60 V电压转膜,加入含5%脱脂奶粉的TBST封闭液,室温摇床封闭1 h;将一抗用封闭液稀释;将封闭后的膜直接放入一抗工作液中,4 ℃反应过夜;TBST充分洗涤3次,每次10 min;加入二抗工作液(1∶3 000)中,室温、避光孵育60 min;TBST充分洗涤3次,每次10 min;采用ECL法进行化学发光反应显影,洗片;Image J软件分析灰度值。
1.4.7 qPCR法检测小肠Wnt1、β-catenin、CyclinD1、C-MYC的mRNA表达水平 取小肠组织,根据RNA试剂盒说明书提取总RNA,按照反转录试剂盒说明书步骤合成cDNA,合成后测定cDNA浓度,备用。qPCR法检测小肠Wnt1、β-catenin、CyclinD1、C-MYC的mRNA表达量,相对定量法计算各指标mRNA的2-ΔΔCt值。引物序列见表2。

表2 qPCR引物序列Table 2 qPCR primer sequence

2 结果
2.1 一般状况评分及体质量变化
对照组大鼠一般状况稳定,进食及饮水量正常,体质量稳定上升。模型组大鼠自第2周开始出现体质量增长缓慢,并逐渐出现食欲不振,神倦懒动、眯眼、被毛无光等状况,一般状况评分显著高于对照组(P<0.01)。黄芪多糖高剂量组及参苓白术散组一般状况评分显著低于模型组(P<0.01);黄芪多糖高、中剂量组及参苓白术散组第10周体质量显著高于模型组(P<0.05)。见图1~2。
2.2 黄芪多糖对脾虚湿困大鼠小肠推进率的影响
与对照组比较,模型组大鼠小肠推进率显著降低(P<0.01);与模型组比较,黄芪多糖高、低剂量组和参苓白术散组小肠推进率明显升高(P<0.05,P<0.01)。见图3。
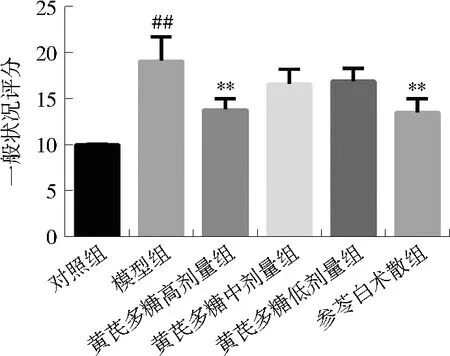
注:与对照组比较,##P<0.01;与模型组比较,图1 黄芪多糖对脾虚湿困大鼠一般状况评分的影响Fig. 1 Effect of APS on general condition scores of rats with dampness stagnancy due to spleen deficiency

注:与对照组比较,##P<0.01;与模型组比较,图2 黄芪多糖对脾虚湿困大鼠体质量的影响Fig. 2 Effects of APS on body weight of rats with dampness stagnancy due to spleen deficiency
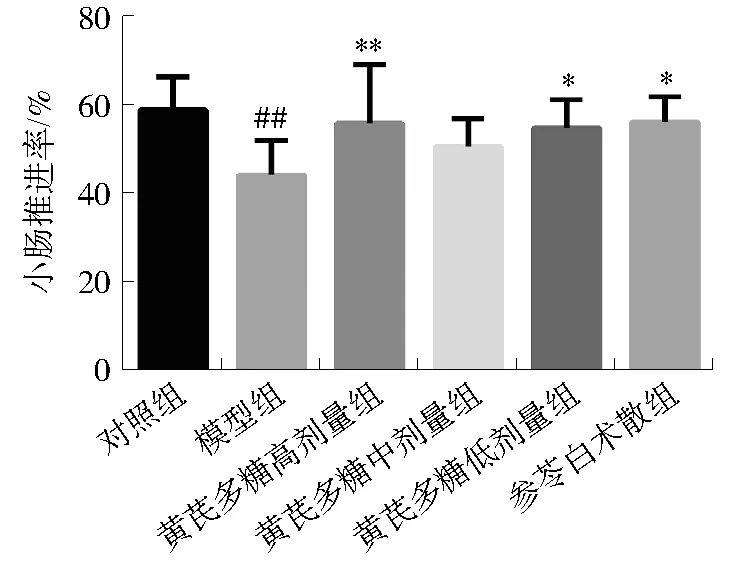
注:与对照组比较,##P<0.01;与模型组比较,图3 黄芪多糖对脾虚湿困大鼠小肠推进率的影响Fig. 3 Effects of APS on the propulsion rate of the small intes-tine in rats with dampness stagnancy due to spleen deficiency
2.3 黄芪多糖对脾虚湿困大鼠血清D-LA、DAO水平的影响
与对照组比较,模型组大鼠血清D-LA、DAO水平显著升高(P<0.01);与模型组比较,黄芪多糖高、中、低剂量组,参苓白术散组D-LA、DAO水平显著降低(P<0.05,P<0.01)。见图4。

注:与对照组比较,##P<0.01;与模型组比较,图4 黄芪多糖对脾虚湿困大鼠血清D-LA、DAO水平的影响Fig. 4 Effects of APS on serum D-LA, DAO levels in rats with dampness stagnancy due to spleen deficiency
2.4 黄芪多糖对脾虚湿困大鼠Wnt1、β-catenin、CyclinD1、C-MYC蛋白表达的影响
与对照组比较,模型组Wnt1、β-catenin、CyclinD1、C-MYC蛋白表达显著升高(P<0.01)。与模型组比较,黄芪多糖高、中、低剂量组及参苓白术散组Wnt1、β-catenin、C-MYC蛋白表达均显著降低(P<0.01),黄芪多糖高、中剂量组CyclinD1蛋白表达显著降低(P<0.05,P<0.01)。见图5。
2.5 黄芪多糖对脾虚湿困大鼠Wnt1、β-catenin、CyclinD1、C-MYC mRNA表达的影响
与对照组比较,模型组Wnt1、β-catenin、CyclinD1、C-MYC mRNA表达显著升高(P<0.01)。与模型组比较,黄芪多糖高、中剂量组及参苓白术散组Wnt1、β-catenin、CyclinD1、C-MYC mRNA表达均显著降低(P<0.01)。见图6。

注:与对照组比较,##P<0.01;与模型组比较,图5 各组大鼠Wnt1、β-catenin、CyclinD1、C-MYC蛋白表达的比较Fig. 5 Comparison of protein expressions of Wnt1, β-catenin, CyclinD1 and C-MYC of rats in each group

注:与对照组比较,##P<0.01;与模型组比较,图6 各组大鼠Wnt1、β-catenin、CyclinD1、C-MYC mRNA表达的比较Fig. 6 Comparison of mRNA expressions of Wnt1, β-catenin, CyclinD1 and C-MYC of rats in each group
3 讨论
在中医理论中,脾主运化的功能包括“化”和“运”两个方面。“化”指的是脾把水谷等精微之物转化成水液,再把水液转化为汗、尿等;“运”指的是脾把津液输布全身。脾虚运化不及,不仅可引起营养物质的吸收输布受阻,导致脏腑组织失养,也可引起水液的生成转输障碍,导致水湿内停。脾虚时常表现为食欲不振、脘腹胀闷、大便稀薄等胃肠疾病的症状以及肠黏膜屏障损伤,脾胃功能的正常是肠道黏膜屏障功能正常的基础[11]。
本课题组前期通过模拟饮食失节加力竭运动建立脾虚湿困大鼠模型,发现模型大鼠出现明显胃肠功能和病理形态的异常,主要表现为:胃动素、胃泌素等水平下降,胃肠动力、吸收障碍;十二指肠黏膜缺损、固有层、黏膜下层血管扩张充血、出血,黏膜下层浆细胞浸润[9]。说明脾虚湿困状态下,肠黏膜结构完整性被破坏,影响肠黏膜屏障功能。可见由肠黏膜损伤导致肠道通透性增高,引起肠道细菌和毒素移位,使得消化吸收功能下降,可能是导致脾虚湿困的机制之一,研究显示益气健脾对于修复胃肠黏膜损伤具有重要意义[11-12]。
本课题组对黄芪及其各一级拆分组分健脾祛湿机制的研究结果显示:黄芪能改善脾虚湿困大鼠的一般状况,调节蛋白和脂类代谢,促进水液运化,纠正胃肠及肝脏形态和功能的异常;黄芪多糖组分调节效果最为明显,是黄芪健脾祛湿的主要物质基础[13]。黄芪多糖通过升高模型大鼠血清胃动素(MTL)、胃泌素(Gas)等水平,改善脾虚湿困大鼠胃肠功能,帮助胃排空[14]。而MTL作为脑肠肽激素能够诱发小肠分节运动与胃收缩,还能刺激胃液与胃蛋白酶分泌,帮助食物消化。本实验中脾虚湿困大鼠小肠推进率降低,提示出现胃肠功能下降;黄芪多糖能提高模型大鼠小肠推进率,提示黄芪多糖具有促进胃肠功能的作用,这可能与其升高MTL水平有关。有研究显示黄芪多糖可加速胃肠黏膜损伤早期修复过程[15]。
脾虚湿困大鼠十二指肠全基因表达谱分析结果显示[16-17],黄芪多糖能显著降低脾虚湿困大鼠Wnt1水平。Wnt1是Wnt/β-catenin信号通路的始动因子及控制细胞生长、增殖的关键分泌信号分子。Wnt/β-catenin信号通路是Wnt经典途径,已经被证明与很多疾病的发生和发展相关。Wnt/β-catenin信号通路的激活可通过一系列过程使胞质内大量游离的β-catenin进入细胞核,并与细胞核内转录因子TCF4结合激活下游的c-myc、Cyclin D1等靶基因,从而影响细胞的增殖、凋亡过程,诱导细胞发生增生性、炎症性或者肿瘤性病变[18-24]。
有研究发现黄芪可下调糖尿病肾病大鼠肾间质Wnt/β-catenin信号通路的表达,延缓大鼠肾间质纤维化的进程,发挥肾脏的保护作用[25]。关于黄芪多糖是否通过Wnt/β-catenin改善脾虚湿困大鼠胃肠功能,修复小肠黏膜上皮损伤尚未见报道。
本实验基于前期黄芪多糖对于脾虚湿困大鼠胃肠功能紊乱及小肠黏膜损伤修复研究,进一步探讨Wnt通路在这一修复过程中的作用。结果显示,脾虚湿困大鼠血清DAO水平升高,提示出现肠黏膜损伤;Wnt通路蛋白Wnt1、β-catenin、CyclinD1、C-MYC蛋白表达异常升高,提示Wnt/β-catenin通路异常激活,诱发细胞发生增生性、炎性病变从而导致了肠黏膜上皮细胞损伤,因此推测肠黏膜损伤可能与Wnt通路异常激活有关。而黄芪多糖干预后,以上Wnt通路相关蛋白表达水平降低,提示黄芪多糖能够下调Wnt信号通路,修复肠黏膜上皮细胞损伤,降低血清DAO水平,从而改善胃肠功能,提高小肠推进率,发挥其益气健脾祛湿的功效。

