雄激素受体在T1期三阴性乳腺癌组织中的表达及其临床意义
李春燕,程志原,马善义,董 骏,朱加作
(宣城市中心医院肿瘤科,安徽 宣城 242000)
三阴性乳腺癌(triple-negative breast cancer,TNBC)是雌激素受体(estrogen receptor,ER)、孕激素受体(progestrogen recepor,PR)和人类表皮生长因子受体2(human epidermal growth factor recepor-2,HER-2)均呈阴性表达的乳腺癌类型[1-2]。据国内多家医院的流行病学数据统计,TNBC占乳腺癌病理类型的10%左右,且确诊时TNBC临床分期以0~Ⅱ期为主(约75%),其中T1期TNBC诊断率约为17.91%~24.30%[3-4]。即便如此,T1期TNBC患者的中位无复发生存时间仍不超过30个月。与其他亚型相比,TNBC侵袭性强、复发率和转移率高,因此患者预后差,生存率低。寻找有效的生物标志物是制定治疗策略的重要因素之一。雄激素受体(androgen receptor,AR)是一种类固醇激素受体,与其配体雄激素结合之后作用于下游靶基因,参与调节细胞增殖信号转导通路[5-6]。本研究旨在检测T1期TNBC患者乳腺组织中AR的表达,并进一步分析其与患者临床病理特征及预后的关系,现报道如下。
1 资料与方法
1.1 一般资料收集2015年3月-2017年3月于沧州市人民医院肿瘤科收治的87例T1期TNBC患者病理组织、癌旁组织、临床病理资料和随访资料,患者年龄22~74岁,平均年龄(45.16±10.16)岁。本研究经我院医学伦理委员会审查同意(审批号:20151325),患者及其家属均知情并签署知情同意书。
1.2 纳入与排除标准[7]纳入标准:经穿刺活检均确诊为TNBC,且临床分期为T1期;肿瘤最大直径≤2cm;术前均未进行放疗、化疗等辅助治疗。排除标准:合并其他恶性肿瘤;合并严重感染性疾病或血液、呼吸、肝肾等疾病。
1.3 方法
1.3.1 AR表达的测定将收集的病理组织及癌旁组织石蜡块连续切片,厚度4 μm,于60℃烤箱中烘干2 h。切片脱蜡至水,切片脱蜡至水;3%H2O2处理15 min;柠檬酸钠修复液修复;BSA溶液封闭20 min。加入一抗4℃孵育过夜;第二天加入二抗室温孵育30 min,DAB显色,苏木素复染、脱水、透明。封片,镜检。单克隆抗体购自德国默克公司,免疫组化SP试剂盒、DAB显色剂购自上海信裕生物科技有限公司。实验操作均严格按照说明书进行。
1.3.2 阳性表达判断标准由2位或2位以上病理医师观察,400倍视野下随机选取5个不同视野,以细胞核内出现黄褐色或棕褐色的细胞为阳性。根据染色程度分为:无染色(-)、浅黄色(+)、棕黄色(++)、黄褐色(+++),分别代表0~3分。根据视野内阳性细胞所占比例分为:0%~10%(-)、11%~25%(+)、26%~50%(++)、51%~75%(+++)、75%~100%(++++),分别代表0~4分。最终得分以染色强度得分和阳性细胞数所占比例之积,最终得分≥3分则为阳性,最终得分<3分则为阴性。
1.3.3 患者临床资料的收集收集患者年龄、月经情况、病理类型、细胞核相关抗原Ki67(Ki-67)指数、组织学分级、脉管浸润、淋巴结状态等。本研究关于Ki-67临界值定义:参照2013年圣盖伦共识[8]推荐,将Ki-67比例≥20%为高表达,比例<20%为低表达;参照诺丁汉联合组织学分级标准[9],将TNBC分为1、2、3级。
1.3.4 随访采用电话、信函和查阅医院病案记录等方式进行随访,记录患者总生存率。生存时间定义为从术后第1天起至任何原因导致的死亡或末次随访时间。随访截止至2020年3月31日。
1.4 统计学处理采用SPSS22.0统计学软件进行统计分析,计量资料以均值±标准差(±s)表示,比较采用单因素方差分析,两组比较采用SNK-q法。计数资料以例(%)表示,采用χ2检验。Kaplan-Meier生存曲线分析T1期TNBC患者AR表达与预后生存期的关系,比较采用Log-rank检验,检验水准α=0.05。
2 结果
2.1 T1期TNBC患者组织中AR表达情况87例T1期TNBC患者中,AR阳性表达28例(32.18%),低于癌旁组织70例(80.45%)。免疫组化结果发现AR表达呈阴性者胞核无着色(图1A),AR表达呈弱阳性者少数胞核内可见黄褐色颗粒(图1B),AR表达呈强阳性者多数胞核内可见黄褐色或棕色颗粒(图1C)。
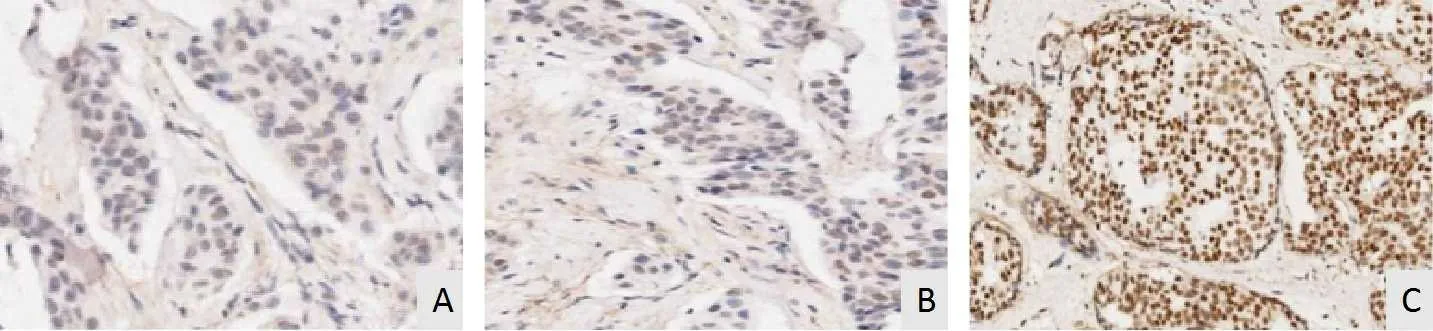
图1 免疫组化染色检测AR表达情况(SP法,×200)
2.2AR表达与T1期TNBC患者临床病理特征的关系AR表达在Ki-67指数≥20%、组织学分级为G3、腋窝淋巴结转移患者中阳性表达率降低,差异均有统计学意义(P<0.05);AR表达与患者年龄、月经情况、病理类型、脉管癌栓等均无关,差异均无统计学意义(P>0.05),见表1。
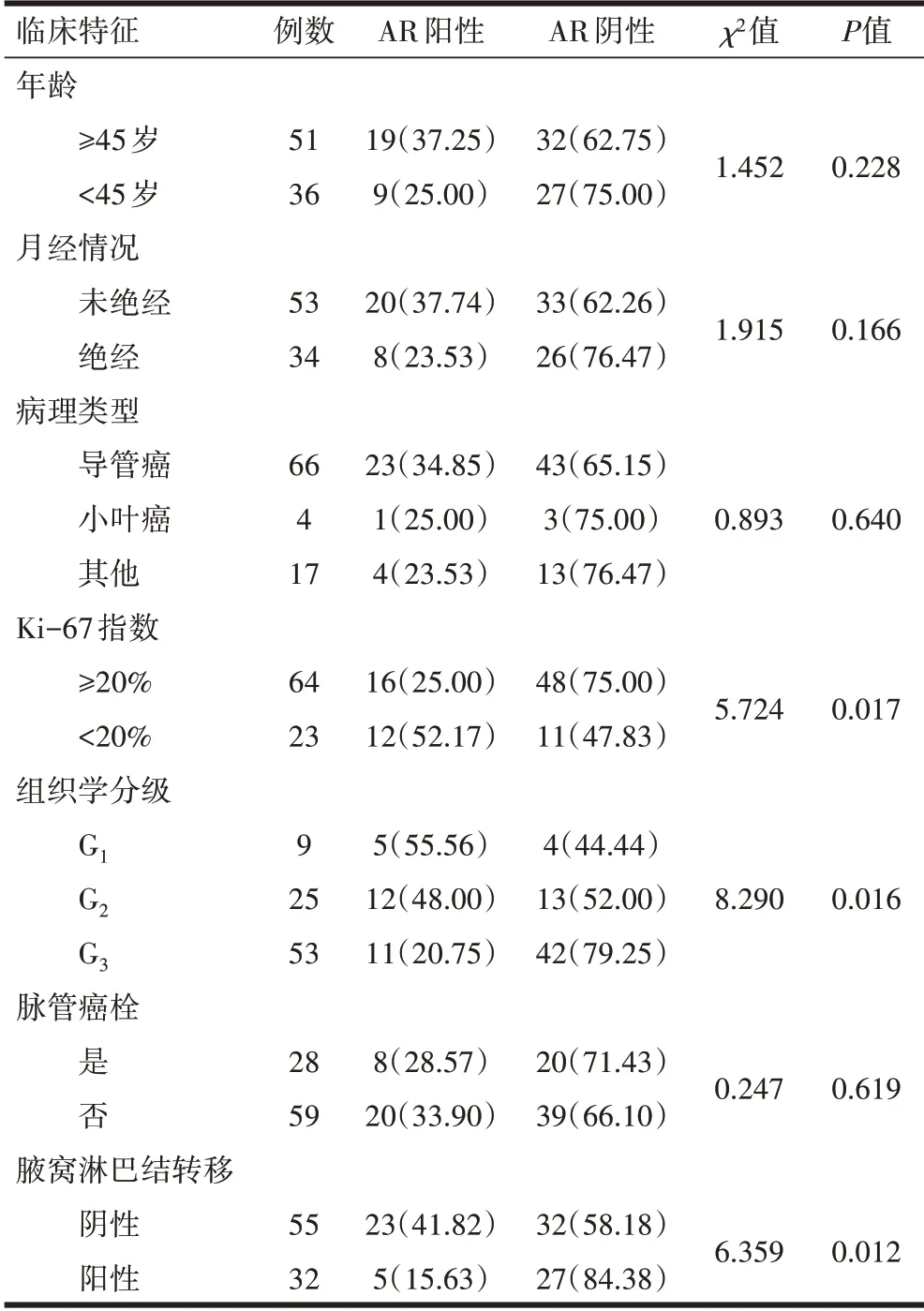
表1 AR表达与T1期TNBC患者临床病理特征的关系/n(%)
2.3 AR表达与T1期TNBC患者临床病理特征多因素分析T1期TNBC患者的Ki-67指数、组织学分级是AR表达的独立影响因素,差异均有统计学意义(P<0.05),见表2。
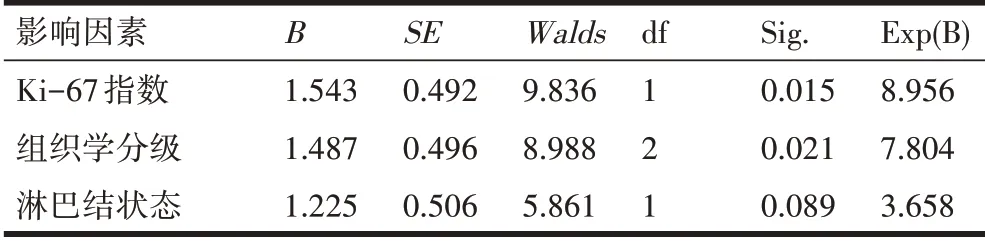
表2 AR表达与T1期TNBC患者临床病理特征多因素分析
2.4 AR表达与T1期TNBC患者生存预后的关系截止至2020年3月31日,87例T1期TNBC患者中共死亡29例。其中AR阳性组总生存率为82.14%(23/28),高于AR阴性组59.32%(35/59),差异有统计学意义(P<0.05)。AR阳性组中位生存时间为49个月,高于AR阴性组中位生存时间39个月,Log-rank检验为P=0.027,差异有统计学意义(P<0.05),见图2。

图2 AR表达与T1期TNBC患者预后生存期的关系
3 讨论
AR与ER和PR同属于类固醇激素家族,其中,ER和PR既可作为用于判定TNBC发生,也是内分泌治疗过程中的靶标[10-11],而AR在TNBC中的发病机制尚未阐明,目前也未出现与其相关的靶向治疗方案。AR是核受体超家族的一员,在人体的多数组织和器官中均有分布。正常状态下,AR构象处于稳定状态,与其配体雄激素结合而激活时,自身构象发生改变并调控靶基因的表达,可参与调控细胞增殖活动[12-13]。本研究结果中,AR阳性表达率为32.18%(28/87),低于癌旁组织80.45%(70/87),符合既往研究结果[14-15],表明AR及其配体表达与对TNBC具有重要的研究价值,可调控TNBC瘤体的生长转移。
AR在乳腺癌发生中的作用是复杂的,若没有相关配体结合,AR可在细胞质中被热休克蛋白和伴侣复合物(HSP-70,HSP-90)保持其非活性状态[16]。若与配体结合后,受体-激素复合物进入细胞核,促进目标基因的辅激活-介导转录(转录/基因组激活模式),并通过负反馈抑制AR转录。除此以外,AR也可以通过一种非转录/非基因组的机制被激活[17],这种机制不需要DNA或RNA的相互作用,并且以一种依赖或不依赖于ERK的方式通过信号转导调节AR活性[18-20]。在本研究中,AR在Ki-67指数≥20%、组织学分级为G3、淋巴结状态为阳性的患者中阳性表达率降低,其中,Ki-67指数、组织学分级是T1期TNBC患者AR表达的独立影响因素。说明AR表达缺失可提高癌细胞增殖能力,并诱导癌细胞发生转移,干扰AR相关的的信号通路可对TNBC患者的治疗产生一定的积极意义[21]。因此,AR有望成为未来治疗TNBC的新型靶点。
AR在TNBC患者中的预后影响是有争议的。一些研究已经强调了管腔雄激素受体TNBC亚型的良好预后,例如AR阴性TNBC女性患者5年生存率低于AR阳性TNBC或其他组织学亚组[22,23]。在本研究中,AR阳性组总生存率和中位生存时间优于AR阴性组,说明AR的表达缺失预示着TNBC患者生存预后不良。但本研究未对患者的无病生存时间进行统计,有待于今后延长随访时间以期为AR阳性表达与TNBC患者预后的关系分析提供更充分的临床证据。
综上,在T1期TNBC中存在AR的阳性表达,但阳性表达率较低,且AR表达与Ki-67指数、组织学分级有关。此外AR阳性表达预示着TNBC患者生存预后良好。因此,若在TNBC的T1期对患者进行AR针对性治疗,有望提高患者预后生存期。

