蜕壳周期内中华绒螯蟹钙含量、组织结构及相关基因表达变化
杨 航,杨志刚,张 龙
( 1.上海海洋大学,农业农村部淡水水产种质资源重点实验室,上海 201306; 2.上海海洋大学,农业农村部鱼类营养与环境生态研究中心,上海 201306; 3.上海海洋大学,水产科学国家级实验教学示范中心,上海 201306 )
中华绒螯蟹(Eriocheirsinensis),俗称河蟹,为我国水产养殖业主要的淡水蟹类养殖种类之一,具有较高的经济价值。蜕壳是中华绒螯蟹必经的生理过程,中华绒螯蟹长至成熟通常蜕壳约20次,并且在幼蟹阶段会蜕壳约11次[1-3]。然而,在实际养殖中,由于蟹蜕壳的存活率低,导致中华绒螯蟹养殖的成本提高,影响了养殖户的经济效益[4-6]。
钙是中华绒螯蟹蜕壳不可缺少的物质。中华绒螯蟹外壳及体内的钙会随着旧外壳的蜕去而流失,蜕壳后蟹会从水体、食物等来源中获取和吸收钙质[7-9]。已有研究表明,肝胰腺和鳃均与钙离子交换有关[10-12]。实际养殖过程中,在蟹大面积蜕壳季节到来时,养殖户会往蟹塘中投入适量的钙制剂(如磷酸二氢钙),以保证中华绒螯蟹能摄入足够的钙离子,避免其在蜕壳时死亡[13]。不过,关于中华绒螯蟹的钙离子交换机制的研究较少。
目前,蜕壳死亡率高仍是中华绒螯蟹养殖需解决的问题。笔者通过对不同蜕壳时期的中华绒螯蟹的肝胰腺和鳃中的钙含量进行测定,结合组织学和分子生物学技术,观察组织结构的变化,分析钙网蛋白基因表达量,初步探究蜕壳周期内中华绒螯蟹钙离子的变化情况,以期为进一步研究如何提高中华绒螯蟹蜕壳的存活率,增加中华绒螯蟹养殖产量,扩大养殖效益提供一定理论基础。
1 材料与方法
1.1 试验材料
试验于2019年4月在上海海洋大学水产与生命学院进行。中华绒螯蟹为1年生幼蟹,取自上海市崇明县上海海洋大学崇明基地,平均体质量(5.63±2.35) g。将蟹养殖在配置有循环水系统的双层玻璃养殖缸内,每层养殖缸内部用塑料板分隔成约20 cm×20 cm的隔间,每个隔间放1~2只蟹。试验期间自然水温,自然光节律,人工充氧,每日更新约1/4的水,每日傍晚投喂,喂食前清除残饵。
1.2 样品采集
通过观察中华绒螯蟹外壳颜色的深浅变化和腹部缝线的开裂情况,初步区分蜕壳间期和蜕壳前期的蟹,之后采用文献[14]的方法在光镜下确定蜕壳时期。一般规定中华绒螯蟹在蜕下旧壳后的0.5 h内为蜕壳期。在蟹蜕下旧壳的0.5 h后直至新壳未完全硬化之前为蜕壳后期。通常将中华绒螯蟹的蜕壳时期分为4个时期,分别是蜕壳间期(C期)、蜕壳前期(D期)、蜕壳期(E期)及蜕壳后期(AB期)[15]。根据文献[14]确定中华绒螯蟹的蜕壳时期,收集不同蜕壳时期的样本,每个时期至少10只蟹。解剖前将中华绒螯蟹置于冰上使其休克。肝胰腺和鳃的样品第1部分保存于-20 ℃冰箱用于钙含量的测定,第2部分保存于波恩氏固定液中用于苏木精—伊红染色,第3部分保存于-80 ℃冰箱用于荧光定量PCR。
1.3 钙含量测定
肝胰腺和鳃的钙含量测定采用钙测定试剂盒(甲基百里香酚蓝比色法,南京建成生物工程研究所),单位以质量摩尔浓度表示(mmol/g),蛋白含量采用蛋白定量测试盒(考马斯亮蓝法,南京建成生物工程研究所)测定。根据试剂盒说明书进行测定。
1.4 常规苏木精—伊红染色
将肝胰腺和鳃样品在波恩氏固定液中固定12 h后,用梯度体积分数的乙醇脱水,用二甲苯透明,石蜡包埋,旋转切片机切片,切片厚度为5 μm,用苏木精—伊红进行常规染色,在光学显微镜下观察显微结构。
1.5 荧光定量PCR
采用Trizol法提取肝胰腺和鳃样品的总RNA后,用荧光定量专用反转录试剂进行反转录PCR,得到的反应液进行荧光定量PCR。采用7500实时荧光定量PCR系统,用荧光定量预混液(南京诺唯赞生物科技有限公司)进行实时荧光定量PCR。扩增在96孔板中进行,每个样品具有3个平行孔。用中华绒螯蟹的β-actin基因作为内参,本实验室的转录组库中的中华绒螯蟹的钙网蛋白基因序列作为参考序列,利用Primer Premier 5.0软件设计引物。引物序列见表1,实时荧光定量PCR反应采用10 μL的体系。使用比较阈值循环(2-ΔΔCt)公式计算转录物水平。

表1 相关引物及其序列Tab.1 Primers and their sequences
1.6 数据处理
所有数据采用平均值±标准误差表示,P<0.05时为统计学差异显著。采用GraphPad Prism 7.0软件绘图,Adobe Illustrator CS 5修图。采用SPSS 24.0软件对试验数据进行统计学分析,用Levene检验方法检测方差齐次性,当不满足使用齐性方差时进行反正弦或平方根处理,然后对试验结果进行单因素方差分析和Duncan′s多重比较。
2 结果与分析
2.1 钙含量
在肝胰腺中,蜕壳后期的钙质量摩尔浓度显著高于其他3个时期(P<0.05),蜕壳间期、蜕壳前期和蜕壳期之间未见显著差异(P>0.05)(图1)。在鳃中,蜕壳前期的钙含量最高,蜕壳期的钙质量摩尔浓度最低,蜕壳间期与蜕壳前期无显著差异,蜕壳期与蜕壳后期无显著差异(P>0.05)(图2)。
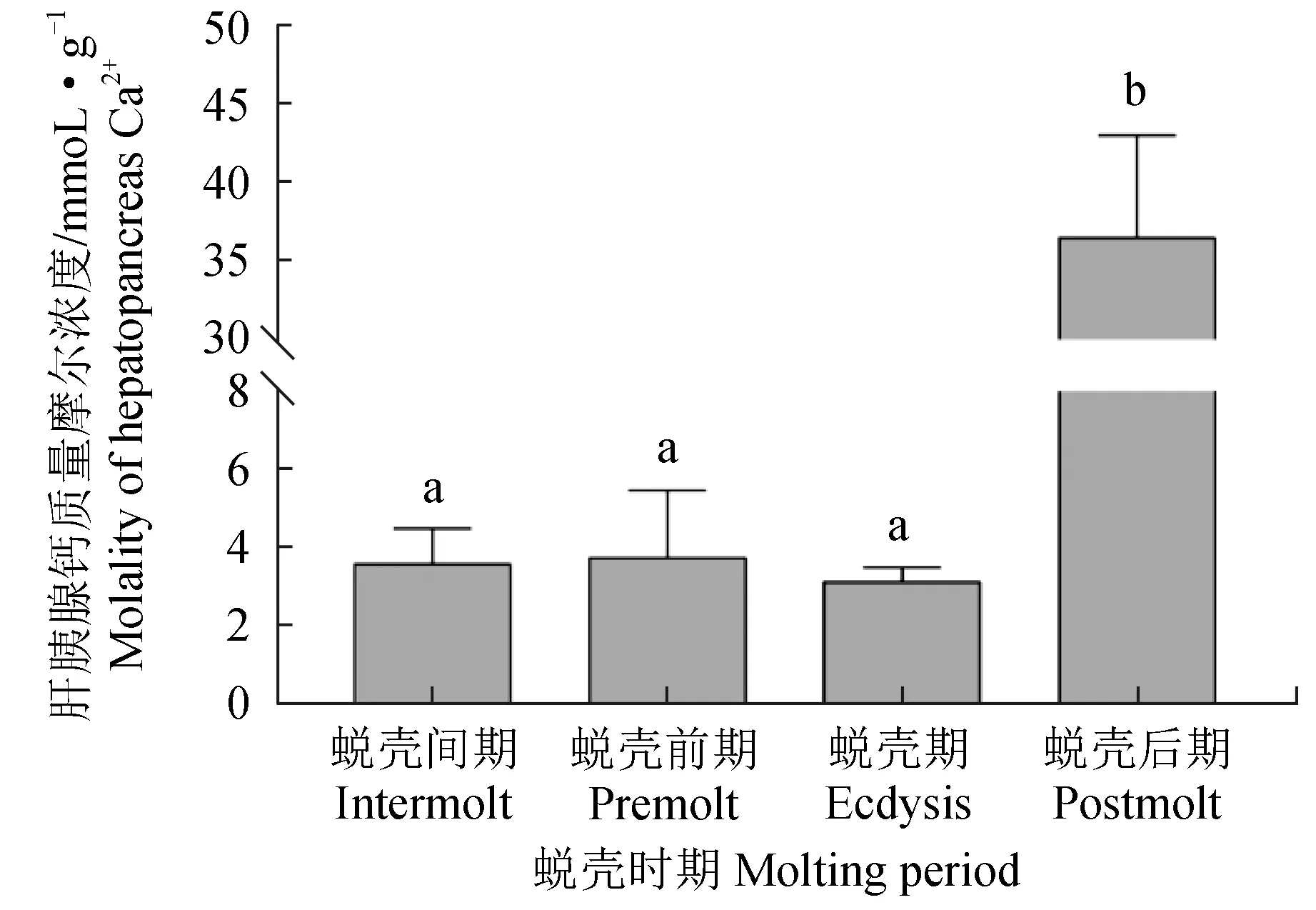
图1 不同蜕壳时期中华绒螯蟹肝胰腺中的钙质量摩尔浓度Fig.1 Calcium molality in hepatopancreas of Chinese mitten crab E. sinensis during the molting cycle不同字母表示差异显著,相同字母表示差异不显著,下同.Means with different letters are significant difference, and means with same letter are not significant difference, et sequentia.
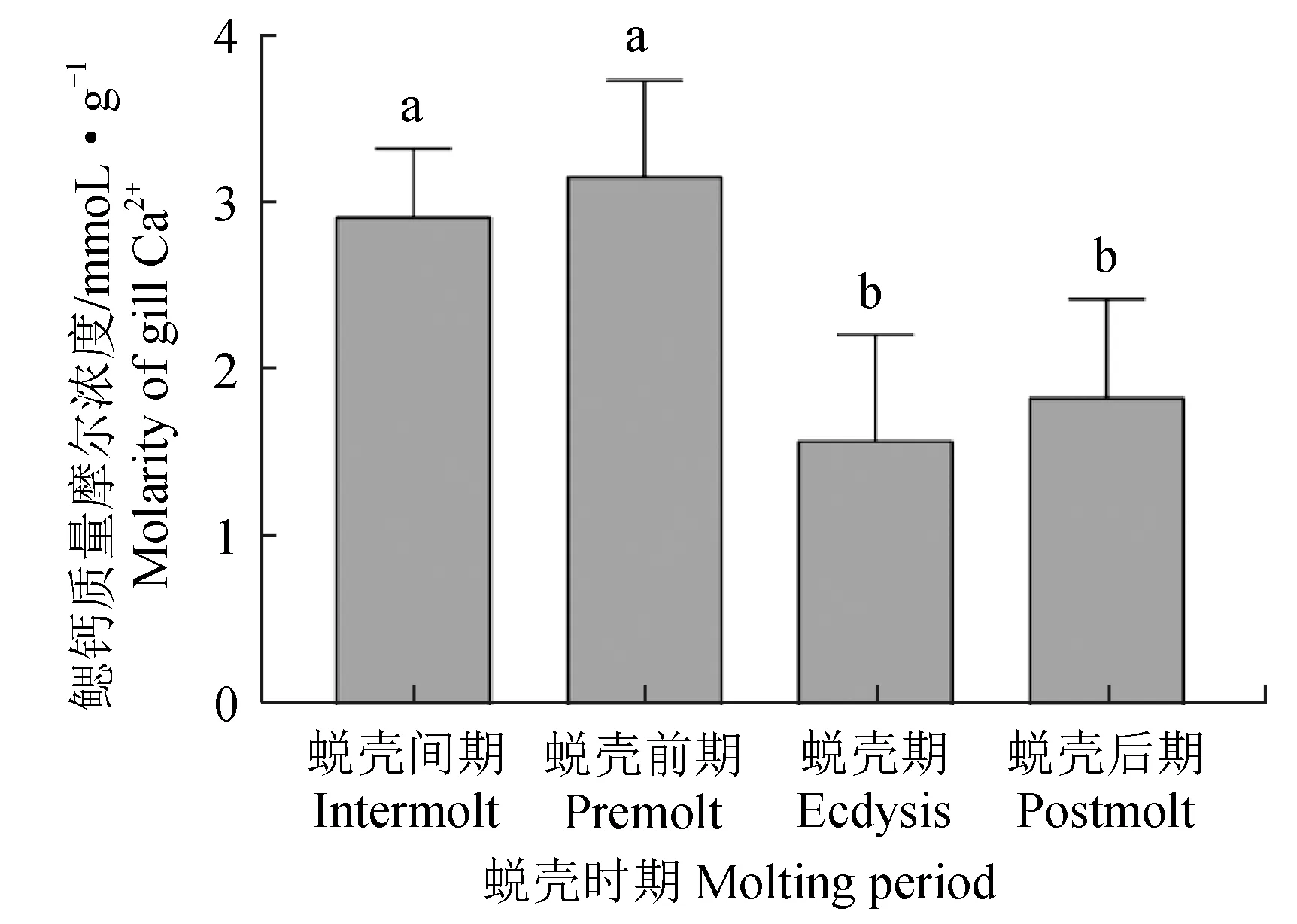
图2 不同蜕壳时期中华绒螯蟹鳃中的钙质量摩尔浓度Fig.2 Calcium molality in gill of Chinese mitten crab E. sinensis during the molting cycle
2.2 组织学观察
通过光学显微镜观察肝胰腺组织苏木精—伊红染色的切片,在蜕壳间期(图3a~b)和蜕壳前期(图3c~d),肝胰腺肝小管的细胞中有较多内容物,染色较深;在蜕壳期(图3e~f)和蜕壳后期(图3g~h),肝胰腺肝小管中的细胞内容物减少,染色较浅。通过光学显微镜观察鳃组织苏木精—伊红染色的切片,蜕壳间期(图4a~b)和蜕壳前期(图4c~d)的鳃没有显著差异,鳃叶末端有边缘管结构,且上皮细胞层与外层角质层分离成空腔。在蜕壳期(图4e~f),鳃的上皮细胞层与外层角质层松散分离,鳃叶末端边缘管处的空腔较大。在蜕壳后期(图4g~h),鳃的边缘管结构恢复正常形态,空腔恢复正常形态。
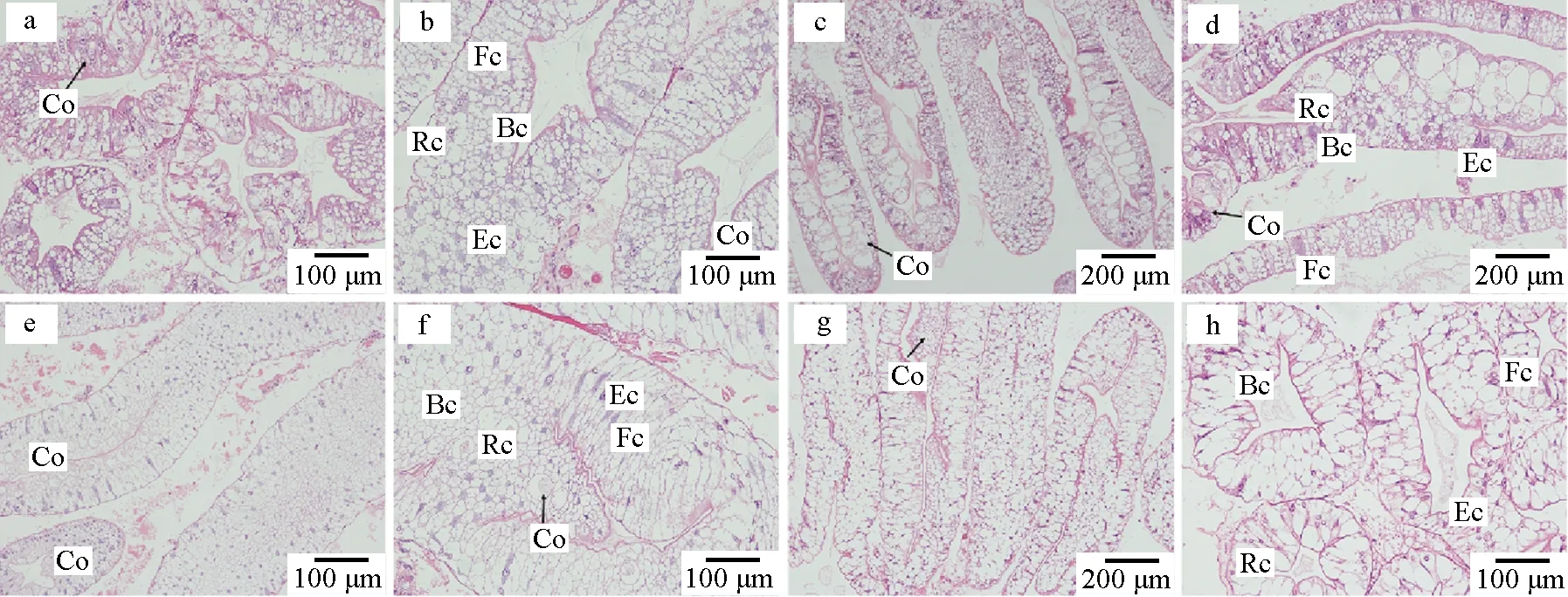
图3 不同蜕壳时期中华绒螯蟹肝胰腺的组织学观察Fig.3 Histological observation of the hepatopancreas of Chinese mitten crab E. sinensis during the molting cyclea~b.蜕壳间期; c~d.蜕壳前期; e~f.蜕壳期; g~h.蜕壳后期; Co.细胞内容物; Rc.储存细胞; Bc.吸收细胞; Fc.纤维细胞; Ec.胚胎细胞.a—b.intermolt; c—d.premolt; e—f.ecdysis; g—h.postmolt; Co.cell content; Rc.resorptive cell; Bc.bulliform cell; Fc.fibrillar cell; Ec.embryonic cell.

图4 不同蜕壳时期中华绒螯蟹鳃的组织学观察Fig.4 Histological observation of the gill of Chinese mitten crab E. sinensis during the molting cyclea~b.蜕壳间期; c~d.蜕壳前期; e~f.蜕壳期; g~h.蜕壳后期; Pc.柱状细胞; El.上皮细胞; Cu.角质层; Mv.边缘管; Ha.血淋巴; ICu.内角质层; OCu.外角质层.a—b.intermolt; c—d.premolt; e—f.ecdysis; g—h.postmolt; Pc.pillar cell; El.epithelial layer; Cu.cuticle; Mv.marginal vessel; Ha.hemocyte; ICu.inter cuticle; OCu.outer cuticle.
2.3 钙网蛋白基因表达量
荧光定量PCR的分析结果表明,在肝胰腺中,钙网蛋白基因的表达量在蜕壳前期最低,在蜕壳期最高(P<0.05)(图5~6)。与蜕壳期的表达量相比,蜕壳后期的表达量略有降低,但变化不显著(P>0.05)。在鳃中,钙网蛋白基因的表达量在蜕壳前期最低,在蜕壳后期最高(P<0.05)。表达量在蜕壳期和蜕壳后期逐渐升高,但变化不显著(P>0.05)。
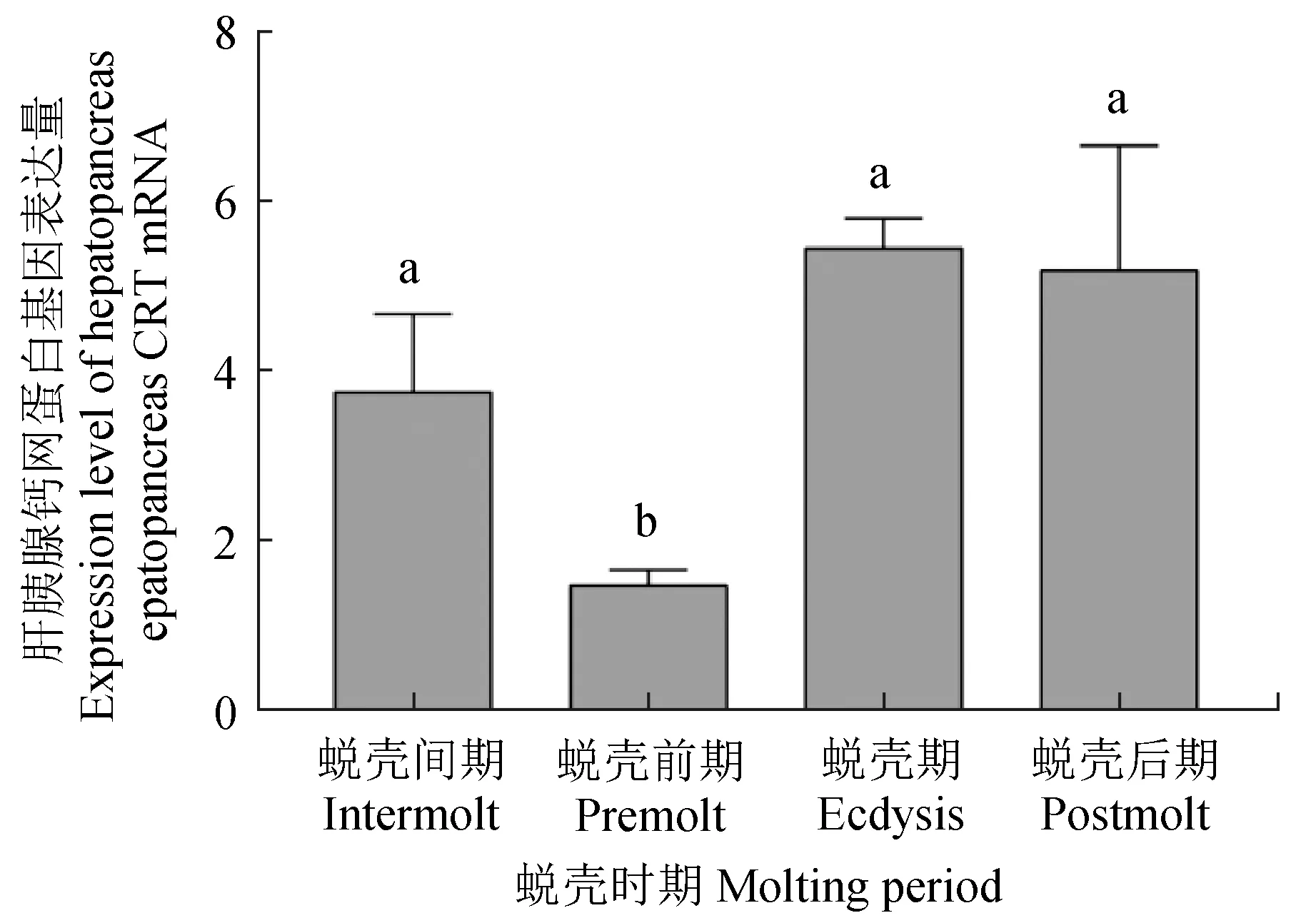
图5 不同蜕壳时期中华绒螯蟹肝胰腺中的钙网蛋白基因的表达分析Fig.5 Expression of CRT mRNA in hepatopancreas of Chinese mitten crab E. sinensis during the molting cycle
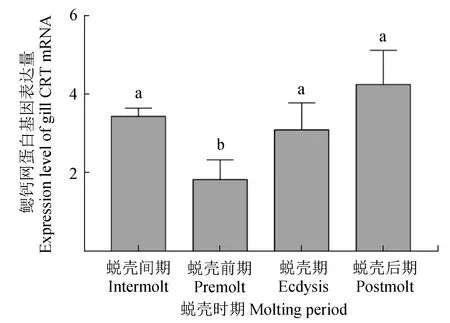
图6 不同蜕壳时期中华绒螯蟹鳃中的钙网蛋白基因的表达分析Fig.6 Expression of CRT mRNA in gill of Chinese mitten crab E. sinensis during the molting cycle
3 讨 论
3.1 钙含量
在蜕壳后期,肝胰腺中的钙含量显著增加,可能是中华绒螯蟹在蜕壳后从外界摄入钙质,以促进机体功能恢复及进行外壳矿化[16]。中华绒螯蟹通常通过两种途径获得营养物质,一种是从食物中摄入,另一种是从水体中摄入。食物中摄入的钙质储存在肝胰腺,水体中摄入的钙质通过鳃转运至机体内。已经有研究表明,中华绒螯蟹的鳃具有交换与运输离子的功能[17-21]。中华绒螯蟹在蜕壳前会补充大量营养物质及钙质,以确保蜕壳顺利完成。因此,在蜕壳间期和蜕壳前期,鳃中的钙含量较高。中华绒螯蟹完成蜕壳后,机体中的钙质流失严重,结合切片观察结果,中华绒螯蟹的鳃在蜕壳期的结构尚未恢复正常形态,此时可能无法发挥正常功能,并且刚蜕完壳的蟹身体机能较为虚弱,通常蛰伏不动,不进食不活动,所以鳃中的钙含量在蜕壳期较低[22]。
3.2 组织学观察
通过观察苏木精—伊红染色的切片结果,在肝胰腺中观察到的细胞内容物有可能是某些营养物质,因为这些内容物随着蜕壳的进行,在蜕壳前期较多,在蜕壳期消失,直到蜕壳后期逐渐出现,符合中华绒螯蟹在蜕壳过程中营养物质的变化趋势。中华绒螯蟹的鳃具有两层角质层,内角质层与上皮细胞紧密贴合形成上皮细胞层,外角质层在边缘管处与上皮细胞层形成空腔,这种空腔结构与中华绒螯蟹交换钙离子的过程有关[23]。在蜕壳期,外角质层与上皮细胞层明显分散,这是由于中华绒螯蟹蜕壳会将旧鳃一起蜕去,刚蜕完壳的蟹形成的新鳃尚未发育完全,上皮细胞层还未与外角质层完全贴合。
3.3 钙网蛋白基因表达量
在分子生物学层面,中华绒螯蟹的蜕壳是由多个基因协同参与形成[24]。其中,钙网蛋白功能广泛,对调节细胞内钙离子平衡有重要作用[25-27]。在1个蜕壳周期内,中华绒螯蟹处于蜕壳间期的时间最长,因此将蜕壳间期的钙网蛋白基因的表达量作为其他3个时期的参照。在肝胰腺和鳃中,与蜕壳前期相比,蜕壳期和蜕壳后期的钙网蛋白基因表达量相对较高,表明蜕壳期和蜕壳后期的钙网蛋白基因的表达过程较活跃,此变化趋势与Xu等[28]对拟穴青蟹(Scyllaparamamosain)的研究结果一致。
4 结 论
综上,在蜕壳周期内,中华绒螯蟹肝胰腺及鳃中的钙含量、组织结构及钙网蛋白基因表达量的变化较为明显。中华绒螯蟹在蜕壳前后的钙含量变化差异较大,肝胰腺中的钙含量在蜕壳后期显著升高,可能表明中华绒螯蟹在蜕壳后的钙离子交换过程较活跃。苏木精—伊红染色结果显示,在蜕壳期,中华绒螯蟹鳃的鳃叶末端边缘管处未形成正常空腔,结合鳃中的钙含量结果,推测此结构可能与钙离子交换过程有关。荧光定量PCR结果显示,钙网蛋白基因在不同蜕壳时期的表达量变化明显,表明钙网蛋白基因与钙离子交换过程有密切关系。本试验中,对蜕壳周期内中华绒螯蟹的钙含量、组织学和钙网蛋白基因表达的初步研究结果,可为中华绒螯蟹蜕壳和钙转运更深入的研究提供一定理论基础。

