长期施用有机肥潮土细菌的多样性及功能预测
练金山,王慧颖,徐明岗,魏文良,段英华*,刘树堂*
(1 中国农业科学院农业资源与农业区划研究所/耕地培育技术国家工程实验室,北京 100081;2 农业农村部耕地质量监测保护中心,北京 100125;3 山西农业大学资源与环境学院,山西太原 030801;4 青岛农业大学资源与环境学院,山东青岛 265200)
土壤中存在大量的微生物,一方面它能够转化和分解有机质,促进碳、氮、磷等养分的循环[1];另一方面微生物自身固存的营养元素在其死亡后又释放到土壤中,并且这部分营养可以被植物快速吸收利用,所以土壤微生物也是土壤肥力的贡献者。此外,微生物通过改善生物和非生物胁迫[1],在促进植物生长方面发挥着关键作用[2–3],因此土壤微生物的多样性被认为是土壤质量和土壤健康的标志[4–6]。细菌是微生物中含量最多、丰度最高的类群,在一定程度上能够衡量土壤质量和健康程度,反映土壤环境条件,其数量、多样性以及群落结构和功能的变化均会影响土壤肥力和农业的可持续性。长期施肥改变土壤微环境、土壤质量和养分循环,并形成与之相适应的细菌群落结构以及相应的功能[7]。因此探明不同施肥下细菌的多样性、群落结构和功能结构,能够揭示科学施肥与土壤生物肥力及作物生产力的作用机制。
施肥可提高土壤肥力,改变细菌的丰度、多样性和功能,从而影响作物产量[8–10]。但是,也有研究认为化肥的大量施用降低了土壤生物多样性对维持作物生产的重要性[11]。粪肥本身含有丰富的有机质,为土壤细菌多样性和活性的提高提供了大量资源[12–13]。袁铭章等[14]在潮土上的研究发现,长期施用有机肥会提高土壤细菌的数量和多样性,并且改变其群落组成。在水稻土的研究中,有机肥的施用对土壤理化性质和细菌群落的影响比无机肥更明显[15]。Sun等[11]的研究表明长期有机无机肥配施可使细菌多样性恢复到与施肥前相当的水平,并且提高作物产量,这表明细菌可能是有机无机肥配施提高作物生产力的关键驱动因素。总的来说,大多数研究发现有机肥的施用改变了微生物的群落结构,可形成更稳定和健康的土壤生态系统,有助于维持或提高作物产量。换而言之,作物产量受到土壤微生物群落、肥力水平等因素影响[16–18]。
近年来,我国施肥和微生物的研究大多集中在微生物对不同施肥响应的差异及其驱动因素,而关于长期施肥对土壤的生物化学性质、微生物多样性及其功能的研究相对较少。本研究基于潮土连续37年的长期定位施肥试验,采用定量PCR和Miseq高通量测序方法,探究细菌的数量、多样性、群落结构和功能对长期施用不同肥料的响应差异,并结合作物产量、土壤理化性质,探讨细菌多样性、群落结构和功能在提高作物产量中的作用,为调节潮土细菌群落从而提高作物产量提供理论依据。
1 材料和方法
1.1 供试材料
非石灰性潮土长期施肥试验点位于山东省莱阳市 (东经 120°43′,北纬 36°58′),始于 1978 年。本研究选择4个处理:不施肥处理(CK)、单施氮肥(N)、单施有机肥(M)和有机无机肥配施(MN)。氮肥为尿素,每年用量是N 127 kg/hm2,有机肥为鲜猪粪,每年施用量是60000 kg/hm2,MN处理是尿素与鲜猪粪配合施用,有机肥与化肥氮以等氮量施用。小区面积为33 m2,每个处理3次重复,共12个小区,完全随机区组排列,作物为小麦–玉米轮作,小麦品种为烟优361,玉米品种为鲁玉16号。于2015年10月玉米收获后采集0—20 cm耕层土壤,每个小区采集5个重复样品混合成一个土样,土壤过2 mm网筛去除杂质(根、石头等)分成3份,一份迅速储存在−80℃的超低温冰箱中用于DNA提取,一份存放在4℃冰箱中,剩余样品风干用于测定土壤理化性质。2015年作物产量和土壤理化性质见表1。
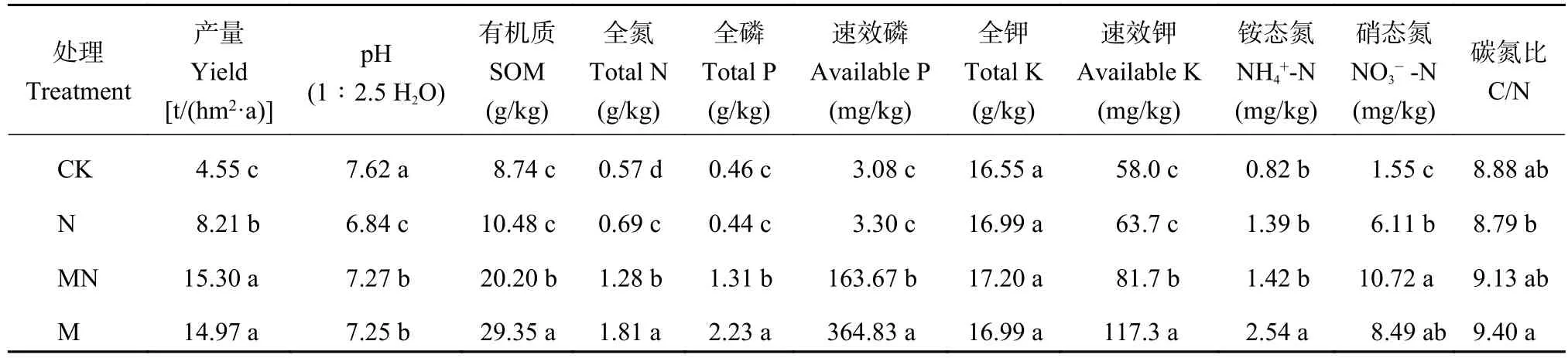
表1 2015年作物产量和土壤理化性质Table 1 Crop yield and soil properties in 2015
1.2 土壤理化性质的测定
土壤pH采用1∶2.5的土水比、复合电极测定;土壤有机质(SOM)含量采用重铬酸钾–硫酸外加热方法测定[19];全氮(TN)采用半微量凯氏定氮法测定;全磷(TP)和全钾(TK)采用硫酸–高氯酸消煮后分别用钼锑抗比色法和火焰光度计法测定;速效磷(AP)采用Olsen法[20]测定;速效钾(AK)采用NH4OAc浸提—火焰光度计法[21]测定;NH4+-N 和NO3−-N含量用KCl浸提—流动分析仪测定[22]。
1.3 DNA 提取和高通量测序
土壤样品DNA采用MoBioPowerSoil DNA提取试剂盒(MO BIO,Carlsbad,CA,USA)提取。引物使用314F(CCTACGGGNGGCWGCAG)和805R(GACTACHVGGGTATCTAATCC),对代表细菌16S核糖体RNA (rRNA)序列进行PCR扩增。其反应体系为 46 μL 的 2×预混料 (TaKaRa Bio,Mountain view,CA,USA)、各1.5 μL的正向、反向引物(10 μmol/L)和 1 μL 模板 DNA。16S rRNA 基因的PCR扩增程序为:95℃下预变性1 min,95℃变性20 s、57℃ 退火 25 s、68℃ 延伸 45 s,循环 30 次。每批样本的DNA提取和PCR均使用不含土壤基因组DNA阴性对照样本检测,检测合格后,所有样本的PCR产物以等摩尔浓度汇集在一起,并使用E.Z.N.A.®凝胶提取试剂盒(美国佐治亚州诺克罗斯市Omega Bio-tek)进行纯化。采用Illumina-MiSeq平台对收集的PCR产物进行测序。所有序列以登录号SRX1032809提交至NCBI数据库。
1.4 定量 PCR
细菌 16S rRNA 基因丰度采用 ABI Real-Time 7500 System (USA)进行qPCR的克隆扩增反应。反应体系为 Fast Fire qPCR PreMix (SYBR Green) 10 μL,ROX Reference Dye 0.4 μL,1 μL DNA 模板,10 μmol/L引物,补加ddH2O至20 μL。PCR扩增程序为:95℃ 下预变性5 min,95℃ 变性 5 s、55℃ 退火30 s、72℃ 延伸 40 s,变性—退火—延伸共循环40次。使用314F和805R进行qPCR扩增,利用Minipre Kit (Qiagen,Germantown,MD,USA) 得到所需的质粒DNA,并以此获得的拷贝数及R2>0.99为标准进行qPCR反应,且每个被测DNA样品设置3次重复。
1.5 数据处理
群落α多样性使用群落多样性指数(Shannon index)、群落丰富度指数(Chao1 index)和群落均匀度指数(Pielou index)来估算。Shannon指数越大,微生物多样性越高;Chao1指数越大说明土壤样品中微生物物种的丰富度越高;Pielou指数用于度量群落中相对物种丰富度。
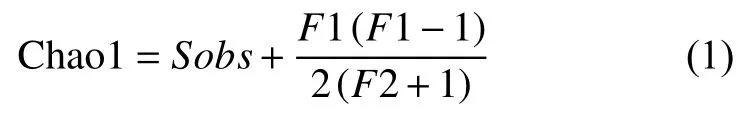
式(1)中:Sobs为观察到的OTU数;F1为只有一条序列的OTU数目(称为Single ton);F2为只有两条序列的 OTU 数目 (称为 Double ton)[23]。
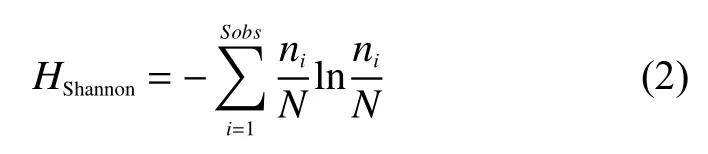
式 (2)中:ni表示含有i条序列的OTU数目;N表示所有的序列数[24-25]。
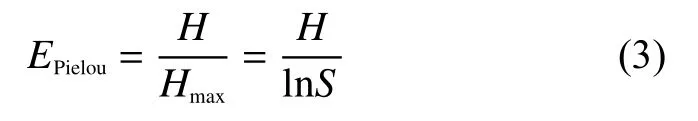
式(3)中:H为Shannon指数;Hmax表示在物种丰富度相同的情况下(即当群落中所有物种丰度完全一致时),能够达到的最大Shannon指数;Hmax= l nS(S为群落中的总物种数)。
多样性指数和土壤理化性状的差异采用SPSS的Windows 16.0版本中的邓肯法显著性检验来检验(SPSS Inc,Chicago,USA);细菌 β 多样性被定义为不同处理之间的Bray–Curtis相异性值。通过主坐标分析法(PCoA)对细菌β多样性可视化,用于表征细菌的群落结构异同程度。使用Mantel检验计算细菌群落结构和功能结构与土壤理化性质之间的相关关系[26]。使用FAPROTAX数据库预测土壤细菌功能。在R语言(3.2.3)中进行统计分析[27],并使用ORIGIN2018进行绘图。
2 结果与分析
2.1 长期施肥下土壤细菌的丰度
图1显示,CK和N处理下土壤细菌的拷贝数分别为2.96×108/g干土和2.98×108/g干土。MN处理的细菌丰度是CK和N处理平均值的11.8倍,M处理的细菌丰度是CK和N处理平均值的10.7倍,说明添加有机肥显著提高了细菌的丰度。
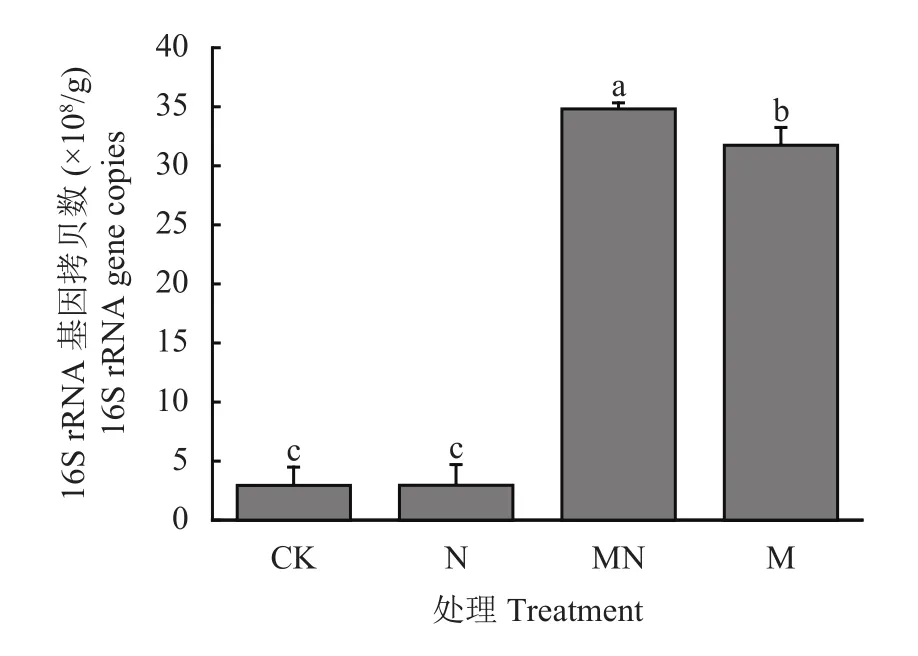
图1 长期不同施肥处理土壤细菌丰度Fig. 1 The abundance of soil bacteria under long-term different fertilization treatments
2.2 长期施肥下土壤细菌的α多样性
表2中Shannon指数表明,M处理中细菌多样性最高,而N处理最低。与N处理相比,M处理的Shannon 指数显著增加了 3.1% (P< 0.05),但是与MN、CK 处理无显著性差异 (P> 0.05)。Chao1 和Pielou指数在4个处理间无显著性差异(P> 0.05)。
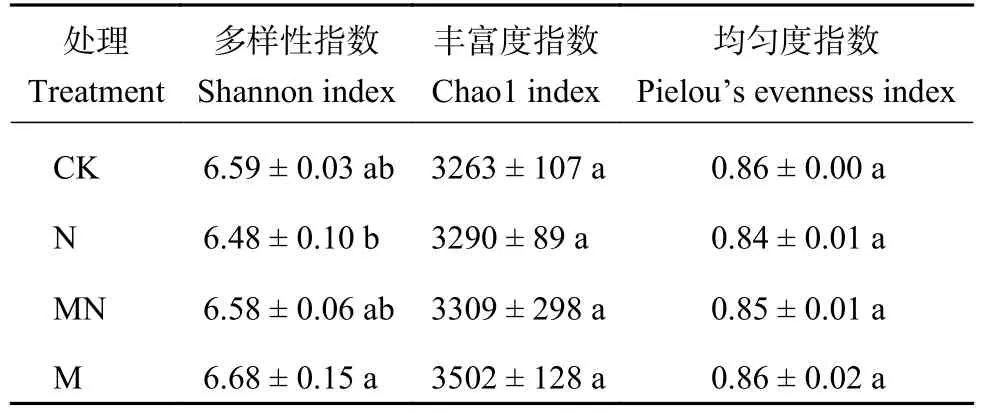
表2 长期不同施肥处理下细菌α多样性指数Table 2 Bacterial α diversity index under long-term different fertilization
2.3 长期施肥下土壤细菌的β多样性和群落组成
基于Bray-Curtis计算的β多样性表征两两样本之间细菌群落的差异,用主坐标分析(PCoA)来表示(图2a)。PCoA分析结果显示细菌群落中超过一半的变异可以用前两个主坐标来解释,其中PCo1可解释51.4%的总变异,PCo2可解释18.9%,共解释细菌群落变异的70.3%。不施肥、单施化肥与施用有机肥(M和MN)处理细菌群落结构沿PCo1和PCo2分离,说明长期施肥显著改变了潮土细菌群落结构。MN和M处理的细菌群落聚集在一起,表明这两个处理的细菌群落结构没有显著差异。
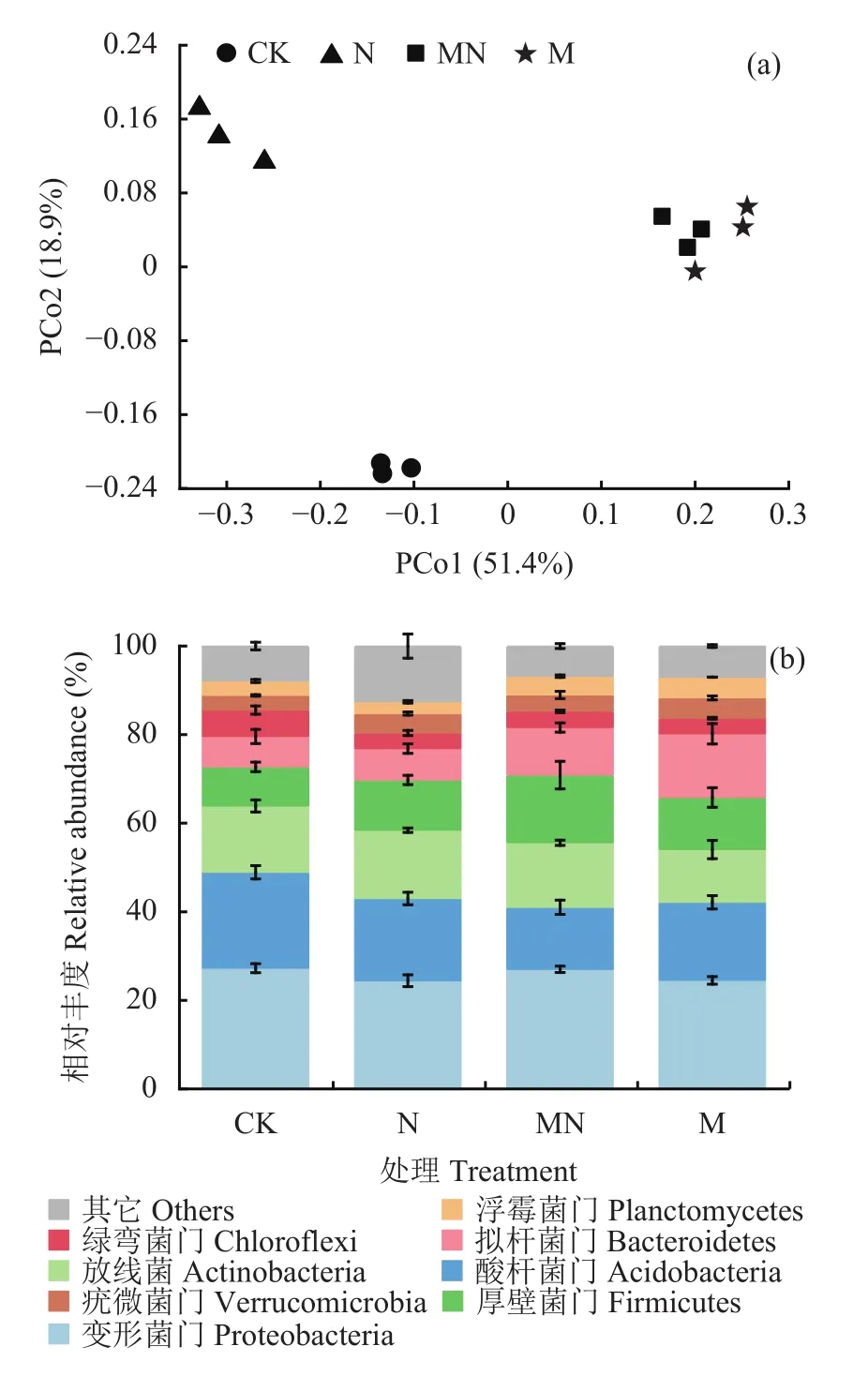
图2 长期不同施肥处理下土壤细菌门水平群落结构和相对组成Fig. 2 Bacterial community structure and relative composition at the phylum level under long-term different fertilization treatments
各处理的土壤细菌在门水平上的相对丰度如图2b所示,总的来说,潮土中变形菌门、酸杆菌门和放线菌门的总数占细菌总数的55%~64%,其次为厚壁菌门(9%~15%)、拟杆菌门(7%~14%)、绿弯菌门(4%~6%)、疣微菌门和浮霉菌门(3%~5%)。与CK相比,施用有机肥处理(MN和M)显著提高了厚壁菌门、拟杆菌门、疣微菌门和浮霉菌门的相对丰度,降低了酸杆菌门、绿弯菌门的相对丰度(P< 0.05);单施化肥处理(N)显著提高了拟杆菌门、疣微菌门和厚壁菌门的相对丰度,降低了变形菌门、酸杆菌门和绿弯菌门的相对丰度(P< 0.05)。与N处理相比,MN处理下变形菌门、厚壁菌门、拟杆菌门丰度显著提高,酸杆菌门丰度显著降低(P< 0.05)。
2.4 长期施肥对土壤细菌功能的影响
采用FAPROTAX对土壤细菌群落功能注释后共获得52个功能种群分组(图3)。其中,10个相对丰度较高的功能类型及其相对丰度总和占总丰度的30%以上;“其他功能种群”为有功能但丰度较低的种群相对丰度之和,占总丰度的54%~63%;另外有6%~10%的功能尚不明确。10个丰度较高的功能种群中,化能异养(chemoheterotrophy)和有氧化能异养(aerobic chemoheterotrophy)种群的丰度最高,均为10%以上;其次为发酵作用(fermentation)、硝化作用(nitrification)、硝酸盐还原(nitrate reduction)和亚硝酸盐氧化 (aerobic nitrite oxidation)种群,其丰度均为1%以上;最低为叶绿体固氮、固氮作用、光养作用和光异养作用种群。

图3 基于FAPROTAX预测的长期不同施肥处理下土壤细菌生态功能多样性Fig. 3 Ecological functional diversity of soil bacterial community under long-term different fertilization treatments based on FAPROTAX tool
与其他3个处理相比,MN处理下化能异养功能(chemoheterotrophy)细菌的丰度显著提高了2.2%~4.2% (P< 0.05)。MN和M处理中起发酵作用(fermentation)的种群相对丰度是其他处理的3倍以上。硝化作用(nitrification)、硝酸盐还原(nitrate reduction)、亚硝酸盐氧化 (aerobic nitrite oxidation)功能在4个处理中无显著差异(P> 0.05)。叶绿体固氮功能(chloroplasts)种群丰度在N处理中最高,且显著高于M和MN处理(P< 0.05)。固氮作用(nitrogen fixation)种群丰度在CK、N和MN处理中显著高于M 处理 (P< 0.05)。光养作用 (phototrophy)和光异养作用(photoheterotrophy)功能种群的相对丰度均在施肥处理中显著高于不施肥处理(P< 0.05)。
2.5 土壤细菌群落β多样性和功能与理化性质及作物产量的关系
Mantel分析结果(图4)表明,土壤细菌群落的β 多样性与作物产量 (r= 0.75)、土壤 pH (r= 0.48)、土壤有机质 (r= 0.64)、全氮 (r= 0.66)、全磷 (r=0.61)、速效磷 (r= 0.57)、速效钾 (r= 0.47)、NO3−-N含量 (r= 0.39)均呈极显著正相关关系 (P< 0.01)(图4)。细菌α多样性(Shannon指数)与土壤pH、土壤有机质、全氮、全钾、速效钾、NH4+-N、C/N显著正相关 (r为 0.60~0.98),与全磷 (r=−0.63)、有效磷 (r= −0.88)呈显著负相关关系 (P< 0.05)。
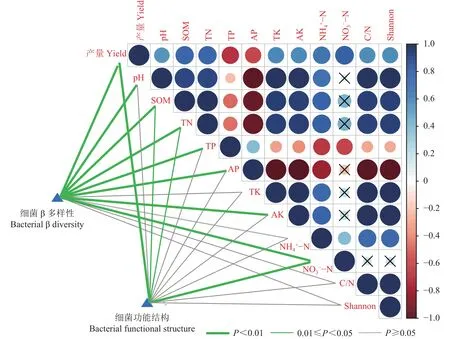
图4 土壤细菌多样性、功能结构、作物产量以及土壤性质的关系Fig. 4 Relationship among soil bacterial diversity,functional structure,crop yield and soil properties
细菌功能与作物产量(r= 0.48)和NO3−-N含量(r= 0.53)呈极显著正相关 (P< 0.01)关系,与土壤有机质 (r= 0.27)和全氮 (r= 0.29)呈显著正相关关系(P< 0.05),说明土壤有机质、全氮和NO3−-N 对土壤细菌群落及功能起主要调控作用。细菌β多样性及功能与产量的显著相关关系说明,细菌的种群结构和功能差异越大,作物产量间的差异也会越大。此外,从图4中可见,作物产量和细菌α多样性(Shannon指数)、pH、土壤有机质、全氮、全钾、速效钾、NH4+-N、NO3−-N、C/N均呈显著正相关关系(r= 0.40~0.71,P< 0.05)。
3 讨论
3.1 长期不同施肥对细菌丰度、多样性和功能的影响
我们的研究发现,长期使用有机肥的处理(M和MN处理)潮土中细菌丰度是CK和N处理平均值的10~12倍(图1)。这是因为畜禽粪便类有机肥本身含有大量的微生物且能为微生物生长提供充足的养分和能源,从而显著提高了土壤中细菌的丰度[28–29]。与不施肥(CK)相比,长期施用化肥(N)处理降低了细菌的α多样性(Shannon指数),化肥有机肥配施(MN)处理对其α多样性的影响较小,而长期单施有机肥(M)处理提高了其α多样性。很多研究发现,不同施肥导致土壤酸碱度的改变是α多样性变化的重要原因,化肥的添加会导致土壤酸化,不利于细菌多样性的维持,而有机肥能够阻控酸化从而保持或提高细菌的多样性[11,28,30]。本试验中,长期单施化肥的土壤pH也显著低于其他施肥处理。但是,由于本研究中潮土本身为偏碱性土壤,所以酸化程度并不严重,这也是其α多样性差异不大的原因之一。
长期不同施肥后,潮土细菌的β多样性发生了显著的改变,M和MN两个处理的细菌群落结构在长期施肥的过程中趋于相似,与CK和N处理产生明显的差异(图2a),说明外源养分添加后土壤原有的生态平衡被打破,土壤微生物丰度及群落结构也会随之改变[31]。在我们的研究结果中,细菌β多样性主要与土壤pH、土壤有机质、全氮、全钾、速效钾、NH4+-N、NO3−-N、C/N有关(图4),这些土壤因子的改变可能是细菌多样性改变的原因。除养分外,我们的研究结果还表明无论是细菌α多样性还是细菌β多样性都与pH极显著相关(P< 0.01)。可见,pH对于土壤细菌的群落结构具有重要影响,在施肥等田间管理措施实施中应得到充分重视。
本研究中4个不同施肥处理的细菌优势门相似,均为变形杆菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、放线菌门(Actinobacteria)、厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes),这与以前的一些研究得到的细菌优势类群相似[32–33]。但不同处理中优势类群的相对丰度存在一定差异,在CK处理中,酸杆菌门和绿弯菌门的相对丰度高于其他处理,这是因为酸杆菌和绿弯菌易富集在低肥力土壤中[34]。厚壁菌门、拟杆菌门、疣微菌门、浮霉菌门在MN和M处理中相对丰度较高,可能是由于肥料可以为作物提供其生长所必需的营养元素,促进作物根部器官的生长和物质分泌,进而提高了参与多种生态过程从而间接促进植物生长的浮霉菌门的相对丰度[35];而厚壁菌门和拟杆菌门是猪粪中丰富的细菌类群,因此随着猪粪的施用两者在土壤中的相对丰度随之增加[10]。
潮土细菌生态功能以化能异养、有氧化能异养、发酵作用、硝化作用、硝酸盐还原为主(图3)。化能异养和有氧化能异养这两种功能被认为是广泛的生态系统功能,并由大多数微生物执行[36],如酸杆菌(Acidobacteria)、变形菌门(Proteobacteria)和疣微菌门(Verrucomicrobia)[37]。发酵作用是葡萄糖代谢的一种厌氧途径[38]。化能异养、有氧化能异养、发酵作用、光养作用和光异养作用是与碳循环相关的重要生态功能[39]。与CK处理相比,长期施肥处理提高了光养作用和光异养作用种群丰度,M和MN处理还显著提高了发酵作用种群丰度,此外,MN处理显著提高化能异养功能种群丰度,表明在MN处理中有更高比例的细菌参与土壤碳循环。有机肥中含有大量的有机碳以及微生物活性物质,不仅提供大量的可矿化碳,而且有利于促进土壤原有有机碳的矿化[40]。MN和M处理中碳循环功能细菌种群丰度的提高,有利于有机质释放出更多作物可利用的无机养分,这可能是MN和M处理下作物产量提高的原因之一。
3.2 细菌多样性和功能与作物产量的关系
细菌α多样性(shannon指数)与作物产量显著相关(P< 0.05),细菌β多样性与作物产量极显著正相关 (P< 0.01) (图4),而有机肥的长期施用 (M 和MN处理)较不施肥处理和只施化肥处理(CK和N处理)作物产量显著提高(表1),这说明有机肥施用形成的微生物群落结构更有利于作物产量的提高。前文我们提到,长期施用有机肥提高厚壁菌门、拟杆菌门、疣微菌门、浮霉菌门的相对丰度,这些细菌丰度的提高是细菌β多样性与作物产量显著相关的原因之一。厚壁菌门中一些固氮菌属利用有机肥提供的碳源和能源满足自身生长,通过释放有机物中的氮和固定空气中的氮形成氨,并进一步转化为植物可利用的氮源,为作物生长提供氮素[41]。浮霉菌门包含大量的厌氧氨氧化菌属,有利于氮循环的氨氧化过程的发生[42]。此外,浮霉菌门经常与植物根际联系在一起[43],而根际是养分交换和元素循环的枢纽,并生活着数以百万计的微生物,在调节营养循环或抑制病原体方面发挥重要作用[44–46]。因此,这些微生物通过参与生化过程进而影响土壤中铵态氮和硝态氮含量,最终对产量产生影响。拟杆菌具有溶磷作用,一些菌属分泌有机酸和磷酸酶将难溶性磷转化为可以被植物吸收利用的H2PO4−和HPO42−两种磷的形态[47],提高植物对磷的吸收和利用,促进植物生长[48]。
细菌功能结构也和作物产量极显著相关(P< 0.01)(图4),这是因为长期施肥改变了土壤有机质、全氮和NO3−-N含量和细菌种类,进而影响了作物生长。这与Fanin等[49]的发现一致,即土壤有机碳和氮的变化可能影响微生物群落及其功能。本研究对潮土上长期施肥下细菌功能种群的相对丰度分析发现,长期施用有机肥(M和MN处理)较CK和N处理显著提高了与碳循环相关的发酵作用,尤其是MN处理还显著提高了化能异养功能,这两个功能有利于MN处理下土壤中有机质(SOM)的转化。SOM的分解和转化可以增加养分的供应[50],并且有利于改善土壤物理、化学、生物化学特性,从而为作物提供养分并创造有利的生活环境[51]。这可能是有机无机肥配施下作物产量较其它处理显著提升的原因之一。然而本研究中长期施肥未改变氮循环相关的功能。这可能是因为物种之间存在功能互补,即土壤微生物可以根据其功能分为不同的功能群,微生物的不同功能群维持着土壤的功能,任何一组物种的减少对土壤生态系统功能的整体过程几乎没有影响,因为其他细菌可以承担其功能[52]。更加细致和准确的细菌功能预测需要通过宏基因组和蛋白质组学等方法进行深入地研究。
4 结论
长期施肥能够改变潮土中细菌的丰度及多样性,尤其是有机肥的长期施用,有利于提高潮土中细菌的丰度,维持细菌的α多样性;有机肥单施及其与化肥配合施用均可提高厚壁菌门、拟杆菌门、疣微菌门、浮霉菌门的相对丰度,两种长期施肥处理土壤的细菌群落结构趋于相似。
潮土中细菌β多样性与作物产量变化及大部分土壤养分变化呈显著的正相关关系,说明处理间细菌群落组成差异越大,相应的作物产量变化及大部分土壤养分变化也越大。有机肥的长期施用能够促进形成更稳定且有利于提高作物产量的细菌群落结构。细菌功能结构与作物产量变化和土壤NO3−-N变化极显著正相关(P< 0.01),与土壤有机质变化和全氮变化显著正相关(P< 0.05)。土壤有机质、全氮和NO3−-N对土壤细菌功能起主要调控作用。

