高磷处理下矿山生态型水蓼根系耐受特征
刘嫣含,李廷轩,蒲 勇,高东东,叶代桦*
(1 四川农业大学资源学院,四川成都 611130;2 泸州市农业农村局,四川泸州 646000;3 四川省生态环境科学研究院,四川成都 610042)
农业生产中化学磷肥和有机肥的不合理施用,易导致磷素在农田土壤中大量积累,加剧水体富营养化等环境风险[1–2]。磷引起的非点源污染对我国水体总污染的贡献高达93%[3]。利用磷富集植物提取介质中过量的磷是一种有效的治理方法,目前筛选出的植物如水莴苣[4]、美人蕉[5]和马唐[6]等均表现出较好的磷素提取效果。良好的磷富集植物应具有较强的磷积累能力,但生长介质中磷浓度过高会导致植物生物量大幅下降,限制其实际提取效果[7]。因此,对高磷具有较强耐性是磷富集植物应用于植物修复的重要前提。
根系是植物吸收水分和养分的主要器官,直接感知逆境胁迫,是植物最敏感的部位[8]。逆境胁迫会打破植物根系细胞活性氧动态平衡,导致根内过氧化氢(H2O2)和丙二醛(MDA)过量积累,引发或加剧根系膜脂过氧化作用[9]。为保护植物根系膜脂完整性,根系抗氧化酶系统会将某些有毒物质氧化为无毒物质,从而保护根系健康生长[10]。其中超氧化物歧化酶(SOD)可把超氧阴离子自由基分解成O2和H2O2,而过氧化氢酶(CAT)则能进一步把H2O2降解成H2O和O2,过氧化物酶(POD)也具有清除H2O2的功能[11]。除抗氧化酶系统外,植物根系元素亚细胞分布也是影响其耐性的重要指标。将更多元素积累分布于细胞壁和液泡可有效降低元素过量对细胞器的毒害,缓解根系受到的胁迫[12–13]。因此,弄清胁迫环境下植物根系抗氧化酶系统和元素亚细胞分布的变化,有助于揭示植物根系耐性特征。
前期研究发现,水陆两生植物水蓼(Polygonum hydropiper)具有良好的磷富集能力,且矿山生态型水蓼磷富集能力更强,其对高浓度畜禽废水中的全磷去除率高达69.10 %[14]。高磷处理下矿山生态型水蓼生物量和磷积累量均显著高于非矿山生态型,根系形态、根系酸性磷酸酶和植酸酶活性等指标与植株磷积累能力紧密相关[15]。由此可见,高磷环境下良好的根系发育是矿山生态型水蓼磷富集的保障,但其根系对高磷的耐受能力仍不清楚。基于此,本研究以矿山生态型水蓼为试验材料,非矿山生态型水蓼为对照,研究矿山生态型水蓼根系对高磷的耐受特征,为后期合理利用矿山生态型水蓼提取环境中过量的磷提供一定的理论依据。
1 材料与方法
1.1 供试材料
供试植物:水蓼(Polygonum hydropiper),矿山生态型种子采自四川省什邡磷矿区(104°01′ E,31°25′ N),非矿山生态型种子采自四川省都江堰市灌口镇 (103°37′ E,31°02′ N)。
供试肥料:磷酸二氢钾(KH2PO4),为分析纯。
1.2 试验设计与处理
试验设 2、4、8、16 mmol/L 4 个高磷浓度处理,以0.5 mmol/L作为正常磷对照,每处理重复4次,共40盆,完全随机排列。采用水培试验,磷源为KH2PO4,营养液为去磷的霍格兰营养液和阿农微量元素混合液。选取均一的种子,经10%的H2O2消毒30 min后,洗净,于40℃培养箱中浸种8 h后,盛于装有珍珠岩和蛭石的塑料盘萌发。待种子萌发后,从培养箱中取出进行常规管理。于三叶期时浇灌1/2营养液至株高约8 cm,选择长势一致的幼苗移至黑色塑料盆(3 L)中,先用1/2霍格兰营养液预培养2周。随后移入相应磷处理的完全营养液(K用K2SO4进行平衡)的黑色塑料盆(容积3 L),每盆3株。每3~4天更换一次营养液,并使用0.1 mol/L的H2SO4或NaOH调节营养液pH至5~6,采用自然光照。试验于2020年3月至6月在四川农业大学科研园区有防雨设施的网室中进行。
1.3 样品采集与制备
于处理后第3周采集植株根系样品,植株根系先用自来水冲洗再用蒸馏水润洗。将每株根系样品均匀分为3部分,一部分于75℃烘干至恒重,称重,粉碎后过1 mm筛用于测定根系生物量和磷含量;另一部分经液氮速冻后保存于–75℃超低温冰箱中,用于根系H2O2含量、MDA含量、抗氧化酶活性和亚细胞各组分磷含量的测定;最后一部分立即浸泡在福尔马林–冰醋酸–酒精固定液(FAA)中,用于植物根系膜透性的研究。
1.4 测定项目及方法
根系磷含量采用HNO3微波消解—钒钼黄比色法测定[16];根系质膜完整性检验采用Evans blue方法染色,后在光学显微镜下观察拍照[17];根系MDA含量参照Dhindsa等的方法测定[18];根系H2O2含量采用南京建成生产的过氧化物试剂盒测定;根系抗氧化酶含量采用索莱宝生产的SOD、POD和CAT活性检测试剂盒测定;根系亚细胞组分磷含量采用钼锑抗比色法测定[16]。
根系亚细胞组分分离采用差速离心法,准确称取鲜样 0.100 g,加入 10 mL 提取液 [0.25 mol/L 蔗糖+50 mmol/L Tris-HCl缓冲液 (pH 7.5)+1 mmol/L 二硫赤鲜糖醇],液氮研磨成匀浆。匀浆液在冷冻离心机(4℃) 300 r/min 下离心 1 min,沉淀为细胞壁组分;上清液在10000 r/min下离心20 min,沉淀为细胞器组分;最终上清液为包含细胞质和液泡的可溶部分[19]。
1.5 数据处理
采用SPSS 22.0进行统计分析,选择LSD法进行多重比较,用 Excel 2019、Image-Pro Plus 6.0和Origin 9.0进行图表制作。
2 结果与分析
2.1 高磷对水蓼生物量的影响
由图1可知,随着磷浓度的增加,矿山生态型水蓼地上部和根系生物量均先增加后降低,在磷浓度4 mmol/L时达到最大值,分别为对照的1.60和1.27倍;非矿山生态型水蓼则逐渐下降。高磷处理下,矿山生态型水蓼地上部和根系生物量均显著大于非矿山生态型,分别为其1.35~2.56和1.18~1.86倍。表明矿山生态型水蓼对高磷的耐受能力更强。
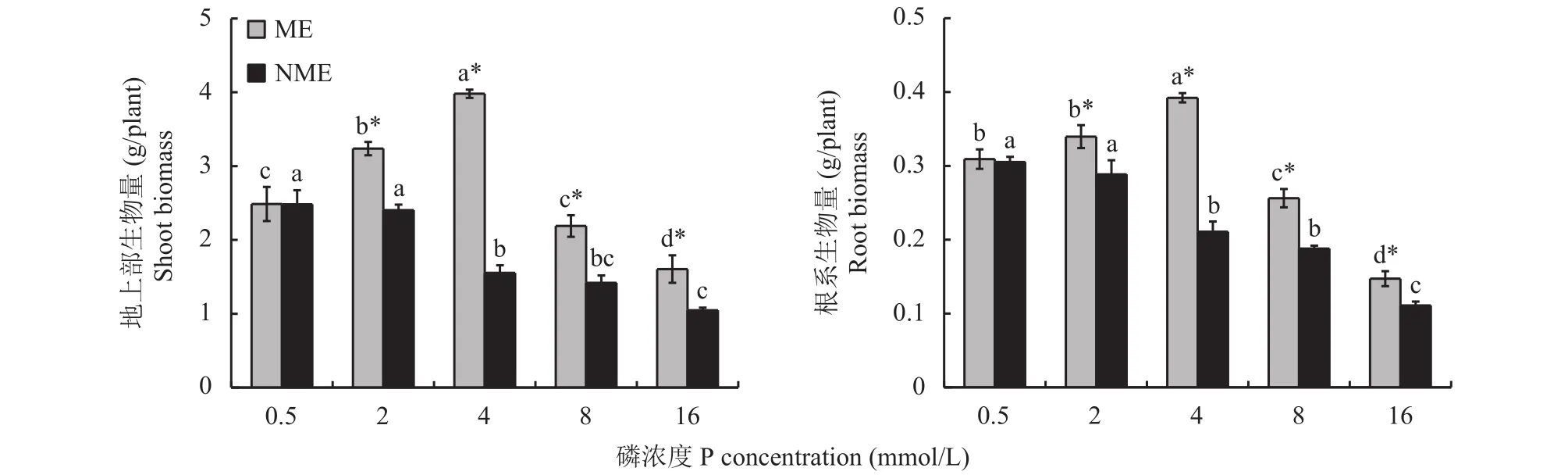
图1 高磷处理下两种生态型水蓼地上部和根系生物量的变化Fig. 1 Changes in shoot and root biomass of two P. hydropiper ecotypes under high P supply
2.2 高磷对水蓼磷积累的影响
2.2.1 磷含量 由图2可知,随着磷浓度的增加,两种生态型水蓼地上部和根系磷含量均先增加后保持稳定。高磷处理下,两种生态型水蓼根系磷含量均显著高于对照,其地上部磷含量在除2 mmol/L磷浓度处理外也均较对照显著增加。高磷处理下,水蓼地上部和根系磷含量在生态型间差异不显著。

图2 高磷处理下两种生态型水蓼地上部和根系磷含量的变化Fig. 2 Changes in shoot P and root P content of two P. hydropiper ecotypes under high P supply
2.2.2 磷积累量 由图3可知,随着磷浓度的增加,矿山生态型水蓼地上部磷积累量先增加后降低,在磷浓度4 mmol/L时达到最大值;非矿山生态型水蓼地上部磷积累量无明显变化。随着磷浓度的增加,两种生态型水蓼根系磷积累量均先增加后降低,分别在磷浓度4和2 mmol/L时达到最大值。与对照相比,除16 mmol/L磷浓度处理外,高磷显著提高了矿山生态型水蓼根系磷积累量,非矿山生态型根系磷积累量仅在2 mmol/L磷浓度处理时较对照显著增加。除16 mmol/L磷浓度处理地上部磷积累量外,矿山生态型水蓼地上部和根系磷积累量在高磷处理下均显著高于非矿山生态型,分别为其1.35~2.58和1.36~1.96倍。可见,矿山生态型水蓼对磷的积累能力更强。

图3 高磷处理下两种生态型水蓼地上部和根系磷积累量的变化Fig. 3 Changes in shoot P and root P accumulation of two P. hydropiper ecotypes under high P supply
2.3 高磷处理下水蓼根系氧化损伤程度分析
2.3.1 根系质膜完整性 伊文斯蓝染色主要用于评价细胞膜系统的完整性或通透性,根系被蓝色着色越明显,代表其质膜受损越严重。由图4可以发现,随着磷浓度的增加,两种生态型水蓼根系染色均逐渐加深。磷浓度达到8 mmol/L时,矿山生态型水蓼根系染色明显,根系质膜受到明显损伤;磷浓度大于2 mmol/L时,非矿山生态型水蓼根系质膜均受到明显损伤。可见,矿山生态型水蓼根系耐受磷浓度更高。

图4 高磷处理下两种生态型水蓼根系膜透性的变化Fig. 4 Changes in apical membrane permeability of the roots of two P. hydropiper ecotypes under high P supply
2.3.2 根系过氧化氢及丙二醛含量 由图5可知,随着磷浓度的增加,矿山生态型水蓼根系H2O2含量先保持稳定后显著增加,而非矿山生态型H2O2含量则逐渐增加。高磷处理下矿山生态型水蓼根系H2O2含量显著低于非矿山生态型,为其45.16%~68.67%。随着磷浓度的增加,两种生态型水蓼根系MDA含量均先保持稳定后显著增加,在16 mmol/L磷浓度处理时达到最大值。在磷浓度8和16 mmol/L时,矿山生态型水蓼根系MDA含量显著低于非矿山生态型,为其78.13%~78.37%。结果表明,矿山生态型水蓼根系H2O2及MDA含量更低。

图5 高磷处理下两种生态型水蓼根系过氧化氢和丙二醛含量的变化Fig. 5 Changes in H2O2 and MDA content in the roots of two P. hydropiper ecotypes under high P supply
2.4 高磷对水蓼根系抗氧化酶活性的影响
随着磷浓度的增加,两种生态型水蓼根系SOD、POD和CAT活性均呈现先显著增高后降低的趋势(图6)。在16 mmol/L磷浓度处理时,矿山生态型水蓼根系仅CAT活性显著低于对照,而非矿山生态型根系SOD和CAT活性均显著低于对照。在磷浓度4和8 mmol/L时,矿山生态型水蓼根系SOD活性显著高于非矿山生态型,分别为其1.31和1.40倍。除磷浓度16 mmol/L外,高磷处理下矿山生态型水蓼根系POD和CAT活性均显著高于非矿山生态型。以上结果表明,矿山生态型水蓼根系抗氧化酶活性更高,可有效减缓细胞脂质过氧化,维持其细胞膜稳定性。
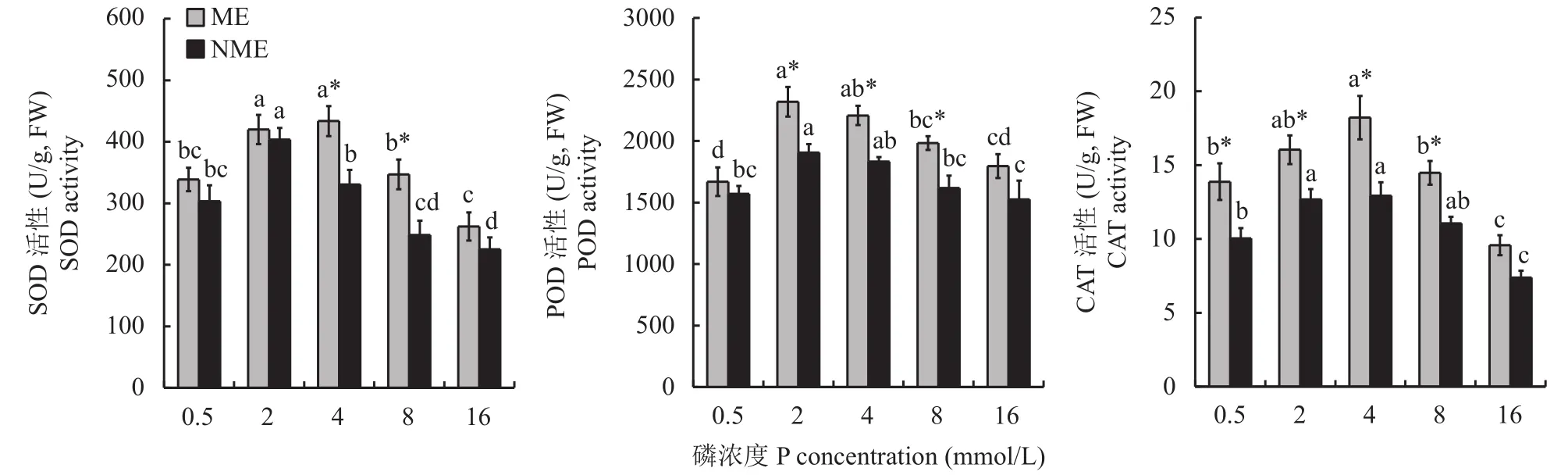
图6 高磷处理下两种生态型水蓼根系SOD、POD和CAT活性的变化Fig. 6 Changes in SOD,POD,and CAT activities of the roots of two P. hydropiper ecotypes under high P supply
2.5 高磷对水蓼根系亚细胞组分磷分布特征的影响
2.5.1 根系各亚细胞组分磷含量 由图7可知,随着磷浓度的增加,两种生态型水蓼根系细胞壁、可溶部分和细胞器磷含量显著增加,均在磷浓度16 mmol/L时达到最大值。在各高磷浓度下,矿山生态型水蓼根系可溶部分磷含量均显著高于非矿山生态型,为其1.03~1.12倍;其细胞壁和细胞器磷含量分别在磷浓度2、8和8、16 mmol/L时显著高于非矿山生态型。

图7 高磷处理下两种生态型水蓼根系细胞壁、可溶部分和细胞器磷含量的变化Fig. 7 Changes in the cell wall,soluble and organelle fractions of P content in subcellular components of the roots of two P. hydropiper ecotypes under high P supply
2.5.2 根系亚细胞组分磷分配比例 两种生态型水蓼根系亚细胞组分磷含量均表现为可溶部分>细胞壁>细胞器(图8)。其中矿山生态型水蓼根系40.79%~43.69 %的磷分配于细胞壁,43.72%~47.15 %的磷分配于可溶部分,仅少量磷分配于细胞器,非矿山生态型水蓼具有相似性。随着磷浓度的增加,两种生态型水蓼根系可溶部分磷分配比例较对照有明显增加,在磷浓度2和4 mmol/L时变化趋势较大。以上表明,高磷处理下两种生态型水蓼根系磷优先分配于细胞壁和可溶部分,从而缓解根系受到的磷胁迫。

图8 高磷处理下两种生态型水蓼根系亚细胞组分磷分配比例的变化Fig. 8 Changes in the subcellular component allocation ratio of the roots of two P. hydropiper ecotypes under high P supply
3 讨论
植物面临高磷胁迫时根系感知最为敏感,根系生物量的变化可以反映其耐受能力。张育文等[20]研究发现,随供磷浓度的增加辣椒根系生物量先增加后下降,过高磷浓度会抑制其根系生长。本研究中,两种生态型水蓼根系生物量在磷浓度8和16 mmol/L时均显著下降,过高磷浓度对水蓼根系产生了毒害。不同植物对高磷的适应能力不同,高磷处理下Hakea prostrata出现毒害症状,而Ptilotus则表现出较好耐受性[12,21]。同时植物不同基因型或生态型间对高磷的响应也不同,高磷处理下两种基因型大麦地上部鲜重相近,但突变体大麦根系鲜重比野生型高44 %[22]。本研究中,在磷浓度4 mmol/L时,矿山生态型水蓼根系生长良好,而非矿山生态型受到抑制,且高磷处理下矿山生态型水蓼根系生物量显著大于非矿山生态型,说明矿山生态型水蓼根系对高磷具有更强的耐受能力。高磷同样会对植物叶片造成毒害,磷富集植物应该对高磷具有良好耐性[12,23]。本研究中,高磷下矿山生态型水蓼地上部生物量显著高于非矿山生态型水蓼,其地上部对高磷也具有较好耐性。除保持较大生物量外,理想的磷富集植物也应具有较强磷富集能力[24-25]。本研究中,矿山生态型水蓼根系和地上部磷积累量均在磷浓度4 mmol/L时达到峰值,显著高于非矿山生态型水蓼,且高于Duo grass[26]、水麻[27]和矿山生态型粗齿冷水花[28]等磷富集植物,表现出较大的磷提取潜力。
根系氧化损伤程度和抗氧化酶系统与植物耐性密切相关[29]。逆境胁迫下植物会产生大量H2O2和MDA等物质,对根系质膜和细胞中的许多生物功能分子造成破坏,影响植物正常生长[9,30–31]。低磷胁迫下,番茄根系膜脂损伤程度增加,根系总根长显著降低,生长受到明显抑制[32]。本研究中,磷浓度在2和4 mmol/L时,矿山生态型水蓼根系H2O2和MDA含量相比对照无显著变化,质膜未出现明显损伤,表现出一定的高磷适应能力。而磷浓度过高同样会导致矿山生态型水蓼根系H2O2和MDA大量累积,造成其质膜严重损伤。逆境下植物根系氧化损伤程度与其抗氧化酶系统密切相关,目前研究中植物抗氧化酶系统主要包括SOD、POD和CAT等[33–34]。研究发现,低磷胁迫会启动杉木幼苗抗氧化酶系统,其体内SOD活性的增高可以清除大量的自由基离子[35]。而在对Elodea nuttallii的研究中却发现相反结果,随着磷浓度的升高,Elodea nuttallii体内SOD和CAT活性降低,MDA含量增加,细胞膜脂过氧化加剧[36]。本研究中,磷浓度在2和4 mmol/L时矿山生态型水蓼根系抗氧化酶活性显著高于对照,而磷浓度在高于8 mmol/L后则与对照差异减小,甚至CAT活性在磷浓度16 mmol/L时较对照显著降低。表明高磷诱导矿山生态型水蓼根系抗氧化酶活性增高,以清除体内多余H2O2和MDA。而磷浓度过高时,其根系H2O2和MDA积累超出自身清理能力,根系生长仍会受到高磷毒害。植物不同基因型或生态型间根系抗氧化酶系统差异较大。低磷胁迫下,耐低磷苦荞品种根系SOD和POD活性增幅大于其他品种,根系生长情况更好[37]。本研究中,与非矿山生态型相比,高磷处理下矿山生态型水蓼根系抗氧化酶活性更高,是其对高磷具有更强耐受能力的重要原因之一。
植物亚细胞组分元素分布与其耐性紧密相关,有效控制细胞质的元素含量,可以维持植物细胞结构的完整性[38–39]。细胞壁是保护原生质体免受毒害的第一道屏障,具有丰富的交换性阳离子,能吸附大量的元素[40]。多数修复植物优先将元素固定于其细胞壁表面,从而避免细胞内部受到毒害[41–42]。在本研究中,两种生态型水蓼细胞壁磷分配比例均较高,这一功能可有效控制细胞可溶性组分和细胞器组分在耐受范围内积累磷素,以减少高磷毒害。当细胞壁吸附能力饱和后,过多的元素会优先储存于可溶部分中,以降低元素对细胞器的毒害[43]。细胞可溶部分由液泡和细胞质两部分组成,磷浓度过高时植物液泡磷含量变幅要大于细胞质,液泡是其磷素储存的重要场所[21]。植物可溶部分的液泡区隔化可有效避免磷毒害,是植物的重要耐性机制之一,这在磷富集植物澳洲狐尾草[12]和本研究水蓼中均有所发现。植物液泡区隔化可能与其液泡膜磷转运蛋白有关,研究发现当外界磷素缺乏时,液泡储存的无机磷会被释放到胞质中供植物利用,当外界磷素充足时,植物吸收的大部分无机磷会被储存在液泡中,液泡膜应具有磷体内周转及再利用的调控机制[44]。目前已在拟南芥液泡膜上发现无机磷转运蛋白(VPTs,也被称为PHT5),其可将无机磷隔离到液泡腔,而高磷处理下水蓼的液泡无机磷转运机制至今仍不清楚,有待在后期研究中进一步探索[45]。综上所述,细胞壁固持和可溶部分的液泡区隔化可能是水蓼具有高磷耐性的重要原因。
4 结论
矿山生态型水蓼对高磷的耐受能力和磷积累能力均强于非矿山生态型水蓼。高磷处理下矿山生态型水蓼有两个特点:1)自由基和保护酶保持动态平衡的磷胁迫生理应答机制,通过提高根系抗氧化酶活性,使其根系H2O2和MDA含量保持在较低水平,从而维持质膜完整性;2)细胞壁固持和可溶部分的液泡区隔化的相互协调,将磷素优先分配于非代谢活性组织,减轻或避免高磷对细胞器的损伤,提高根系对高磷的耐受能力。

