电针干预慢性炎性痛的杏仁核潜在蛋白筛选
陈月蓉,徐赟赟,倪雯沁,丁棋柯,戴玮,许颖龄,朱希潇,方剑乔*,吴媛媛*
(1.浙江中医药大学第三临床医学院康复医学院,杭州 310053;2.浙江省针灸神经病学研究重点实验室,杭州 310053;3.浙江中医药大学第二临床医学院,杭州 310053)
疼痛是一种多维的有意识体验,包括感官成分(对疼痛的严重程度和位置的感知)和消极的情感-动机成分[1]。慢性疼痛是一个常见且复杂的问题,对个人和社会都有深远的影响[2]。全球疾病负担研究中,疼痛和疼痛相关疾病是全球残疾和疾病负担的主要原因[3]。研究表明杏仁核中多种细胞因子、受体和活性变化参与了疼痛的调节[4-14]。研究发现,电针可缓解痛抑郁和痛记忆动物模型的痛觉异常和情绪障碍,中枢边缘系统中与杏仁核有密切联系的前扣带回皮层参与电针对痛感觉与痛情绪的调节过程[15-16];但其具体的分子生物学机制仍不明确。本部分实验以完全弗氏佐剂(complete Freund’s adjuvant,CFA)诱导的慢性疼痛大鼠模型为载体,对慢性炎性痛大鼠进行电针干预,观察模型大鼠的痛觉异常;筛选并探讨杏仁核中参与电针干预慢性疼痛的差异蛋白;本研究将更深层次地说明慢性痛的发生以及电针干预的新机制。
1 材料与方法
1.1 材料
1.1.1 实验动物
6~8周龄SPF级雄性SD大鼠共27只,体重为(250±20)g,购于中国科学院上海实验动物中心【SCXK(沪)2018-0006】。于浙江中医药大学实验动物中心【SYXK(浙)2018-0012】饲养。饲养于40 cm×5 cm×25 cm(长×宽×高)的独立送回风净化笼具内,每笼4~5只大鼠。饲养期间给予啮齿类动物标准颗粒饲料,均由浙江中医药大学实验动物中心提供及饲养,12 h循环灯光,室温为(25±1)℃,相对湿度为(50±5)%。本实验操作均遵循中华人民共和国《实验动物管理条例》的相关规定及人道主义精神。本实验操作均遵循浙江中医药大学实验动物管理与伦理委员会实验伦理学要求(伦理审批号:IACUC-20210118-07)。
1.1.2 主要试剂与仪器
CFA(F5881,美国Sigma);甘油、BSA(G0854、A0332-25G,中国上海生工);尿素、碘乙酰胺、十二烷基磺酸钠、银染试剂盒(161-0731、163-2109、161-0302、161-0450,美国Bio-Rad);KH2PO4、KCl、HCl(10017618、10016318、10011018,中 国 国 药);NH4HCO3、三氟乙酸(A6141、T6508,美国Sigma);Trypsin(317107,美国Promega);甲酸(064450,美国Fluka);Tris(T8060-1 kg,中国索莱宝)。
von Frey丝(Aesthesio,美国Danmic);电子天平(AB135-S,美国METTLER TOLEDO);色谱系统、质谱仪、酶标仪、C18上样柱、C18分析柱(Easy nLC、Q Exactive、Multiskcan FC、C18 μm,100Å、10 cm,μmC18-A2,美国Thermo Scientific);超声破碎仪(JY92-Ⅱ,中 国 宁 波 新 芝);SCX色 谱 柱(Polysulfoethyl,美国PolyLCInc)。
1.2 方法
1.2.1 实验方案
实验大鼠随机分为对照组、模型组、电针组,每组9只。对照组大鼠于左后足跖掌面皮下注射100 μL的生理盐水。模型组和电针组大鼠于左后足跖掌面皮下注射100 μL CFA以诱发慢性炎性痛模型。电针组电针治疗时间为造模后第1~14天,每日治疗1次。其余两组不进行电针干预。取材后对各组大鼠的右侧杏仁核进行同位素标记的相对和绝对定量(isobaric tags for relative and absolute quantitation,iTRAQ)蛋白质组学检测,对差异蛋白进行生物信息学分析,以探讨电针影响慢性疼痛的杏仁核潜在机制。实验流程图如图1所示。
1.2.2 造模
SD大鼠适应性喂养7 d,称重后用3%戊巴比妥钠注射液腹腔注射(1 mL/Kg)麻醉,对照组大鼠左后足跖掌面皮下注射生理盐水0.1 mL,模型组和电针组大鼠左后足跖掌面皮下注射0.1 mL CFA。造模成功后,模型组和电针组大鼠左足可见明显肿胀,对照组大鼠左足无明显改变。对照组、模型组和电针组大鼠造模后24 h左足形态如图2所示。

图2 对照组(左)和模型组、电针组(右)左足形态Figure 2 Hind paw photographs revealed an obvious swelling in the guarding posture of CFA rats
1.2.3 机械痛阈检测
将大鼠放置于金属网上,再盖以透明的有机玻璃罩,玻璃罩规格为20 cm×10 cm×15 cm,室温为(25±1)℃,相对湿度为(50±5)%,首先让大鼠进行15min左右的环境适应,当大鼠状态为相对安静后进行检测。用von Frey纤维丝对大鼠足底中部进行刺激,使纤维丝弯曲成S形,刺激时长为6~8 s(包括6、8 s),若在刺激期间,大鼠出现明显的缩足或舔足反应,则记为阳性。von Frey纤维丝的力度值共分为1.4、2、4、6、8、10、15和26 g。测试时从8 g力度值的纤维丝开始测试,若使用该力度值的纤维丝不能引起大鼠的缩足或者舔足反应时,记为阴性“O”,并使用力度值大一级的纤维丝继续检测;若使用8 g力度值的纤维丝能引起大鼠的缩足或舔足反应时,记为阳性“×”,并用小一级力度值的纤维丝继续检测,直至出现阴性和阳性(阳性和阴性)反应的骑跨。按相同标准连续测定4次。为消除每一次检测带来的影响,两次检测之间应间隔30 s,若使用力度值为26 g的纤维丝仍不能引起大鼠的阳性反应,则将50%缩足阈值记作26 g。50%缩足阈值计算公式为50% g PWT=(10[xf+kδ])/10 000,Xf为最后应用的von Frey纤维的力度log值,δ为相邻von Frey纤维力度log值之间差值的平均值(即0.184),k为阳性和阴性反应类型的查表值[17]。测试分别在第0天(基线)、第1、7、11和14天进行。
1.2.4 电针方法
电针组选取双侧足三里(ST36,胫骨前结节外侧5 mm)和三阴交(SP6,内踝隆起近10 mm)穴位将直径0.25 mm、长13 mm的不锈钢针直刺入穴位,深度为5 mm。采用平补平泄法。同侧的足三里和三阴交连接电针。电针参数设置如下:方波电流输出(脉宽:0.2 ms),电针强度从1 mA开始,每隔10 min增加0.5 mA,治疗时间为30 min。刺激频率为2 Hz。所有的大鼠都被布罩松散地固定,没有任何身体上的约束。电针时间为造模后第1~14天。每日治疗1次,共治疗14 d。对照组与模型组不予电针干预。
1.2.5 取材和蛋白提取
大鼠称重后用3%戊巴比妥钠注射液腹腔注射(1 mL/kg)麻醉,经左心室、升主动脉用生理盐水快速灌注200 mL,置于冰袋上断头,开颅,取脑。根据Paxinnos & Watson脑立体定位图谱,切取杏仁核(前囟向后0.36 mm至前囟向后5.04 mm;顶部向下7.4 mm至10.2 mm;正中线向右3 mm至5.4 mm,见图3),置于-80℃冻存。
蛋白提取:每组9个样本,每3个样本混为1管,加入适量SDT裂解液(4%十二烷基磺酸钠,100 mmol/L Tris-HCl,pH=7.6),转移至预先装有适量石英砂(组织样品另外加入1颗1/4英寸陶瓷珠)的2 mL离心管中,进行匀浆破碎,超声(80 W,工作10 s,间歇15 s,循环10次),沸水15 min。17 500 rpm离心40 min,取上清及滤液通过0.22 μm滤纸完成过滤收集。进行蛋白质定量(BCA,bicinchoninic acid)。分装样品,-80℃保存。
1.2.6 iTRAQ技术绘制蛋白质谱
用iTRAQ试剂(应用生物系统)标记每个样品的100 μg多肽混合物。然后使用AKTA净化器系统通过SCX层析对iTRAQ标记的肽进行分级。以1 mL/min的流速以0%~8%缓冲液B(10 mmol/L KH2PO4,pH=3.0,25%乙腈,500 mmol/L KCl)的梯度洗脱22 min,然后在22~47 min内洗脱8%~52%缓冲液B,在47~50 min内洗脱52%~100%缓冲液B,在50~58 min内洗脱100%缓冲液B,以及在58 min后洗脱0%缓冲液B。洗脱用214 nm处的吸光度监测,每1 min收集1次。收集的馏分在C18小柱上脱盐,真空离心浓缩。流程图见图4。

图4 iTRAQ实验流程Figure 4 Work flow of iTRAQ
1.2.7 质谱分析
高效液相色谱:样品的分离通过纳升流速的高效液相色谱(high-performance liquid chromatography,HPLC)液相系统Easy nLC完成。质谱鉴定:经液相系统分离后的样本通过Q-Exactive质谱仪完成质谱分析。采集多肽和多肽碎片的质量电荷比的方式如下:每次全扫描后采集10个碎片图谱,MS2 Activation Type为HCD,Isolation window为2 m/z,二级质谱分辨率17 500 at 200 m/z,Microscans为1,二级Maximum IT为60 ms,Normalized Collision Energy为30 eV,Underfill为0.1%。数据分析:查库鉴定与定量分析通过Mascot 2.2和Proteome Discoverer 1.4完成。
1.2.8 生物信息学分析
进行聚类分析时,首先对目标蛋白质集合的定量信息进行归一化处理(归一化到(-1,1)区间)。样本的分类及蛋白量的分析通过软件Graphpad Prism 8.0完成,并将分析结果展示为层次聚类热图。
1.3 统计学方法
采用SPSS 20.0软件进行统计分析,Graphpad Prism 8.0软件整理生成统计图;所有数据均以平均值±标准差()表示,组间比较采用单因素重复测量方差分析(ANOVA);多重比较中,方差齐时采用最低显著性差异(LSD),方差不齐时采用Dunnett检验。以P<0.05为差异有统计学意义。
2 结果
2.1 电针对CFA诱导的慢性炎性痛大鼠机械痛阈的影响
如图5所示,CFA注射前,各组大鼠左后足机械缩痛阈差异无显著性(P>0.05)。CFA注射后,模型组与电针组大鼠的机械缩痛阈显著下调(P<0.01);电针治疗后,电针组大鼠痛阈上调,与模型组相比差异具有显著性。
2.2 对照组大鼠和模型组大鼠杏仁核差异蛋白表达
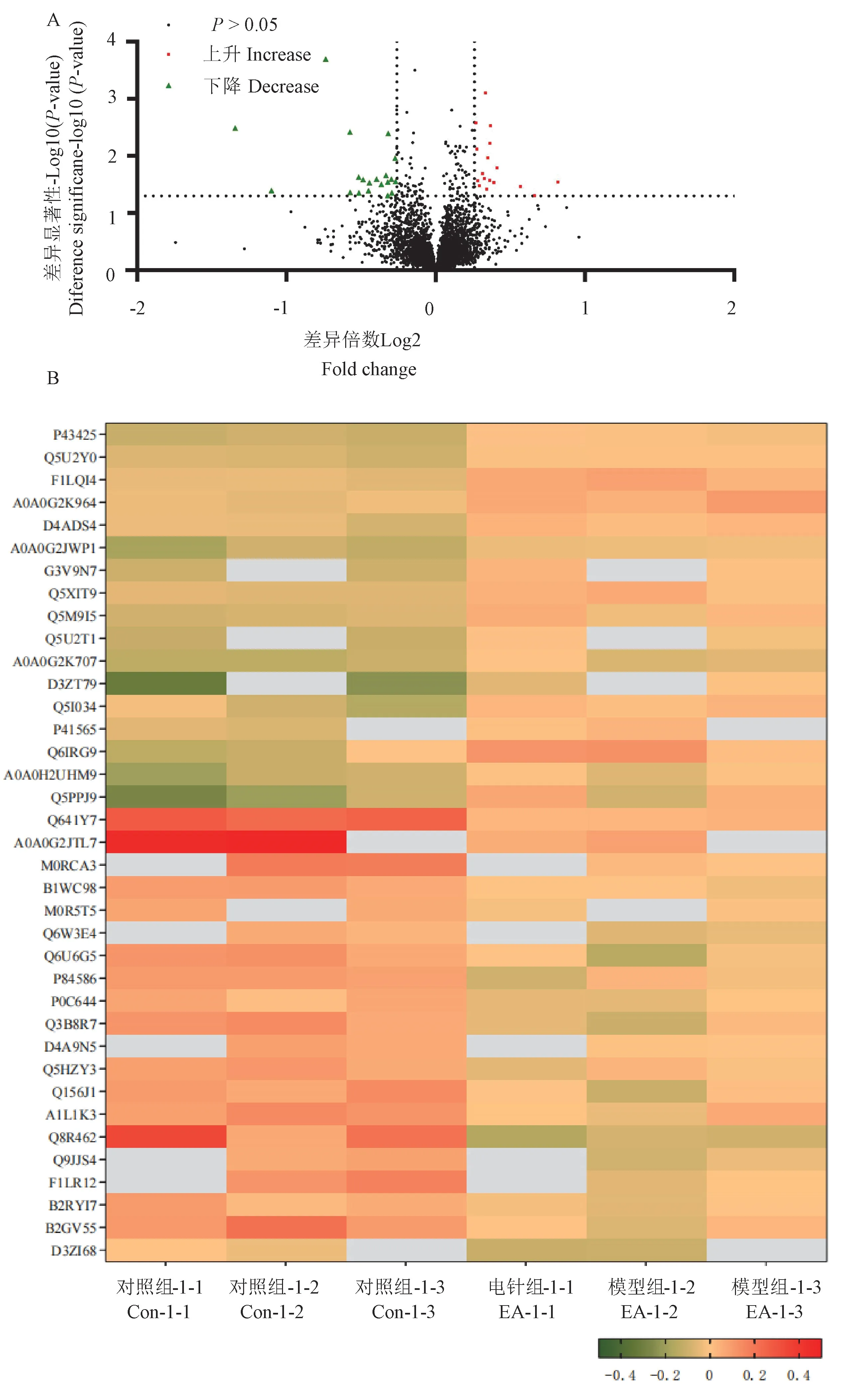
每组9只大鼠,每3只大鼠的杏仁核蛋白作为一个蛋白质组学检测样本,每个样本做3次方法学重复。iTRAQ鉴定到的蛋白中符合表达差异倍数大于1.2倍(上下调)且P值小于0.05筛选标准的蛋白质视为差异表达蛋白质,其数量如表1所示。其中,对照组与模型组相比,共检测到58个差异蛋白,其差异倍数和差异显著性如图6A所示。对照组与模型组相比表现出有显著性差异的蛋白质层次聚类分析图见图6B。

注:与模型组相比,##P<0.01;与对照组相比,**P<0.01。图5 各组大鼠不同时间点PWTs变化Note.Compared with model group,##P<0.01.Compared with Con group,**P<0.01.Figure 5 Comparisons of PWTs among groups of rats at different timepoints
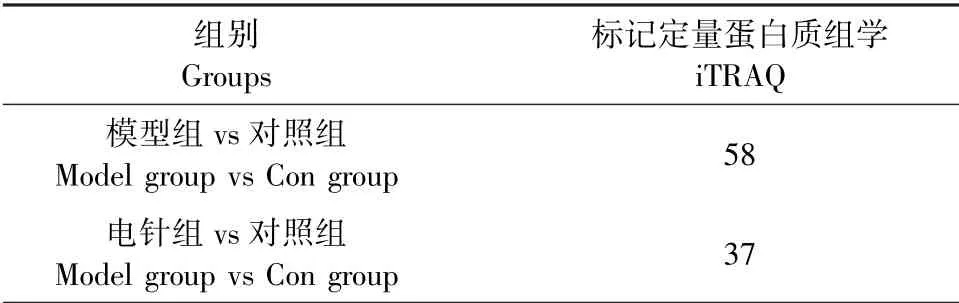
表1 两组间的差异蛋白数量Table 1 Number of differential proteins between two groups
对照组与电针组相比,共检测到37个差异蛋白,其差异倍数和差异显著性如图7A所示。对照组与电针组相比表现出显著性差异的蛋白质层次聚类分析图见图7B。
通过进一步的统计学分析,发现模型组相较于对照组变化有显著性差异且电针组相较于模型组有显著性差异且有意义的有F盒蛋白6(F-box only protein 6,FBXO6)、组蛋白甲基转移酶(SET and MYND domain-containing protein,Smyd5)、突触黏附蛋白(extracellular leucine-rich repeat fibronectin type III domain containing 1,Elfn1)共3个蛋白(见图8)。
在本研究中,蛋白质组学揭示了电针治疗慢性痛时影响杏仁核FBXO6、Smyd5、Elfn1表达的作用。其中3个蛋白的作用见表2。

表2 差异蛋白功能Table 2 Differential protein function

注:A:绿点为模型组相比对照组下降且差异有显著性;红点为模型组相比对照组上升且差异有显著性;B:与对照组相比的差异倍数,取其以10为底的对数值。图6 对照组与模型组相比差异有显著性的蛋白分布火山图和层次聚类分析图Note.A.The green dot is the decrease in the model group compared to the control group and there is a significant difference.The red dot is the increase in the model group than the control group and there is a significant difference.B.The multiple of the difference compared with the control group,which is the logarithmic value with the base 10 as the value.Figure 6 Volcano plot and heat map of differential proteins between Con group and model group
注:A:绿点为电针组比对照组下降且差异有显著性;红点为电针组比对照组上升且差异有显著性;B:与对照组相比的差异倍数,取其以10为底的对数值。图7 电针组与对照组相比差异有显著性的蛋白分布火山图和层次聚类分析图Note.A.The green dot is the decrease in the EA group compared to the control group and there is a significant difference.The red dot is the increase in the EA group than the control group and there is a significant difference.B.The multiple of the difference compared with the control group,which is the logarithmic value with the base 10 as the value.Figure 7 Volcano plot and heat map of differential proteins between EA group and Con group
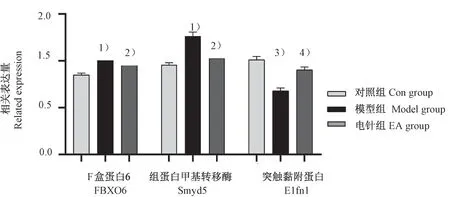
注:与对照组相比,1)P<0.01;与模型组相比,2)P<0.05;与对照组相比,3)P<0.05;与模型组相比,4)P<0.05。图8 电针诱导大鼠杏仁核FBXO6、Smyd5和Elfn1的表达变化Note.Compared with Con group,1)P<0.01.Compared with model group,2)P<0.05.Compared with Con group,3)P<0.05.Compared with model group,4)P<0.05.Figure 8 Electroacupuncture induces changes in the expression of FBXO6,Smyd5 and Elfn1 in the amygdala of rats
3 讨论
在本研究中,电针对慢性炎性痛模型大鼠的痛阈有明显的上调作用。疼痛和情绪的调控涉及到中枢与外周的多个环节、多种因子,针灸的调节同样涉及多靶点。在针灸和疼痛研究中,基因组学、蛋白质组学到代谢组学的研究方法的应用开始逐渐增多[30-31]。因此,研究了电针对杏仁核蛋白表达的影响。基于iTRAQ的蛋白质组学分析,模型组与对照组相比共发现58个显著改变的蛋白质,其中17个在杏仁核中表达上调,41个表达下调。同时,电针组与对照组相比杏仁核中共有37个蛋白发生显著变化,其中17个蛋白在杏仁核中表达上调,20个表达下调。最后,对照组对比模型组且电针组对比模型组差异有显著性且有意义的蛋白为FBXO6、Smyd5、Elfn1。
FBXO6是一种参与内质网相关蛋白降解(ERassociated protein degradation,ERAD)的泛素连接酶系统,负责N-糖蛋白的泛素化[32]。FBXO6能够调节细胞对复制应激的敏感性[33]。此外有研究发现FBXO6对I型干扰素(interferon-I,IFN-I)介导的抗病毒免疫反应的普遍作用[34]。FBXO6还能通过抑制内质网应激和抑制cJun氨基末端激酶(c-Jun Nterminal kinase,JNK)的活性以减轻镉对人胚肾293细胞(human embryonic kidney cells,HEK293)细胞的毒性[35]。但在疼痛领域中还没有关于FBXO6的文献报道。
Smyd5在维持染色体完整性方面发挥着重要作用[36]。Smyd5参与调节了巨噬细胞中的组蛋白甲基化,Smyd5使赖氨酸20上的组蛋白H4三甲基化,从而抑制炎症反应基因包括肿瘤坏死因子(tumor necrosis factor,TNF)、巨 噬 细 胞 炎 性 蛋 白1β(macrophage inflammatory protein-1β,MIP-1β)和白介素1(interleukin 1,IL-1)的表达[37]。这可能与电针缓解CFA诱发的慢性炎性痛相关。
Elfn1是一种突触黏附蛋白,也是一种假定的I型跨膜蛋白,含有一个富含亮氨酸重复型受体激酶(leucine-rich repeat receptor kinase,LRR)结构域、一个纤维连接蛋白III型结构域和一个跨膜域[38]。Elfn1是III组代谢性谷氨酸受体的变构调节器,也是一种跨突触支架蛋白,它是招募突触前谷氨酸受体7(glutamate metabotropic receptor 7,GRM7)和离子型谷氨酸海人藻酸受体(glutamate ionotropic receptor kainate,GRIK2)以形成突触所必需的[28,39]。代谢性谷氨酸受体(metabotropic glutamate receptors,MGluRs)构成一个内源性调节系统,它沿整个痛神经轴表达并调节痛觉[40]。有研究表明第七亚型代谢型谷氨酸受体(metabotropic glutamate receptor 7,mGluR7)对疼痛有易化作用[41]。因此,电针可能通过Elfn1对mGluR7的相关作用从而起到镇痛效应。
杏仁核是疼痛情绪-情感维度和疼痛调节的重要大脑中心[42]。有研究指出中央杏仁核(central amygdala nucleus,CeA)中的谷氨酸(glutamic acid,Glu)传递与疼痛有关[43-44]炎性痛大鼠CeA中过度表达的mGluR8可抑制伤害性行为,而这种效应的产生与Glu释放的增加、GABA的减少等因素相关[45]。Glu是中枢神经系统传递疼痛相关信号的主要神经递质。兴奋性谷氨酸能和抑制性γ-氨基丁酸能传递的失衡被认为是中枢敏感化发展的基础,而中枢敏感化能引起慢性疼痛患者的临床症状[46]。Elfn1在杏仁核中、Glu能神经元上表达[27]。因此,电针对慢性炎性痛大鼠的镇痛效应可能是通过Elfn1对杏仁核上的Glu能神经元的相关作用产生的,但确切机制仍不清楚。
综上所述,数据表明,CFA诱导的慢性炎性疼痛会导致杏仁核的蛋白变化,共有3个蛋白质在模型组和电针组的大鼠杏仁核中差异表达。由此可见,电针“足三里”“三阴交”可明显改善CFA诱发的慢性炎性痛。其机制可能与改变杏仁核中FBXO6、Smyd5、Elfn1表达相关。后期,将对3个差异蛋白中重要蛋白进行进一步的验证。我们的研究为进一步探讨电针影响慢性疼痛的杏仁核机制铺平了道路。

