参苓白术散对溃疡性结肠炎模型小鼠的疗效评价
马琪,翁与竞,李佳,覃施媛,何燕凤,马旭东
(1.西南大学动物医学院,重庆 402460;2.西南大学医学研究院免疫研究中心,重庆 402460)
溃疡性结肠炎(ulcerative colitis,UC)是一种慢性炎症性肠道疾病,病变多侵袭结直肠的黏膜及黏膜下层,其临床症状主要表现为腹痛、腹泻及便血等[1],常反复发作,很难痊愈。研究表明,该病可能与环境因素,基因遗传等有关[2-3]。目前普遍认为,UC机体存在肠黏膜炎症免疫耐受紊乱,肠黏膜免疫反应异常激活是UC发生、发展的重要因素[4]。近年来,UC的发病率有持续升高的趋势,且致癌风险增大[5]。因此,寻找治疗UC更为安全有效的药物显得尤为迫切。由于传统中药具有整体施治、安全可靠、毒副作用小等特点[6],中医药在治疗本病方面已经具有明显的天然优势,并且已有大量研究显示,中药可以通过调节肠道菌群[7],阻止肠道细菌和内毒素发生移位,平衡有益菌与细菌病毒,能明显提高黏膜细胞的再生能力,降低过高的黏膜通透性,从而改善黏膜的屏障功能。
UC证型实证中以大肠湿热为主,虚证中以脾虚证为主,在虚实夹杂证型中,多以脾虚为基础,并见湿热、寒湿、气滞、血瘀[8]。而在临床上,大肠湿热证、脾胃气虚证及脾虚夹湿热证三证型临床多见,符合中医学理论的病初起多属于实证,发展日久耗伤正气则形成虚证或虚实夹杂证的疾病发展观[9]。本研究探讨的脾虚泄泻型UC的病机关键为脾虚湿盛,运化失健[10]。中医认为,脾喜燥而恶湿,外来湿邪,最易困阻脾土,以致升降失调,清浊不分,水谷杂下而发生泄泻,即所谓“无湿不成泄”,故《杂病源流犀烛·泄泻源流》说:“湿盛则飧泄,乃独由于湿耳。”因此,健脾温肾、行气导滞是中药治疗UC的重要原则[11]。参苓白术散出自《太平惠民和剂局方》,是中医治疗脾虚夹湿证的经典方剂,由党参、白术、茯苓、山药、白扁豆、薏苡仁、砂仁、桔梗、莲子、炙甘草组成,诸药配伍,益气健脾,渗湿止泻[12]。常用于治疗脾胃虚弱,体倦乏力,饮食消化不良,泄泻,食少便溏等的脾虚泄泻证。本研究通过葡聚糖硫酸钠(dextran sodium sulfate,DSS)诱导小鼠UC模型,探究参苓白术散对其治疗效果。本研究采用DSS诱导的UC模型的方法,该造模方法操作简单、方便重复、实用性强,成功率高[13]。DSS是一种水溶性硫酸多聚糖,其会增加肠道黏膜通透性、导致上皮细胞坏死、扰乱肠道微菌群、影响机体免疫应答,从而诱导UC[14-16]。本研究通过预实验对比不同浓度DSS(3%、3.5%、4%)诱导的小鼠UC模型的差异,筛选出诱导小鼠UC最优浓度为3.5%水溶液,该浓度下,UC症状最典型,死亡率最低。DSS的给药方式选择为自由饮用。最后根据体重、大便性状、便潜血、结肠长度、结肠损伤评分、DAI评分、结肠组织病理学评分等指标,判断UC模型的建立是否成功以及评价参苓白术散的治疗效果。本研究探讨了参苓白术散对DSS诱导的UC小鼠的治疗效果,希望能为参苓白术散治疗UC提供科学依据并为抗溃疡新药研制奠定基础。
1 材料与方法
1.1 材料
1.1.1 实验动物
36只6周龄SPF级雄性BALB/c小鼠,体重约18~20 g,购自湖南斯莱克景达实验动物有限公司【SCXK(湘)2019-0004】。饲养于西南大学动物实验室【SYXK(渝)2019-0003】,饲养期间各组小鼠为自由饮水、采食。饲养环境:昼夜各半循环照明,湿度恒定,温度控制在25℃左右。所有操作均符合西南大学动物实验伦理学要求(审批号:IACUC-20190620-02)。
1.1.2 主要试剂与仪器
葡聚糖硫酸钠(DSS)(S0948,MW:36000-50000,MP Biomedicals),联邻甲苯胺(C10659221,上海麦克林),无水乙醇(20190818,成都金山化学),柳氮磺胺吡啶(sulfasalazine,SASP)(C10865372,上海麦克林生化),过氧化氢(200506,四川省伊洁士),冰醋酸(20170501,重庆川东化工)。
参考《太平惠民和剂局方》中参苓白术散的配方组成,药材莲子、薏苡仁、砂仁、桔梗、白扁豆、茯苓、党参、甘草、白术、山药购自重庆荣昌布美大药房,经西南大学动物医学院刘娟教授鉴定,莲子为睡莲科植物莲Nelumbo nucifera Gaertn.的干燥成熟种子,薏苡仁为禾本科植物薏苡Coix.Lacryma-jobi L.var.mayuen(Roman)Stapf的干燥成熟种仁,砂仁为为姜科植物阳春砂Amomum villosum Lour.的干燥成熟果实,桔梗为桔梗科植物桔梗Platycodon grandiflorum(Jacq.)A.DC.的干燥根,白扁豆为豆科植物扁豆Dolichos lablab L.的干燥成熟种子,茯苓为多孔菌科真菌茯苓Poria cocos(Schw.)Wolf的干燥菌核,党参为桔梗科植物党参Codonopsis pilosula(Franch.)Nannf.的干燥根,甘草为豆科植物甘草Clycyrrhiza uralensis Fisch.的干燥根茎,白术为菊科植物白术Atractylodes macrocephala Koidz.的干燥根茎,山药为薯蓣科植物薯蓣Dioscorea oppasita Thunb.的干燥根茎。
1.2 方法
1.2.1 药物及试剂的制备
参苓白术散浸膏制备:将药物按莲子肉、薏苡仁、砂仁、桔梗(炒):扁豆(炒):茯苓、党参、甘草、白术(炒)、山药=2∶3∶4的比例称取50 g,先后以八倍水、六倍水煎煮1 h,纱布过滤,合并滤液,蒸发浓缩至1 g/mL,再分别以65%、75%乙醇先后醇沉24 h,均取上清液,用旋转蒸发仪75°C 106 r/min,蒸发至1 g/mL,烘干,4℃保存。灌胃时以纯净水溶解配置,高剂量12.56 g/(kg·d),中剂量6.28 g/(kg·d),低剂量3.14 g/(kg·d)。
柳氮磺胺吡啶溶液配制:用纯净水配置成0.045 g/mL的溶液,剂量为0.45 g/(mL·d)。
DSS配制:称取葡聚糖硫酸钠溶解于水中,配成3.5%的浓度。
联邻甲苯胺冰醋酸溶液配制:取0.5 g联邻甲苯胺,加入等体积的无水乙醇和冰醋酸,定容至50 mL,置于棕色瓶中,用锡纸包裹,避光4℃保存。
1.2.2 分组及动物的处理
采用随机数字表法把小鼠分为6只/组。A组:参苓白术散高剂量组;B组:参苓白术散中剂量组;C组:参苓白术散低剂量组;D组:柳氮磺胺吡啶治疗组;E组:空白对照组;F组:模型组。A、B、C、D、F组饮用3.5% DSS水溶液,E组饮用纯净水。每天更换新鲜饮水,连续1周。A、B、C、D、E、F组分别以高剂量参苓白术散、中剂量参苓白术散、低剂量参苓白术散、柳氮磺胺吡啶、纯水、纯水按10 mL/kg灌胃,共1周。
1.2.3 观察指标
记录小鼠每日体重变化、死亡率、粪便性状和隐血。其中,采用邻甲苯胺法检测小鼠粪便隐血,邻甲苯胺法为1983年中华医学会全国临床检验方法学术讨论会推荐的方法,利用血红蛋白中的亚铁血红素具有过氧化物酶活性,催化过氧化氢释放出新生态氧,使其显色,此方法操作较为简单易行[17]。检测方法如下[18]:取小鼠粪便,涂压于滤纸上,在粪便上滴加2~3滴15%邻甲苯胺冰醋酸溶液;再滴加2~3滴3% H2O2;立即观察结果,在2 min内显蓝褐色为阳性。参照表1的标准评分。

表1 隐血检测判断标准Table 1 Criteria for occult blood detection
1.2.4 结直肠长度的测量
给药结束后,处死小鼠,剖腹,取盲肠末端至肛门段的结直肠,测量其自然长度并记录。
1.2.5 结肠组织黏膜损伤评分
沿肠系膜纵行剪开,平铺于玻璃板上,用冷生理盐水漂洗干净,肉眼观察结肠黏膜损伤程度,依Cooper方法进行评分,标准参照表2[19]。

表2 结肠黏膜肉眼观察评分标准Table 2 Scoring criteria for eye observation of colonic mucosa
1.2.6 疾病活动指数(DAI)评分
参照表3的标准评估小鼠的疾病活动指数(DAI)。DAI=(体重下降分数+大便性状分数+大便隐血分数)/3。依Cooper方法进行评分,标准如表3[19]。

表3 DAI评分标准Table 3 DAI scoring criteria
1.2.7 脏器系数
依次称取小鼠心、肝、脾、肾的脏器重量,计算各脏器与其体重之比值即为对应的脏器系数。
1.2.8 结肠组织病理学评分
将小鼠整个结肠泡入10%中性福尔马林固定后,用石蜡包埋,制成切片(约5 μm)后进行伊红-美蓝(HE)染色制成病理切片。采用Leica DFC显微拍照系统对病理切片进行观察与拍照并进行组织病理学评分,评分内容包括肠上皮细胞损伤程度和炎症浸润程度,结果可以用于评价结肠组织损伤程度。评分标准如表4[20]。
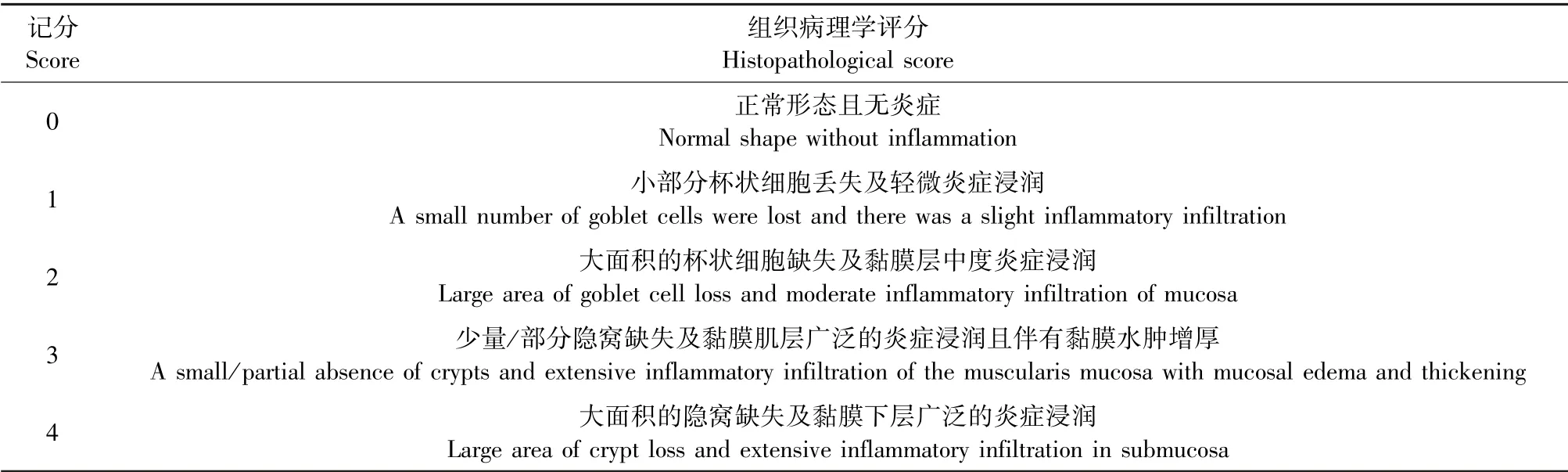
表4 组织病理学评分标准Table 4 Histopathological scoring criteria
1.3 统计学分析
2 结果
2.1 小鼠的一般状况
各组小鼠在实验前精神状态、体重及大便性状等各方面均正常。造模期间,除E组小鼠外,其他各组小鼠随着造模进程逐渐出现懒动、拱背,毛发无光泽,嗜卧扎堆,且部分小鼠因腹泻便血严重表现出消瘦、站立不稳,肛周粘附有干涸的血便。给予治疗的A、B、C组小鼠精神状况随治疗深入逐渐好转,其中参苓白术散中剂量组小鼠的腹泻、便血情况显著减轻。
2.2 体重变化
在治疗期间,B、C、E组小鼠体重先上升,后逐渐趋于平稳,A、D、F组的小鼠体重一直维持在低水平波动。与F组相比较,E组体重明显升高,差异极具显著性(P<0.01),C组次之,差异极具显著性(P<0.01),B组小鼠体重较F组高,差异具有显著性(P<0.05)(见图1)。
2.3 小鼠结肠黏膜损伤眼观评分
F组小鼠炎症病变主要靠近肛门段结肠,病变黏膜充血、水肿、糜烂和溃疡形成。B组小鼠与E组小鼠的结肠评分相近,表明B组恢复较好,与F组比较,差异具有显著性(P<0.05)。A、C、D组无显著性差异(见图2)。

注:与F组比较,*P<0.05,**P<0.01,与E组比较,#P<0.05,##P<0.01。(下图同)图1 小鼠每日体重变化折线图Note.Compared with group F,*P<0.05,**P<0.01.Compared with group E,#P<0.05,##P<0.01.(The same in the following figures)Figure 1 Daily weight change line chart of mice

注:A:结肠黏膜病变;B:结肠黏膜损伤眼观评分。图2 结肠黏膜病变及结肠黏膜损伤眼观评分Note.A.Mucosal lesion of colon.B.Score of colonic mucosal injury by eye observation.Figure 2 Lesion and injury score by eye observation of colonic mucosal
2.4 小鼠结直肠长度
小鼠结肠长度缩短是UC的重要特征[21]。与E组相比,F组结肠长度明显缩短(P<0.05)。与F组相比,A组、B组、C组、D组DSS所致小鼠结肠缩短的现象均有不同程度的缓解。尤其B,C组(P<0.05)效果最为明显,治疗效果好于其他组(见图3)。
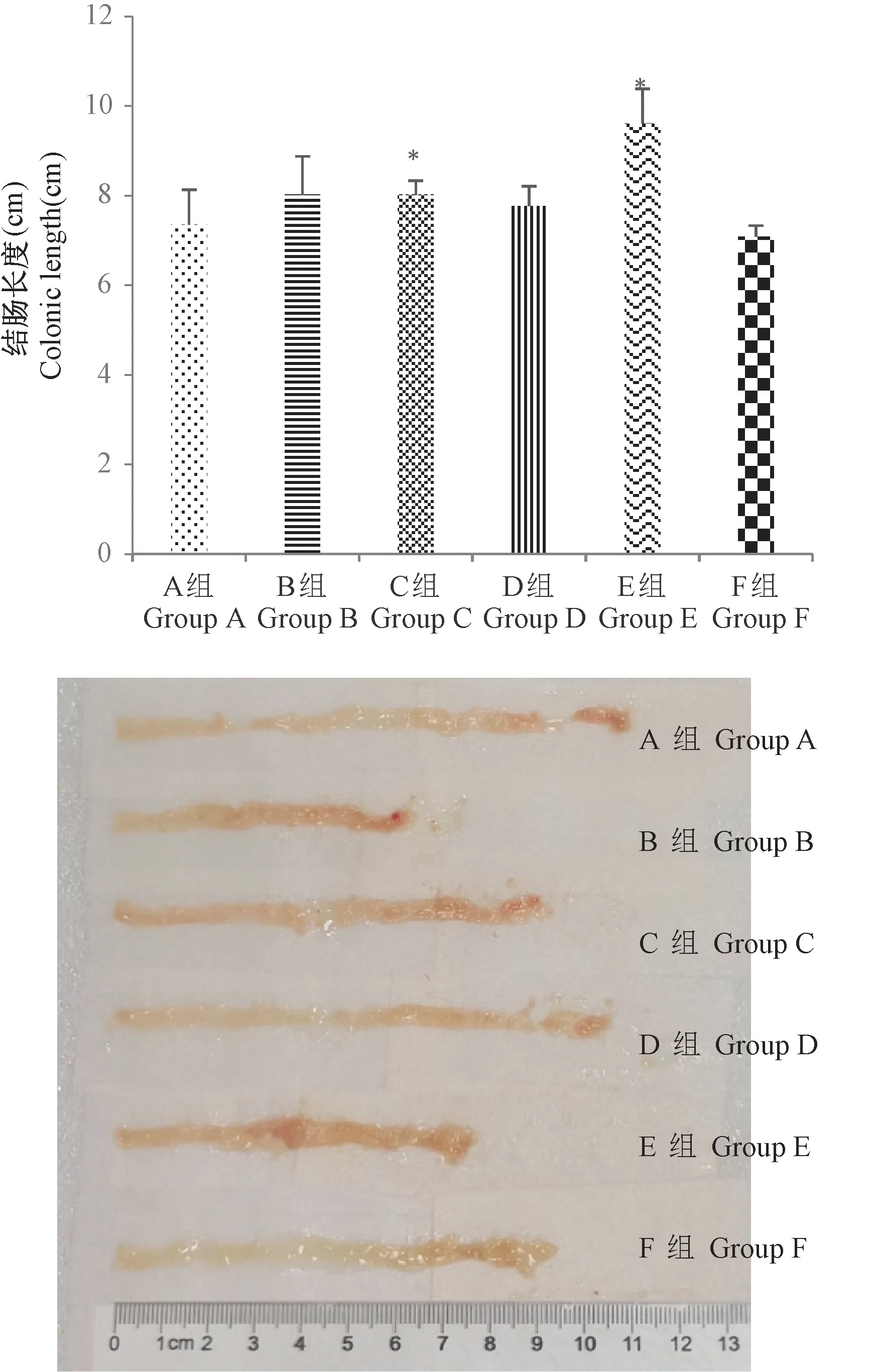
图3 小鼠结肠长度变化Figure 3 Changes of colonic length in mice
2.5 隐血及肉眼便血
粪便带血是UC的临床特征之一。与E组相比,F组隐血及便血最严重(P<0.05)。A组、C组及D组隐血及便血情况逐日严重,与F组相比情况较好。B组自第3天后,隐血及血便的情况逐渐好转,直到第6、7天,隐血检测呈阴性。说明A组、B组、C组及D组对DSS诱导的UC有所改善,但与F组相比,A组、C组及D组差异无统计学意义,只有B组差异极具显著性(P<0.01),治疗效果最明显(见图4)。
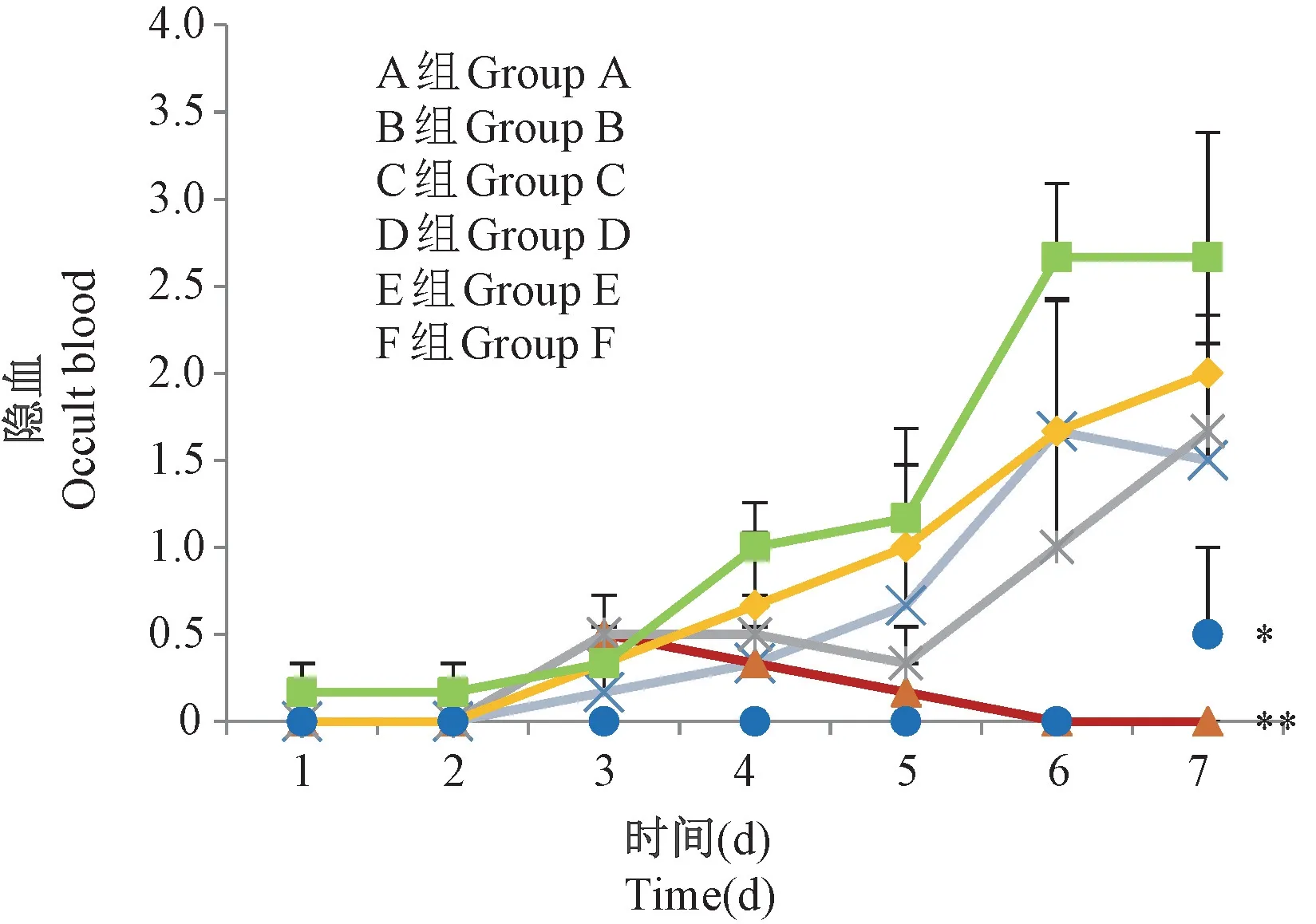
图4 隐血及肉眼便血评分Figure 4 Occult blood and naked eye hematochezia score
2.6 DAI评分
F组的DAI评分基本呈上升趋势,显著高于E组。最后2 d,F组的疾病活动指数比其他组都高,说明各组的治疗有一定的效果。B组、E组基本在同一水平上波动,表明B组治疗效果最好(见图5)。

图5 小鼠DAI评分Figure 5 DAI score in mice
2.7 脏器系数
结果显示,肝、脾、心、肾的脏器系数无显著性差异,说明UC导致的病变不会影响肝、脾、心、肾的脏器功能。(见图6)。

图6 小鼠脏器系数Figure 6 Organ coefficient of mice
2.8 结肠组织病理切片及病理学评分
病理切片结果表明UC导致模型组小鼠结肠肠黏膜上皮结构破坏,正常形态消失,上皮细胞及皱襞变矮,整个肠壁变薄,黏膜下层有炎性细胞浸润,组织病理学评分与空白组相比差异具显著性(P<0.01)。同时,参苓白术散治疗组小鼠结肠黏膜比较完整。但D组结肠肠黏膜上皮破损严重,肠黏膜有显著糜烂,黏膜层、黏膜下层有大量炎性细胞浸润,肠壁显著增厚。说明参苓白术散对UC的治疗有一定效果,同时柳氮磺胺吡啶治疗UC未取得疗效(见图7)。
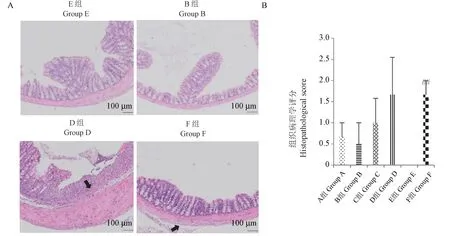
注:A:小鼠结肠组织HE染色病理切片;B:组织病理学评分。图7 小鼠结肠组织病理学检测(n=3)Note.A.Representative images of colon pathologic damages with hematoxylin and eosin(HE)staining.B.Histopathological score.Figure 7 Histopathological examination of colon tissues in mice(n=3)
3 讨论
UC是一种黏膜和黏膜下层的慢性非特异性炎症,病变主要在结肠和直肠,临诊主要表现为腹痛、腹泻、排血便等。《医学心悟》指出:“湿多成五泻,泻之属湿明矣。然有湿热,有寒湿,有积食,有脾虚,有肾虚,皆能致泻,宜分而治之。”参苓白术散有健脾渗湿之功,是用于治疗脾虚泄泻型UC的有效方剂。临床上已有报道用参苓白术散的加减方或联合方治疗UC,且有较好的疗效。研究表明中医药辨证治疗UC,尤其是慢性阶段的UC治疗,有药物副作用较小、疗效显著的优势[22]。
DSS会破坏肠道上皮细胞的完整性,击破肠道的机械屏障,诱发急性UC,主要表现为腹泻、溃疡、直肠出血和粒细胞浸润[14]。同时,还能对肠道生物屏障即肠道菌群产生影响,破坏有益菌的生存环境,导致肠内细菌和病毒移位,使细菌病毒更容易进入上皮细胞而造成上皮损伤[7]。还因为DSS有抗凝作用,所以能延缓血液凝固[15-16],造成肠道出血。此外,还与机体免疫应答失调有关。因此,本研究采用DSS自由饮水的方式建立UC小鼠模型,给予不同剂量的参苓白术散治疗,通过对小鼠进行临床表现及结肠相关指标量化评分,综合评价了参苓白术散对UC小鼠的治疗效果。
因DSS引起小鼠结肠长度的缩短,结肠黏膜损伤,粪便带血,粪便稠度改变是UC的重要特征[21],故本实验观测小鼠的粪便性状,隐血及肉眼血便,结肠长度,结肠黏膜损伤,组织病理学以及一些可以参考的相关体征。实验数据表明,B组(P<0.05)、C组(P<0.01)、E组(P<0.01)体重均明显较F组高,B组结肠黏膜损伤眼观评分明显低于F组(P<0.05),F组结肠长度与E组相比明显缩短(P<0.05)且B组、C组与F组相比小鼠结肠缩短的现象得到缓解(P<0.05),F组与E组相比隐血及便血情况明显严重(P<0.05)且B组相较于F组隐血及便血情况明显改善(P<0.01),F组的DAI评分基本呈上升趋势且显著高于E组,同时B组与E组DAI评分波动相近,另外组织病理学结果显示F组与E组相比结肠病变严重(P<0.01),同时参苓白术散治疗组病理切片与空白组较为相近。以上数据说明高中低剂量的参苓白术散均能改善UC小鼠临床症状,其中参苓白术散中剂量治疗组治疗效果最佳。另外,本实验中D组治疗效果不明显,可能是由于柳氮磺胺吡啶几乎不溶于水,配成的溶液极易发生沉淀,导致灌胃后小鼠极难吸收,且药物沉积于胃肠致其运化失职、升降失调,以致伤食泄泻,影响进食和给药,进一步加剧了结肠炎炎症,因而D组体重一直处于较低的状态,且结肠粘膜损伤眼观评分、粪便隐血、DAI指数一直不见降低,病理切片也显示结肠病变较为严重。因此,D组应用羧甲基纤维素钠来配置柳氮磺胺吡啶以增强溶解与吸收。
4 结论
本研究通过采用量化的UC临床疾病活动指数评分、结肠眼观评分、组织病理学评分及观察临床表现综合评价了参苓白术散对DSS诱导的小鼠急性UC的治疗效果。结果表明,参苓白术散浸膏可以有效改善UC小鼠的症状,其中参苓白术散中剂量组治疗效果最好。

