猴头菇提取物的质量标准研究
◎ 李美珍,陈炎欢,冯华业,黄绮敏,黄照荣
(无限极(中国)有限公司,广东 江门 529100)
猴头菇(Hericium erinaceus)提取物是以猴头菇为原料,经提取、过滤、浓缩、干燥等工序制成的提取物。主要作为膳食补充剂,也广泛用于食品、保健食品行业。猴头菇提取物具有抗氧化、保护胃黏膜的作用[1-5]。
目前在国内外均未有猴头菇提取物相关的质量标准。多数植物提取物企业执行的都是自身的企业标准。由于没有统一的质量标准,猴头菇提取物质量要求差异大,产品质量无法保证,不利于行业的发展。因此,建立猴头菇提取物质量标准,对进一步规范猴头菇提取物的生产、销售具有重要的现实意义。
1 材料与方法
1.1 材料与试剂
猴头菇提取物(适量猴头菇药材加8倍量水煎煮3次,合并滤液,70 ℃减压浓缩,经喷雾干燥而得)。10批猴头菇提取物来源于3个厂家,编号1~10。腺苷标准品(CAS号58-61-7,批号110879-201703),中国食品药品检定研究院,含量以99.9%计;甲醇为色谱纯(德国 Merck公司);其他试剂均为分析纯,水为纯化水。
1.2 仪器与设备
HP1200 型高效液相色谱仪(包括二极管阵列检测器,美国Agilent公司)。
1.3 实验方法
1.3.1 感官测定
取本品嗅其气味、尝其滋味;另取试样适量置于白色瓷盘中观察其色泽、外观,并检查有无异物。
1.3.2 薄层色谱鉴别
(1)对照品溶液配制。取2.0 mg腺苷溶解于2.0 mL甲醇中,制成1 mg·mL-1的腺苷对照品溶液。
(2)供试品溶液配制。取本品粉末约5.0 g,置于锥形瓶中,加入90%甲醇30 mL,加热回流提取30 min,取出放冷,过滤并蒸干滤液,残渣加热水10 mL溶解,放冷,用石油醚(60~90 ℃)提取2次,每次20 mL,弃去石油醚液、水液,用水饱和正丁醇提取3次,每次30 mL,合并正丁醇提取液,水浴蒸干,残渣加甲醇1 mL溶解,摇匀,即得。
(3)薄层色谱测定。分别吸取对照品溶液1 μL,供试品溶液5 μL,点于同一硅胶板上,以三氯甲烷-乙酸乙酯-异丙醇-水-浓氨溶液(8∶2∶6∶0.3∶0.2,体积比)为展开剂,展开,取出,晾干,置紫外光灯(254 nm)下检视。供试品色谱中,在与对照品色谱相应的位置上,应显相同的荧光淬灭斑点。
1.3.3 理化指标测定
水分按照《食品安全国家标准 食品中水分的测定》(GB 5009.3—2016)的第一法进行测定。灰分按照《食品安全国家标准 食品中灰分的测定》(GB 5009.4—2016)规定的方法进行测定。粒度按照《中华人民共和国药典(2020版)》第四部通则中“粒度和粒度分布测定法”第二法(筛分法)进行测定,过100目筛。
1.3.4 腺苷的含量测定
(1)对照品溶液制备。精密称取腺苷对照品约2 mg于100 mL容量瓶中,用50%甲醇溶解并定容至刻度,即得。
(2)供试品溶液制备。精密称取本品约2.0 g于50 mL小烧杯中,加水40 mL,加热溶解,取出放至室温,转移至50 mL容量瓶中,加水至刻度,摇匀,用0.45 μm的针式过滤器过滤,取续滤液,即得。
(3)色谱条件。色谱柱:十八烷基键合硅胶柱(250 mm×4.6 mm,5 μm)。流动相:以甲醇为流动相A,以水为流动相B,按表1中的规定进行梯度洗脱;波长260 nm;柱温30 ℃;流速1.0 mL·min-1;进样量5 μL;理论塔板数按腺苷峰计算应不低于5 000。
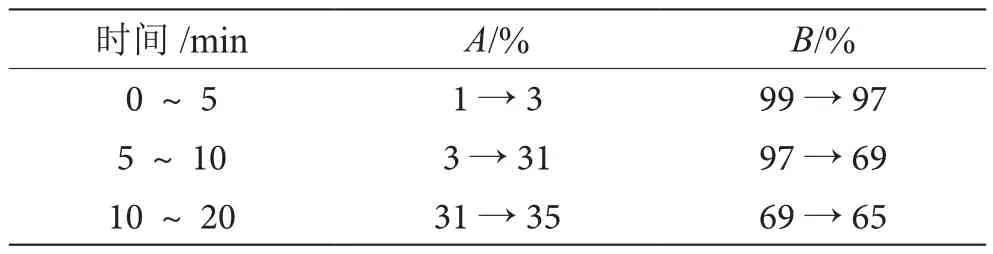
表1 梯度洗脱条件表
(4)线性关系考察。精密称取腺苷对照品2.220 mg置于50 mL容量瓶中,按1.3.4中(1)项下制备方法加50%甲醇溶解制成储备液,再精密吸取该储备液1.0 mL、2.0 mL、4.0 mL、6.0 mL、8.0 mL和10.0 mL分别至10 mL容量瓶中,加50%甲醇定容至刻度,摇匀,按1.3.4中(3)项下色谱条件分析,测定峰面积。以腺苷对照品的浓度(μg·mL-1)为横坐标,峰面积为纵坐标,求得回归方程。
(5)精密度试验。精密称取1.3.4中(1)项下制备的腺苷对照品溶液(浓度22.133 4 μg·mL-1),重复进样6次,分别计算峰面积及保留时间的RSD值。
(6)稳定性试验。取猴头菇提取物(批号200401)按1.3.4中(2)项下制备的供试品溶液,按1.3.4中(3)项下色谱条件分别于0 h、2 h、4 h、6 h、12 h和24 h测定,计算供试品中腺苷峰面积。
(7)重复性试验。取猴头菇提取物(批号200401)同一天内按1.3.4(2)项下制备的6份供试品溶液,按1.3.4中(3)项下色谱条件测定,计算腺苷平均含量、RSD及分离度。
(8)回收率试验。取猴头菇提取物(批号200401,腺苷含量为0.025%)精密称定约1.0 g于9个50 mL小烧杯中。另取腺苷对照品(纯度99.7%)4.882 mg置100 mL容量瓶中,加50%甲醇溶解并定容(此对照品溶液含腺苷48.673 5 μg·mL-1),分别吸取该对照品溶液2.5mL(以腺苷计121.683 8 μg)、5.0 mL(以腺苷计243.367 7 μg)、7.5 mL(以腺苷计365.051 6 μg),分3组加入含样品的9个50 mL小烧杯中,按1.3.4中(2)项下制成供回收率测定用供试品溶液,按1.3.4中(3)项下色谱条件测定,计算腺苷的回收率及RSD值。
(9)样品含量测定。分别精密吸取对照品溶液和供试品溶各5 μL,注入液相色谱仪,测定。根据所得对照品溶液和供试品溶液色谱图中腺苷峰面积计算供试品中待测组分腺苷含量。
1.3.5 重金属指标测定
重金属指标按照《食品安全国家标准 食品中多元素的测定》(GB 5009.268—2016)第一法电感耦合等离子质谱法(ICP-MS)规定的方法测定铅、砷、汞、镉含量。
1.3.6 微生物检查
菌落总数的测定按《食品安全国家标准 食品微生物学检验 菌落总数测定》(GB 4789.2—2016)规定的方法进行;霉菌和酵母的测定按《食品安全国家标准食品微生物学检验 霉菌和酵母计数》(GB 4789.15—2016)规定的方法进行;大肠埃希氏菌的测定按《食品安全国家标准 食品微生物学检验 大肠埃希氏菌计数》(GB 4789.38—2012)规定的方法进行。沙门氏菌的测定按《食品安全国家标准 食品微生物学检验 沙门氏菌检验》(GB 4789.4—2016)规定的方法进行。金黄色葡萄球菌的测定按《食品安全国家标准 食品微生物学检验 金黄色葡萄球菌检验》(GB 4789.10-2016)第一法金黄色葡萄球菌定性检验规定的方法进行。
2 结果与分析
2.1 感官测定
观察发现10批猴头菇提取物为棕色、棕红色至棕褐色干燥均匀的粉末,色泽均匀,具有猴头菇特有的气味,无异味,无正常视力可见外来异物。
2.2 薄层色谱鉴别
S为腺苷。供试品色谱中,在与对照品色谱相应的位置上,显相同的荧光淬灭斑点。见图1。
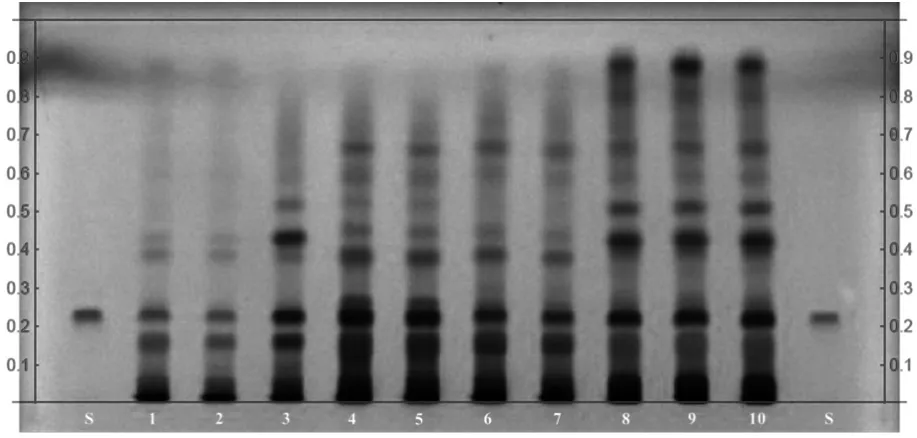
图1 猴头菇提取物薄层色谱图
2.3 理化指标测定
理化检测发现,10批原料的水分从3.16%到5.72%,灰分从3.11%到9.55%不等,粒度通过率均在96%以上。具体结果见表2。

表2 猴头菇提取物水分、灰分、粒度测定结果表
2.4 腺苷的含量测定
(1)线性关系考察。以腺苷对照品的浓度(μg·mL-1)为横坐标,峰面积为纵坐标,求得回归方程:Y=0.2779X-0.037 7,R2=1。结果表明腺苷在2.213 3~22.133 4 μg·mL-1范围内与峰面积呈良好的线性关系。
(2)精密度试验。重复进样6次,分别计算峰面积及保留时间的RSD值,保留时间和峰面积的RSD值为0.44%和0.05%。不对称度以腺苷计不高于1.1。理论塔板数以腺苷计约71 000,表明仪器精密度良好。
(3)稳定性试验。结果供试品中腺苷峰面积的RSD为0.68%(n=6),表明供试品溶液在24 h内稳定。
(4)重复性试验。腺苷平均含量为0.025%,RSD为1.76%。分离度大于1.5,表明该方法重复性良好。
(5)回收率试验。计算腺苷的回收率,平均回收率为97.80%(92%~105%),RSD值为1.15%,表明该方法准确度良好。
(6)样品含量测定。根据所得对照品溶液和供试品溶液色谱图中腺苷峰面积计算供试品中待测组分腺苷含量。结果见表3,10批猴头菇提取物中腺苷含量按干燥品计算分别不低于0.02%。

表3 猴头菇提取物腺苷含量测定结果表
2.5 重金属指标测定
猴头菇提取物铅、砷、汞、镉测定结果见表4。

表4 猴头菇提取物铅、砷、汞、镉测定结果表(单位:mg·kg-1)
2.6 微生物检查
猴头菇提取物微生物检查结果见表5。

表5 猴头菇提取物微生物检查结果表
3 结论
根据对猴头菇提取物进行感官测定、薄层色谱鉴别、理化指标测定、腺苷含量测定、重金属指标测定和微生物检查的结果,结合食品和药品质量标准的制定原则,和相关国家标准以及产品特性、市场要求初步制定了猴头菇提取物质量标准,结果见表6。本研究初步建立的猴头菇提取物质量标准提高了其质量评价的客观性与专属性,为进一步规范猴头菇提取物生产、销售行业提供科学依据。

表6 猴头菇提取物质量标准表
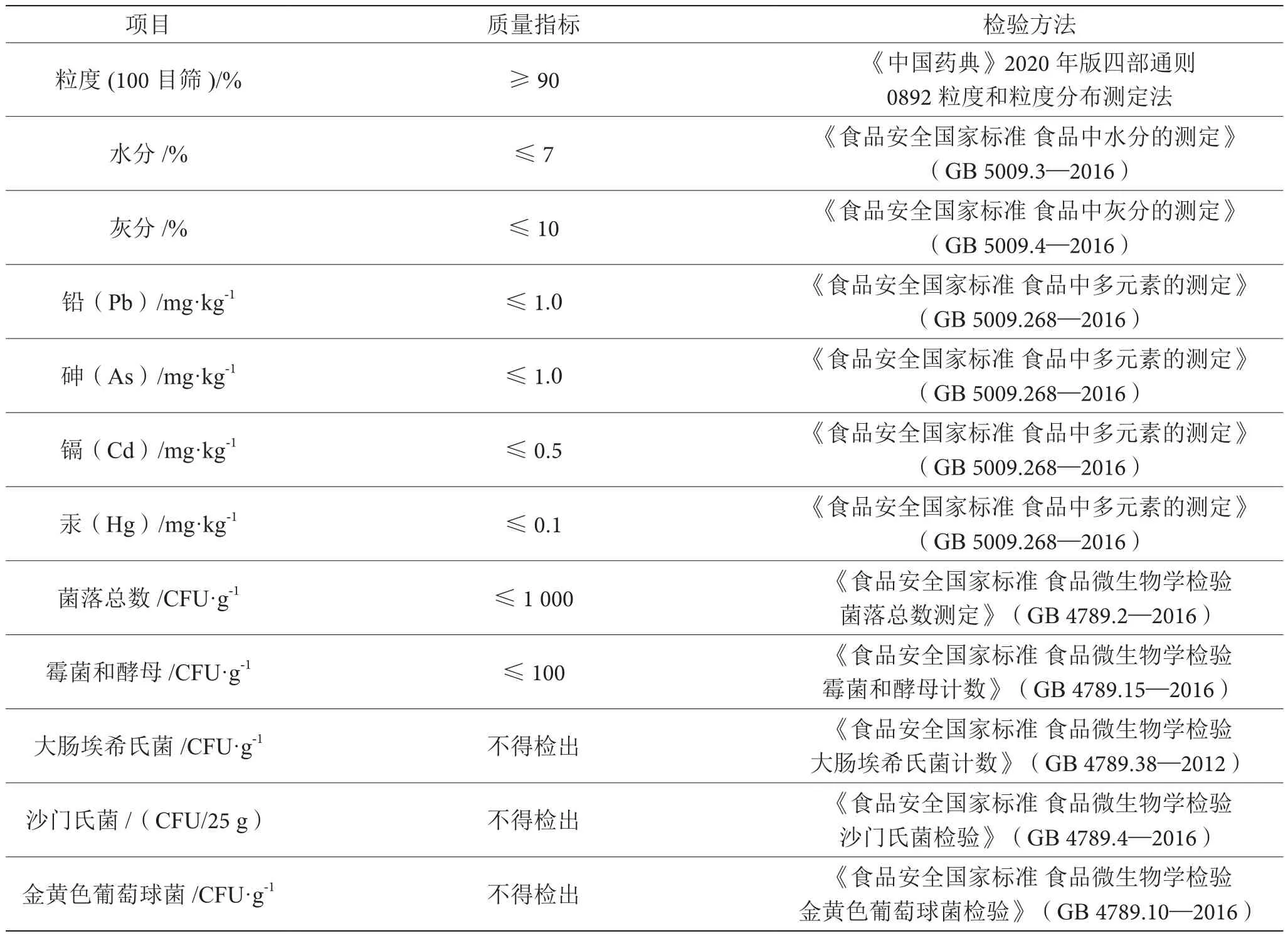
(续表6)

