SOD-肝素结合结构域融合蛋白的毕赤酵母重组菌株构建及表达
叶芬,周建森,郭静科,刘树滔
(1.福州大学生物工程研究所,福建 福州 350002;2.福州大学至诚学院食品与生物工程系,福建 福州 350002)
0 引言

胞外超氧化歧化酶(EC-SOD)较为特殊,它具有独特的C端肝素结合结构域(heparin binding domain,HBD).该结构域具有肝素亲和性,可特异性地与富含肝素的细胞表面[5]结合.因此,EC-SOD可能是保护细胞表面和细胞外基质蛋白免受超氧化物介导的氧化损伤的第一道防线[6],在预防和治疗氧化损伤相关的疾病方面,如高脂肪饮食诱发的肥胖、炎症和胰岛素抵抗[7]等,都具有重大的应用潜力.EC-SOD有着很高的应用价值,但是一方面天然EC-SOD在生物体内的含量很低,较难通过分离提取的方式获得[8-9],另一方面,通过基因重组表达的方式获得的EC-SOD的活力不高[6, 10-12],例如,范立强等[10]研究的重组EC-SOD在粉纹夜蛾Tn-5Bl-4细胞中表达的比活力只有260 U·mg-1,Shrestha等[11]发现重组EC-SOD的表达水平只有220 U·mL-1的酶活力,Bae等[12]的研究显示重组EC-SOD表达的比活力为124.7 U·mg-1.这些都限制了EC-SOD的推广和应用.
EC-SOD基因重组蛋白表达活力不高的原因可能是由于缺乏适当的折叠和成熟机制[9].由于EC-SOD本质上也是Cu, Zn-SOD,与其他Cu, Zn-SOD明显不同的只是EC-SOD具有的独特C端肝素结合结构域(HBD),而Cu, Zn-SOD具有非常优良的重组蛋白高水平表达,例如郑屹峰等[13]发现Cu, Zn-SOD在重组毕赤酵母中的表达可达895 U·mL-1.因此解决EC-SOD表达活力不高的一个方法是采用Cu, Zn-SOD与HBD的融合表达.基于这种思路,本研究尝试将人源EC-SOD的HBD与Cu, Zn-SOD编码序列的基因融合和密码子优化,并导入毕赤酵母,构建高水平表达SOD-HBD融合蛋白的毕赤酵母工程菌,从而为EC-SOD的推广与应用奠定基础.
1 材料与方法
1.1 材料
1) 菌株与质粒.P.pastorisX-33、pPICZαA表达质粒购自上海生物工程股份有限公司;E.coliDH5α购自北京Solarbio公司.
2) 仪器与设备.S1000型PCR扩增仪,美国BIO-RAD公司;AE-6450型蛋白质电泳仪,日本ATTO公司;DYY-5型核酸电泳仪,北京六一仪器厂;JS-380A型凝胶成像分析仪,上海培清科技有限公司;U-1900型紫外分光光度计,日本HITACHI公司;电转化仪,美国BIO-RAD公司.
3) 主要试剂.DNA marker DL5000、EcoR I、XbaI、SacI、PCR mix均购自日本Takara公司;DNA胶回收试剂盒购自杭州博日科技有限公司;UNIQ-10柱离心式质粒小量抽提试剂盒、NBT所用试剂等购自上海生物工程股份有限公司;BCA蛋白浓度测定试剂盒购自上海碧云天生物技术有限公司;其余试剂药品均为分析纯.
1.2 方法
1) 酵母最适密码子的优化.从NCBI数据库中获得人源Cu, Zn-SOD的CDS基因序列与人源EC-SOD的肝素结合结构域基因序列,利用密码子具有简并性的特点,通过毕赤酵母的密码子偏好性数据进行密码子优化,选取EcoR I和XbaI作为酶切位点,并使得GC含量在总序列中所占比例为40%~60%,将目的基因委托上海生物工程股份有限公司合成.
2) 真核表达载体pPICZaA-SOD-HBD的构建.将合成的目的基因与载体pPICZaA分别进行EcoR I和XbaI双酶切,通过试剂盒回收的目的基因片段与pPICZaA载体片段,再通过T4 DNA连接酶, 16 ℃过夜连接,构建表达载体pPICZaA-SOD-HBD.随后转化至E.coliDH5α中.抽提质粒并进行核酸测序与双酶切鉴定.
3) 表达菌株X33/pPICZaA-SOD-HBD的构建.将含有表达载体pPICZaA-SOD-HBD的E.coliDH5α的菌株进行高纯度质粒抽提,SacI酶切线性化,电转化至毕赤酵母X33表达菌株,菌落PCR鉴定重组菌,其中设计载体通用引物序列为: AOX 1上游引物5’-GACTGGTTCCAATTGACAAGC-3’,AOX 1下游引物5’-GGCAAATGGCATTCTGACATCCTC-3’.PCR设置条件为: 94 ℃ 预变性5 min;94 ℃ 30 s,56 ℃ 30 s,72 ℃ 1 min,扩增30个循环;补充延伸72 ℃ 10 min,4 ℃保存.鉴定成功的菌株选取工程菌命名为X33/pPICZaA-SOD-HBD.
4) 融合蛋白的诱导表达.挑取圆润饱满的单菌落接种于20 mL YPD液体培养基,30 ℃培养,直至OD600=2~6;将菌液以1.0%的体积分数接种到20 mL YP液体培养基,添加0.5%(体积分数,下同)甲醇进行诱导;30 ℃,200 r·min-1,培养3 d,每隔1 d取样并补加甲醇保持其浓度;10 400 r·min-1,离心2 min,制备发酵上清液,以未诱导的菌液作为对照,通过盐酸羟胺法[14]测定上清液的SOD酶活力,SDS-PAGE鉴定,从相对分子质量的角度进一步鉴定目的融合蛋白的表达.
5) 融合蛋白摇瓶诱导表达条件的优化.本研究对融合蛋白摇瓶诱导表达条件进行单因素优化实验.
① 诱导时间的优化: 将菌液以1.0%的体积分数接种到20 mL YP液体培养基中,添加0.5%甲醇进行诱导,30 ℃,200 r·min-1,将摇瓶诱导时间延长至7 d,每隔1 d取样1 mL并补加甲醇保持其浓度,10 400 r·min-1离心2 min,取上清液,于4 ℃保存.所有样品均进行SOD酶活力、蛋白含量的测定,SDS-PAGE电泳和NBT活性电泳[15]验证,每组3个平行实验.
② 诱导剂量的优化: 将菌液以1.0%的体积分数接种到20 mL YP液体培养基,甲醇诱导剂量各调至体积分数为0.5%、1.0%、1.5%、2.0%、2.5%,30 ℃,200 r·min-1,摇瓶诱导3 d,取样1 mL并补加甲醇保持其浓度,10 400 r·min-1离心2 min,取上清液,于4 ℃保存.进行SOD酶活力测定,SDS-PAGE电泳,每组3个平行实验.
③ 初始pH值的优化: 将菌液以1.0%的体积分数接种到20 mL YP液体培养基,将培养基的初始pH值调至4.8~5.8,添加0.5%甲醇进行诱导,30 ℃,200 r·min-1,摇瓶诱导3 d,取样1 mL并补加甲醇保持其浓度,各指标的测试同2),每组3个平行实验.
6) 融合蛋白摇瓶诱导表达条件的正交分析.设计3因素3水平的正交试验[16],分析诱导时间、诱导剂量和初始pH值对重组蛋白质表达水平的影响,以酶活为实验指标,使用盐酸羟胺法测定酶活.
7) 主要检测方法.
① 聚丙烯酰铵凝胶电泳(SDS-PAGE): 取1 mL菌液,10 400 r·min-1离心2 min收集上清.将上清与SDS-PAGE电泳上样处理液等体积混匀,沸水浴煮5 min.在分离胶质量浓度为0.125 g·mL-1、浓缩胶质量浓度为0.040 g·mL-1,电压120 V条件下进行电泳.电泳后以0.25%(质量分数)的R250考马斯亮蓝染色,最后置于脱色液中脱色至蛋白条带清晰.
② 非变性聚丙烯酰胺凝胶电泳(Native-PAGE): 具体操作步骤与SDS-PAGE电泳相似,区别在于所配置的凝胶、上样处理液及缓冲溶液均不含有SDS与巯基乙醇,且样品无需经过沸水浴处理.
③ 氯化硝基四氮唑蓝(NBT)法: 将上清液进行Native-PAGE,随后将凝胶通过NBT进行特异性染色[15].
1.3 数据统计与分析方法
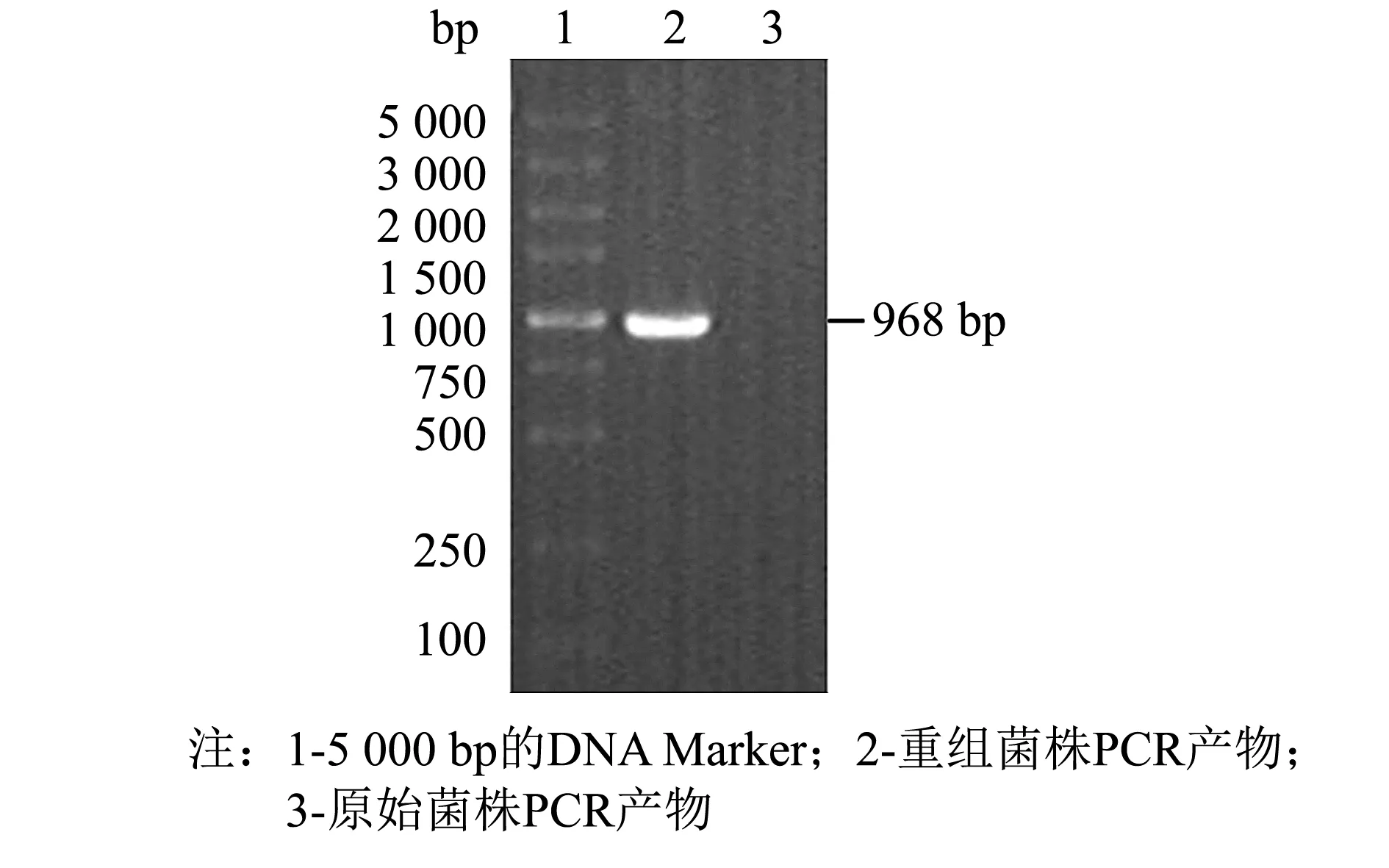
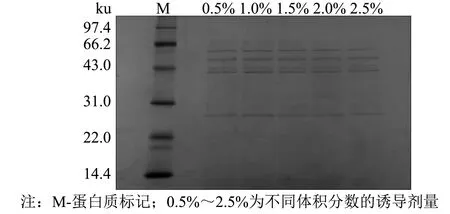
采用 SnapGene 4.0.2、Excel 2010、Origin 2019 64Bit、SPSS 24软件对数据进行处理分析,做载体图谱、序列比对及标准差等,结果以“平均数±标准误差(M±SD)”表示,以0.01 480 bp的目的基因SOD-HBD与3 526 bp的载体pPICZaA构建后的表达载体pPICZaA-SOD-HBD全长序列为4 016 bp.经过核酸测序,序列结果与预期一致,如图1所示.双酶切鉴定电泳图谱显现3.5 kb附近的载体片段和486 bp附近的目的片段,如图2所示.这些结果表明pPICZaA-SOD-HBD表达载体构建成功. 图1 pPICZaA-SOD-HBD载体构建图谱Fig.1 Construction of pPICZaA-SOD-HBD vector 图2 pPICZaA-SOD-HBD酶切鉴定结果Fig.2 Identification of pPICZaA-SOD-HBD by restriction enzyme pPICZaA-SOD-HBD线性化结果如图3所示,在4.0 kb左右出现明显的单一条带,表明SacI单酶切的质粒pPICZaA-SOD-HBD已经成功线性化.采用菌落PCR法对重组毕赤酵母菌株进行鉴定,结果如图4所示.PCR电泳图中重组菌株在1 000 bp左右出现明显条带,与预期的968 bp一致,对照组的原始毕赤酵母菌株未出现明显条带,表明pPICZaA-SOD-HBD已经成功转入到PichiapastorisX33表达菌株中. 图3 pPICZaA-SOD-HBD线性化结果Fig.3 Results of pPICZaA-SOD-HBD linearization 图4 X33/pPICZaA-SOD-HBD的PCR鉴定结果Fig.4 Identification of X33/pPICZaA-SOD-HBD by PCR 经甲醇诱导后,离心取得上清液,利用盐酸羟胺法测SOD酶活力筛选出酶活高的重组菌株,如图5所示,24号菌株中第6号菌株在摇瓶水平的酶活力达到381 U·mL-1,故选取第6号菌株进行后期实验. 甲醇诱导后的第6号菌株,取0~3 d的上清液进行SDS-PAGE电泳(见图6).由图6可见, 大约在25 ku处出现了明显的蛋白条带,而且条带从无到有颜色逐渐变深.该蛋白条带的相对分子质量范围与预期的蛋白理论相对分子质量相当.说明SOD-HBD融合蛋白很有可能成功在毕赤酵母中进行了分泌表达. 图5 重组菌株筛选结果(n=3) Fig.5 Screening results of recombinant strains (n=3) 图6 融合蛋白SOD-HBD的诱导表达 Fig.6 Induced expression of fusion protein SOD-HBD 2.4.1 诱导时间对融合蛋白表达量的影响 不同诱导时间下的SOD-HBD表达情况如图7所示,随着时间的延长,酶活与比活力均呈现先上升后下降的趋势,当诱导到第5天时酶活达到最高的1 072 U·mL-1,是初始酶活的2.81倍,且比活力为591 U·mg-1.可能的原因是菌体在诱导前期,为适应新的生存环境,前期分泌表达的外源蛋白较少.当逐渐适应该环境后,随着菌株不断的生长与繁殖,融合蛋白的表达量也会不断提高.但在诱导后期,细胞内的代谢废物等也会逐渐积累,同时伴随着菌株的衰退就会导致融合蛋白的表达量降低[17]. 不同诱导时间下的SOD-HBD电泳图如图8所示,随着诱导时间延长,蛋白电泳条带由浅到深,且在第5天时颜色最深,第5天后颜色逐渐变浅;与此同时,在相对分子质量25 ku左右的蛋白条带也呈现同样的趋势,与之前的酶活力变化趋势相对应. 图7 不同诱导时间下的SOD-HBD表达情况(n=3)Fig.7 SOD-HBD expression under different induction time (n=3) 图8 不同诱导时间下的SOD-HBD电泳图Fig.8 SOD-HBD electrophoretogram under different induction time NBT活性电泳染色图如图9所示,诱导了1~7 d的样品及市售SOD均出现明显的白色条带,而诱导0 d的样品未出现明显的蛋白条带,表明重组蛋白具有SOD特性;在SDS的作用下该重组蛋白仍然具有SOD特性,且可以看到白色条带在25 ku左右,如图10所示,符合预期的蛋白相对分子质量. 图9 NBT活性电泳染色图Fig.9 NBT reactive electrophoretic staining 图10 SDS-PAGE与NBT活性电泳相结合染色图Fig.10 SDS-PAGE combined with NBT active electrophoresis staining 2.4.2 甲醇诱导剂量对融合蛋白表达量的影响 当甲醇诱导剂量的体积分数达到1.0%时酶活力最高,为795 U·mL-1,是初始酶活的2.09倍, 如图11所示; 且如图12所示,诱导剂量的体积分数为1.0%时的蛋白条带浓度最深,说明甲醇可以诱导酵母进行蛋白的表达,但是酵母对甲醇的耐受性是有限的,所以甲醇浓度过低可能使蛋白表达不完全,浓度过高可能抑制了菌体的生长,从而影响外源蛋白无法长期持续表达[18]. 图11 不同诱导剂量下的酶活情况(n=3)Fig.11 Enzyme activity at different induced doses (n=3) 图12 不同诱导剂量下的蛋白电泳图Fig.12 Electrophoretic images of different induced doses of protein 2.4.3 培养基初始pH值对融合蛋白表达量的影响 培养基初始的pH值对微生物的繁殖与产物合成具有一定影响,调整不同的pH值对融合蛋白进行诱导,如图13所示,当培养基初始pH值调整为5.4时的酶活力最高,可以达到673 U·mL-1,提高了76.6%.如图14所示,初始pH=5.4时的条带浓度最深,表明过酸过碱会直接影响菌体的生长,导致菌体死亡而将蛋白酶释放,使得外源蛋白发生降解[13]. 图13 不同初始pH值下的酶活情况(n=3)Fig.13 Enzyme activity at different initial pH values (n=3) 图14 不同初始pH值下的蛋白电泳图Fig.14 Electrophoretic images of proteins at different initial pH values 2.4.4 融合蛋白表达条件的正交分析 为获得最适摇瓶表达条件,根据单因素实验结果,在3因素中选取3个水平, 设计正交实验,结果如表1~3所示. 表1 正交实验优化的因素及水平 表2 正交实验设计及直观比较结果 表3 方差分析结果 如表2所示,4号实验组酶活最高,可达1 120.2 U·mL-1,是初始酶活的2.94倍;正交实验的结果表明,各个因素对重组蛋白表达的影响次序依次为: 诱导时间>诱导剂量>初始pH值.最佳摇瓶条件为A2B1C2,即诱导时间为5 d,初始pH值为5.2,诱导剂量体积分数为1.0%. 根据表3所示的方差分析结果,表明诱导时间对重组蛋白的表达水平有显著性,初始pH值范围为5.2~5.6和诱导剂量的体积分数范围在0.5%~1.5%对重组蛋白的表达水平没有显著性. 本研究利用基因工程技术,成功构建出X33/pPICZaA-SOD-HBD表达菌株,并通过甲醇诱导筛选出酶活力达到381 U·mL-1的菌株.为进一步提高该融合蛋白的表达量,本研究进行了单因素与正交实验,单因素结果表明,诱导时间为第5天时酶活是初始酶活的2.81倍,比活力为591 U·mg-1,甲醇诱导剂量体积分数为1.0%时的酶活是初始酶活的2.09倍;当培养基初始pH值为5.4时酶活提高了76.6%.通过正交实验获得最佳摇瓶条件, 诱导时间为5 d,初始pH值为5.2,诱导剂量的体积分数为1.0%时,酶活可达到1 120.2 UmL-1,是初始酶活的2.94倍.总体而言,本研究提高了重组EC-SOD的蛋白表达水平,在一定程度上解决了其难提取且表达量低的问题,后期实验将进一步研究融合蛋白分离纯化和理化性质,为重组EC-SOD蛋白的推广与应用提供更多的理论依据与实践基础.2 结果与讨论
2.1 表达载体pPICZaA-SOD-HBD的构建

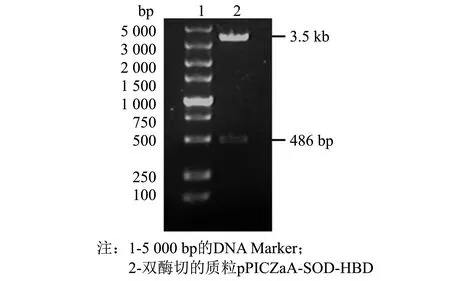
2.2 鉴定表达菌株X33/pPICZaA-SOD-HBD

2.3 融合蛋白的诱导表达


2.4 融合蛋白表达条件的探究










3 结语

