氟虫腈对意大利蜜蜂工蜂幼虫及幼龄工蜂的亚致死效应
李佳欢,齐素贞,吴黎明,黄少康,*
1. 福建农林大学动物科学学院(蜂学学院),福州 350000 2. 中国农业科学院蜜蜂研究所,北京 100093
蜜蜂(Apis)是一种对农业生产十分重要的授粉昆虫[1-2],同时蜜蜂生产的蜂蜜、蜂花粉、蜂王浆和蜂胶等蜂产品均是具有很高营养价值的绿色保健食品[3]。随着全球污染的日益加重,蜜蜂也遭受着环境污染带来的生存压力以及多种病虫害的侵袭,由此引发的蜂群崩溃综合症(Colony Collapse Disorder)在全球范围内引起了广泛关注[4-6]。在众多影响蜜蜂健康的因素中,杀虫剂的使用一直具有很大的争议。杀虫剂是重要的农业生产物质,是现代农业生产不可缺少的重要组成。自19世纪70年代以来,有机合成农药的迅速发展使得农药的种类和性质都发生了翻天覆地的变化,大量广泛施用农药造成了环境残留的问题,且有些药剂会污染植物的花粉和花蜜,导致蜜蜂暴露风险的增加[7]。
氟虫腈(fipronil)是苯基吡唑类的代表性杀虫剂,化学名称为5-氨基-1-(2,6-二氯-4,4,4-三氟甲基苯基)-4-三氟甲基亚硫酰基吡唑-3-腈。氟虫腈在水体和土壤中降解缓慢,半衰期较长[8],极易在环境及作物中蓄积[9]。鉴于氟虫腈的残留和环境风险,欧盟规定氟虫腈不得用于人类食品产业链的畜禽养殖,我国亦规定其在蔬菜中的最大残留限量(MRL)为0.02 mg·kg-1[10],且自2009年10月1日起,除卫生用、玉米等部分旱田种子包衣剂外全面限制使用氟虫腈[11]。虽然氟虫腈的使用量大幅降低,但近几年我国多地土壤及蔬菜中氟虫腈检出率依然较高(违禁农药不合格率中氟虫腈占比14.97%)[12],如重庆近郊农用地的部分普通白菜中氟虫腈的残留量达1.312 mg·kg-1[13],华南某市部分蔬菜基地土壤中氟虫腈的残留量最高可达33.09 mg·kg-1[14]。
氟虫腈以昆虫γ-氨基丁酸(GABA)受体为作用靶点,通过与GABA受体非竞争性结合,可以干扰受体门控氯离子通道,导致昆虫神经和肌肉过度兴奋而死亡[15]。由于这一特殊的作用机制,氟虫腈对甲壳类水生生物和蜜蜂具有极高风险。据报道,氟虫腈对蜜蜂剧毒,其对蜜蜂的急性经口半数致死剂量(LD50)为0.00383 μg·蜂-1[16],这种高致死作用可能是导致法国20世纪90年代蜜蜂大量死亡的重要原因[17]。除较高的急性致死毒性外,亚致死剂量的氟虫腈亦可显著影响蜜蜂的健康。研究发现8 μg·L-1的氟虫腈会引起工蜂癫痫、震颤和麻痹,运动能力下降,雄蜂生育能力下降[18-19];2.5 μg·L-1的氟虫腈还可影响蜜蜂咽下腺的形态以及蜜蜂肠道菌群多样性[20-21]。这些作用剂量低于环境中氟虫腈的残留水平,因此,环境残留水平上氟虫腈对蜜蜂的风险不容忽视。
蜜蜂是一种敏感的生物指示物,其不同发育阶段对污染物的响应可能不同,目前关于氟虫腈对蜜蜂幼虫和幼龄工蜂的毒性作用研究还很缺乏。因此,本研究以意大利蜜蜂幼虫和新出房成年工蜂为研究对象,采用人工饲喂的方法研究了亚致死剂量下氟虫腈对蜜蜂幼虫及工蜂的慢性毒性。结果发现,氟虫腈可显著干扰蜜蜂幼虫的发育,幼虫化蛹率显著降低、死亡率显著增高(P<0.05);幼龄工蜂对氟虫腈的耐受浓度相对较高,暴露7 d时各处理组中死亡率均较低(<20%),但当暴露时间延长至14 d时,高浓度(10 μg·L-1)处理组中蜜蜂死亡率高达(65.0±17.7)%,这说明氟虫腈对幼龄工蜂具有一定的时间累积毒性(time reinforced toxicity, TRT)效应。此外,本文还检测了整只幼虫及7 d、14 d时幼龄工蜂的头腹部组织的氧化应激酶超氧化物歧化酶(SOD)和过氧化氢酶(CAT)、解毒酶谷胱甘肽(GSH)和谷胱甘肽巯基转移酶(GST)及乙酰胆碱酯酶(AChE)活性的变化,结果表明在本研究条件下,氟虫腈在低暴露剂量下即可显著干扰蜜蜂幼虫和成蜂机体稳态,引发显著的氧化损伤和神经毒性。本研究一方面补充了亚致死剂量下氟虫腈对蜜蜂幼虫和成蜂风险评估数据的不足,另一方面可为未来指导氟虫腈的安全使用和管理制定提供参考。此外,本研究也揭示了蜜蜂不同发育阶段对农药的敏感性差异,未来可为不同作用机理、不同施用方式的农药或环境污染物制定特异的风险评估模型,提高风险评估工作的精准化。
1 材料与方法(Materials and methods)
1.1 供试生物与试剂
意大利蜜蜂(Apismelliferaligustica)由中国农业科学院蜜蜂研究所蜂场提供。氟虫腈原药(97%纯度)购自海利尔药业集团股份有限公司,色谱纯级丙酮购自赛默飞世尔科技(中国)有限公司,葡萄糖和果糖购自上海玉博生物科技有限公司,酵母提取物购自英国OXOID公司,水为娃哈哈纯净水,121 ℃湿热灭菌后使用;Bradford蛋白浓度测定试剂盒(P006)购自上海碧云天生物技术有限公司;酶活力测定试剂盒均购自南京建成生物工程研究所。
1.2 氟虫腈暴露浓度的设置
据文献报道,氟虫腈对意大利蜜蜂的48 h-LD50为0.00383 μg·蜂-1。结合预实验结果,本研究中蜜蜂幼虫的氟虫腈暴露浓度为10-3、10-2、0.1、1和10 μg·L-1;成蜂的暴露浓度为1、5和10 μg·L-1。
药液配制:以丙酮为溶剂,配制浓度为1 000 mg·L-1的氟虫腈储备液。以蜜蜂幼虫人工配方饲料为稀释剂,配制含氟虫腈浓度为10-3、10-2、0.1、1和10 μg·L-1的幼虫试验饲料;以50%蔗糖溶液为稀释溶剂,配制氟虫腈浓度分别为1、5和10 μg·L-1成蜂试验药液;以不含丙酮和不含氟虫腈的幼虫饲料或50%蔗糖溶液为空白对照。
1.3 蜜蜂幼虫的暴露与培养
幼虫暴露处理参照经济合作与发展组织(OECD)颁布的OECD 237准则、中华人民共和国农业行业标准(NY/T 3085—2017)和本实验室已发表的方法进行[22-23]。简言之试验开始3 d前,将隔王板放入实验蜂群,并在隔王板间放入一张空蜂脾,随后将蜂王移入并限制其在空脾上产卵12 h;控王产卵结束后,将蜂王移出,隔王板和卵脾保持在蜂箱内待卵孵化。3 d后,蜂卵孵化为1日龄(d)幼虫,实验开始。将1 d幼虫转移至预先准备好的每孔含20 μL人工饲料的48孔板中,并在人工培养箱中(35 ℃±1 ℃,相对湿度95%)培养,2 d时不饲喂,3 d时剔除死亡幼虫,将同批次备用健康幼虫补入并饲喂20 μL含氟虫腈的饲料;随后在第4、5和6天时分别饲喂每只幼虫30、40和50 μL含氟虫腈的幼虫饲料。实验设置3个蜂群,每16只幼虫来自一个蜂群,设为一个重复,每个暴露浓度设置3个重复,共计48只幼虫。
在饲喂期间每天记录幼虫死亡数,以移虫针轻触幼虫,幼虫不动则认为死亡。试验开始后的第7天,停止饲喂,第8天时将其转移至24孔板中化蛹,每天检查蛹的死亡和发育情况,更换无菌纸,保证洁净化蛹环境,统计幼虫最终的化蛹率和羽化率。重复此实验,在第8天时收集幼虫样本,经pH 7.4磷酸盐缓冲液(PBS)溶液润洗擦干后,-80 ℃冷冻保存待后续生化指标分析。
1.4 新出房工蜂的暴露与培养
暴露开始前,将蜂群中待出房的封盖子脾转移至人工培养箱中(35 ℃±1 ℃,相对湿度50%)羽化。工蜂出房后24 h内,将其转移至贮蜂笼内。每笼20只幼龄工蜂,饥饿2 h后饲喂50%蔗糖溶液(空白对照)或含不同浓度的氟虫腈试验药液(处理组)。饲喂剂量为1 mL·笼-1·天-1,每天更换试验药液并观察记录蜜蜂死亡情况。每笼为一个重复,每个试验浓度设置3个重复。新出房工蜂设置2个时间处理,一组饲喂7 d后收集每笼中的蜜蜂头部(整只头)和腹部(整只腹部)组织,一组饲喂14 d后收集,样品-80 ℃冷冻保存待后续分析。
1.5 酶活力的检测
蜜蜂组织粗酶液的制备和生化指标检测参照各试剂盒说明书进行。首先准确称取蜜蜂组织样品质量,按试剂盒要求加入与质量相对应体积的样品提取液或生理盐水,然后置于冰上研磨,破碎匀浆后4500 r·min-1离心10 min,取上清液转移至新的离心管中。采用Bradford蛋白测定试剂盒制备蛋白标准溶液,酶标仪(Spectra Max i3,美谷分子仪器(上海)有限公司,中国)测定蛋白标准溶液和样品吸收值,绘制蛋白浓度标准曲线并计算样品蛋白浓度;随后根据各试剂盒方法测定目标酶活力或产物的含量变化。具体方法可参考本实验室已发表的文章[24]。每个浓度组3个样品处理,每个样品重复测定3次。
1.6 数据处理
各检测指标结果均以平均值±标准差(Mean±SD)表示,采用Graphpad prism 7.0软件进行单因素方差分析(One-way ANOVA),结合Tukey’s HSD检验比较处理组与对照组之间的显著性差异,各处理组间生存曲线的显著性差异分析采用Graphpad prism 7.0软件中log-rank(Mantel-Cox)test模型进行。文中*表示P<0.05,**表示P<0.01,差异显著。
2 结果(Results)
2.1 氟虫腈对蜜蜂幼虫发育的影响
氟虫腈可显著影响蜜蜂幼虫的发育和死亡。空白对照组中幼虫的平均死亡率为(22.92±2.95)%,略高于OECD 237准则的要求,但根据文献报道,当观测化合物效应浓度范围时,蜜蜂幼虫人工饲养对照死亡率可适当放宽至20%~25%,故本研究中的幼虫实验仍在可接受范围内[25-26]。由图1(a)可知,氟虫腈可显著增加幼虫的死亡率,在设定的10-3、10-2、0.1、1和10 μg·L-1处理组中,幼虫的死亡率比对照组显著增加22.92%~47.92%(P<0.05),但在蛹期阶段氟虫腈处理组中的死亡率与对照组无显著差异。幼虫死亡率的增高导致其化蛹率和羽化率显著降低,且与对照组差异显著(P<0.05)(图1(b))。

图1 氟虫腈对蜜蜂幼虫死亡(a)和发育(b)的影响注:(a)图中灰色部分为幼虫死亡率,白色部分为蛹期死亡率,每个柱形图代表幼虫和蛹期的死亡率累积之和,其中*代表对照组 与处理组之间幼虫死亡率差异显著;字母a、b代表对照组与处理组之间幼虫和蛹的总死亡率之和差异显著; 对照组与处理组之间蛹期死亡率差异不显著,未标记。Fig. 1 Effect of fipronil on death (a) and development (b) of honeybee larvaeNote: In Figure (a), the gray part is the larvae mortality rate, while the white part is the pupal mortality rate; each column represents the cumulative sum of the larvae and pupal mortality rates, in which *represents the significant difference in the larvae mortality rate between the control group and the treatment group; the letters a and b represent the significant difference in the sum of the total mortality of larvae and pupae between the control group and the treatment groups; there was no significant difference in pupa stage mortality between the control group and the treatment groups.
2.2 氟虫腈对蜜蜂幼虫酶活力的影响
亚致死剂量的氟虫腈可显著诱导蜜蜂幼虫体内的氧化应激反应。由图2可知,氟虫腈各处理组中的SOD酶活力与对照组相比无显著差异,而CAT酶活力则显著高于对照组(202.49±8.95) U·g-1protein (P<0.05),且随氟虫腈暴露浓度增加而增加(图2(b))。丙二醛(MDA)是脂质过氧化反应的终端产物,在空白对照组中其含量为(0.47±0.08) nmol·mg-1protein,在10-3μg·L-1氟虫腈暴露组中,MDA含量显著下降至0.1 nmol·mg-1protein(P<0.0001),而在0.1 μg·L-1和1 μg·L-1处理组中其含量显著升高至0.79 nmol·mg-1protein和0.95 nmol·mg-1protein,与对照组相比差异显著(P<0.01) (图2(c))。
GSH含量变化(图2(d))与CAT变化相似,在低浓度10-3μg·L-1和10-2μg·L-1处理组中,GSH含量与对照组(84.97±2.83) μmol·g-1protein相比无显著差异,但在0.1 μg·L-1和1 μg·L-1组中GSH含量显著升高,最高含量为(150.00±6.75) μmol·g-1protein(P<0.0001)。GST酶活力变化与其他指标变化不同,所有氟虫腈处理组中的GST酶活力均显著低于对照组(69.95±1.82) U·mg-1protein (P<0.01),但各个处理组间的GST酶活力维持在相近水平(图2(e))。
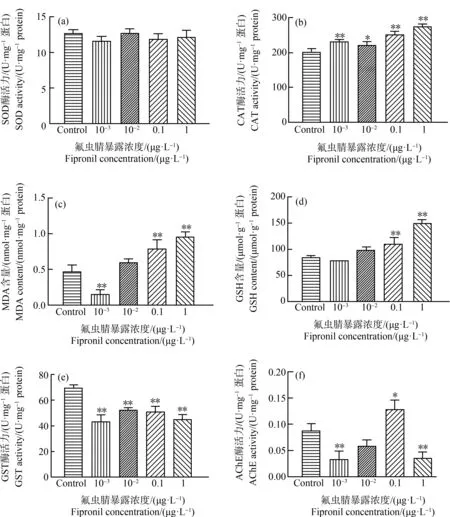
图2 氟虫腈对蜜蜂幼虫酶活力的影响注:SOD表示超氧化物歧化酶,CAT表示过氧化氢酶,MDA表示丙二醛,GSH表示谷胱甘肽,GST表示谷胱甘肽转移酶, AChE表示乙酰胆碱酯酶;*表示P<0.05,**表示P<0.01,与对照组相比。Fig. 2 Effects of fipronil on enzyme activities in bee larvaeNote: SOD means superoxide dismutase; CAT means catalase; MDA means malondialdehyde; GSH means glutathione; GST means glutathione transferase; AChE means acetylcholinesterase; *indicates P<0.05, **indicates P<0.05, compared with the control.
对照组中蜜蜂幼虫的AChE活力为(0.09±0.01) U·mg-1protein,经氟虫腈暴露8 d后,AChE活力在10-3μg·L-1和1 μg·L-1组中显著下降61.4%和58.7% (P<0.01),在10-2μg·L-1组中变化不显著,但在0.1 μg·L-1处理组中比对照组升高1.6倍(P=0.0122)。
2.3 氟虫腈对幼龄工蜂的影响
氟虫腈对幼龄工蜂生存的影响结果如图3所示。在暴露期间,对照组蜜蜂在7 d和14 d时的累积死亡率均<10%,满足化合物对蜜蜂毒性测定的要求。氟虫腈处理组中,暴露7 d时,1 μg·L-1和5 μg·L-1处理组中的死亡率<10%,10 μg·L-1处理组中的死亡率<20%;1 μg·L-1和5 μg·L-1处理组中幼龄工蜂的死亡率有所增加,但仍<20%,而10 μg·L-1处理组中幼龄工蜂的死亡率显著增至(65.0±17.7)%,与处理组相比差异显著(P<0.0001)。
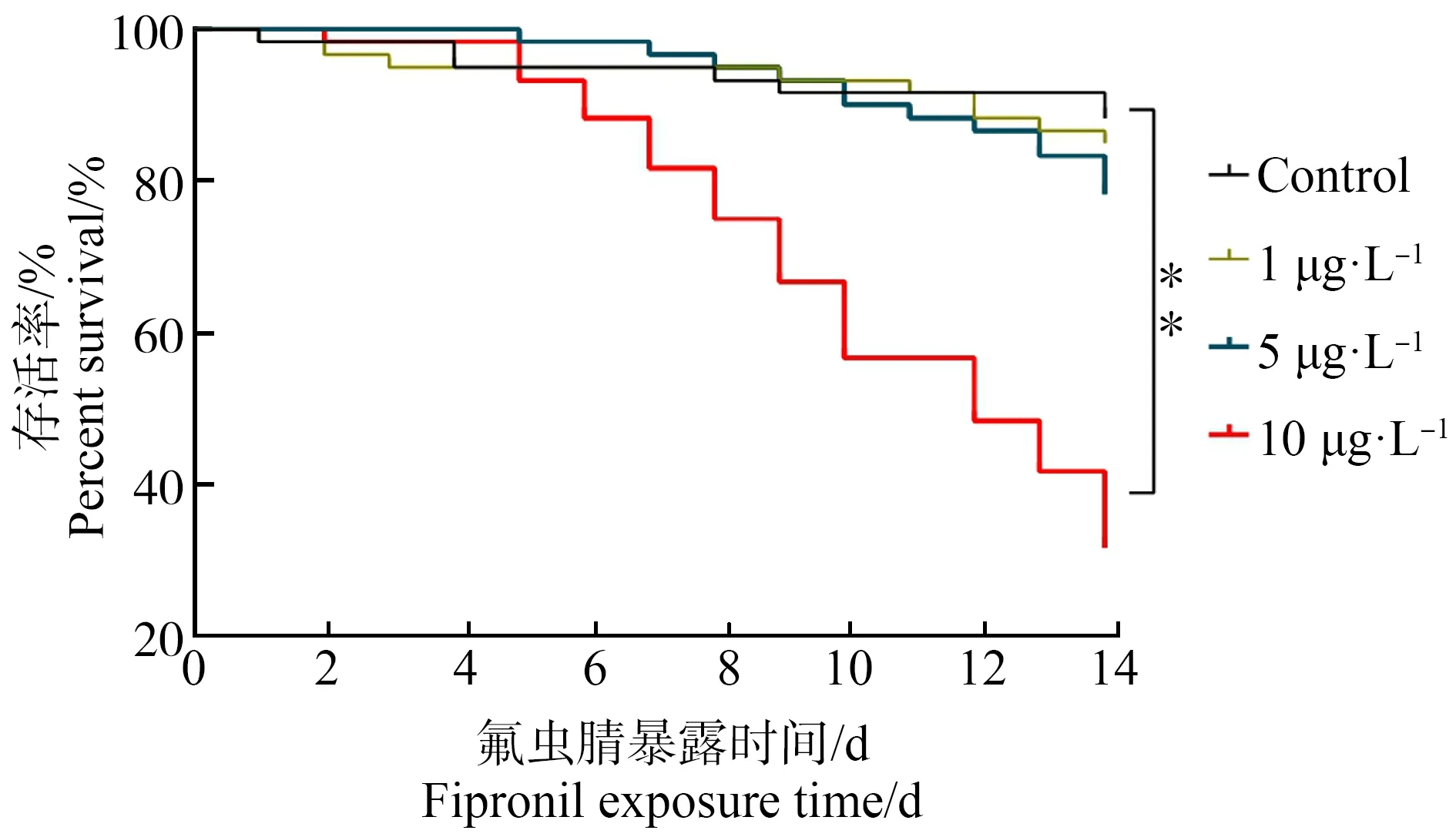
图3 氟虫腈对幼龄工蜂存活率的影响注:**表示P<0.01,与对照组相比。Fig. 3 Effect of fipronil on the survival rate of young adult beesNote:**indicates P<0.01, compared with the control.
与幼虫相似,SOD对氟虫腈反应不敏感,氟虫腈暴露7 d和14 d后,幼龄工蜂腹部SOD活力与对照组相比无显著变化(图4(a))。CAT酶活力(图4(b))在暴露7 d时变化趋势不固定,相比于对照组(110.13±8.96) U·g-1protein,在1 μg·L-1处理组中CAT活力显著上升至(132.80±4.27) U·g-1protein(P=0.0125),但在5 μg·L-1处理组中CAT酶活力显著下降至(85.37±8.42) U·g-1protein(P=0.0077),而10 μg·L-1处理组中的CAT活力为(118.80±6.28) U·g-1protein,与对照组相比差异不显著。当暴露时间持续到14 d时,对照组中CAT酶活力为(93.00±6.40) U·g-1protein,而氟虫腈各处理组中的CAT酶活力则随暴露浓度的增加显著下降了17.6%、12.2%和87.2%(P<0.05)。
GST活力在7 d和14 d的对照组中分别为(76.68±1.78) U·mg-1protein和(92.09±8.29) U·mg-1protein,在氟虫腈暴露期间,各处理组中的GST酶活力均低于对照水平(图4(c))。GSH含量在暴露7 d时无显著变化;在暴露14 d时则呈现显著的下降趋势,1 μg·L-1与10 μg·L-1处理组中GSH含量分别为(47.41±4.66) μmol·g-1protein、(41.73±3.42) μmol·g-1protein,与对照组相比(62.82±2.69) μmol·g-1protein分别显著降低了32.5%、50.5%(P<0.05)(图4(d))。
氟虫腈暴露7 d和14 d时,成蜂腹部MDA含量在低浓度处理组(1 μg·L-1和5 μg·L-1)中变化均不显著。在高浓度10 μg·L-1处理组中,MDA含量在7 d时为(1.33±0.17) nmol·mg-1protein,显著低于对照组(1.91±0.15) nmol·mg-1protein,降低了30.4%(P=0.0073);14 d时,MDA含量为(2.87±0.30) nmol·mg-1protein,相比对照组MDA含量(2.07±0.22) nmol·mg-1protein,显著升高了38.4%(P=0.0113)(图4(e))。
3 讨论(Discussion)
蜜蜂是非常重要的授粉昆虫,在农业生产和生态环境安全中发挥着重要作用,蜜蜂的减少会严重影响各种作物的产量和生态多样性,因此对包含农药在内的多种环境污染物进行全面的风险评价不仅可以预防其对蜜蜂造成较大的损害,更可以为农药的使用、污染物的治理等提供参考和依据[27]。
3.1 亚致死剂量氟虫腈对蜜蜂存在生存风险
氟虫腈与新烟碱类杀虫剂具有相似的化学结构、作用机制和毒性作用,在2015年时,二者销售份额占全球杀虫剂市场的1/3[28]。氟虫腈对蜜蜂的生存风险已多有报道,Holder等[17]通过室内生物测定结合蜂群模拟实验发现氟虫腈可以导致蜜蜂大量死亡,且具有TRT效应,相比于吡虫啉等新烟碱类杀虫剂,氟虫腈对蜜蜂的风险更高,导致蜂群死亡的可能性更大。本研究中发现在10 μg·L-1剂量下,氟虫腈暴露7 d不会引发显著的蜜蜂死亡,但当暴露时间延长至14 d时,蜜蜂死亡率显著增加,这也在一定程度上证明了氟虫腈的TRT效应。氟虫腈所引发的蜜蜂高死亡率与其作用机理密切相关。氟虫腈作用于GABA受体,可影响昆虫大脑的重要结构,Jacob等[29]利用光学显微镜和透射电镜观察了不同剂量氟虫腈对无刺蜂(Scaptotrigonapostica)原脑蘑菇体肯氏细胞(Kenyon cells)形态的影响,发现经口摄入剂量低至0.24 ng a.i.·μL-1、局部接触剂量低至0.27 ng a.i.·bee-1时均可观察到固缩肯氏细胞(细胞凋亡)数量的增加,说明氟虫腈可激发显著的神经细胞损伤。氟虫腈对蜜蜂繁殖和行为的影响是导致蜜蜂死亡的另一重要因素。El Hassani等[30]在室内条件下评估了亚致死剂量氟虫腈对蜜蜂行为的影响,发现1 ng·蜂-1的剂量处理1 h后即可显著降低蜜蜂的蔗糖敏感性,0.5 ng·蜂-1的剂量则可干扰蜜蜂的嗅觉记忆。Kairo等[31]研究发现0.1 μg·L-1氟虫腈可以影响蜜蜂雄蜂的生育能力,降低蜂王的繁殖力,影响下一代蜂卵的质量和发育。Zaluski等[18]发现致死或亚致死剂量的氟虫腈可导致蜜蜂运动行为显著减少,且当蜂群暴露于氟虫腈时,孵化卵的数量、工蜂卵所占的面积以及发育的幼虫和蛹的数量都有降低,这也证明了氟虫腈对蜜蜂幼虫的高风险性。Silva Cruz等[32]观察了氟虫腈处理下蜜蜂幼虫肠道形态的变化,发现氟虫腈处理组中大多数的幼虫会出现中肠细胞质中的空泡消失,染色质压实的现象。目前关于氟虫腈对蜜蜂幼虫的直接毒性评价还很少,本研究发现亚致死剂量的氟虫腈对蜜蜂幼虫存在较高的生存风险,其可显著降低幼虫化蛹率和羽化率,导致发育失败。

图4 氟虫腈暴露后幼龄工蜂腹部组织酶活力变化注:*表示P<0.05,**表示P<0.01,与对照组相比。Fig. 4 Enzyme activity changes in abdomen of the young adult bees after exposure to fipronilNote:*indicates P<0.05, **indicates P<0.01, compared with the control.
综合文献报道和本研究中的结果可知,氟虫腈在μg或ng水平即可引发显著的蜜蜂生存风险,而据报道,氟虫腈在水稻田地表水中的检出浓度不低于9 μg·L-1,在居民区地表水中的检出浓度则高达12.6 μg·L-1[33-34]。在巴西,农药的使用量和蜂群损失量一直居高不下,Castilhos等[35]随机采集并测定了中毒非洲化蜜蜂体内的氟虫腈和新烟碱类杀虫剂的残留情况,发现氟虫腈的检出率高达为55.3%,检出剂量为0.7~23 ng·g-1蜜蜂,最高可达539.7 ng·g-1蜜蜂。这些都说明环境中残留氟虫腈对蜜蜂仍存在很高风险,结合文献和本文中的研究结果,氟虫腈对蜜蜂的安全性低,在亚致死剂量下即可显著干扰蜜蜂幼虫发育和成蜂生存,因此在很长一段时间内都不应忽视氟虫腈残留对蜜蜂的风险。
3.2 亚致死量氟虫腈诱导蜜蜂氧化胁迫
氧化胁迫是生物体对抗外源胁迫时产生的一种常见反应,在维持生物体体内稳态方面发挥着重要作用[36]。Wang等[37]对氟虫腈引起的氧化损伤和代谢机理进行了详细的综述,整理发现氟虫腈在多种生物体内/体外均可引起的显著的氧化压力,增加活性氧自由基(ROS)或活性氮自由基(RNS)的生成、引发线粒体损伤,干扰ERK、JNK和AKT等代谢通路,导致更严重的DNA、脂质和蛋白等大分子的过氧化和损伤。本研究中,蜜蜂幼虫和幼龄工蜂体内SOD和CAT酶活力、MDA含量发生显著变化,说明亚致死剂量氟虫腈可诱导蜜蜂氧化应激反应。但是SOD在蜜蜂幼虫和成蜂中的变化均不显著,这说明SOD对氟虫腈引发的氧化压力不敏感,可能不是监测氟虫腈氧化胁迫的灵敏指标。
值得注意的是,蜜蜂幼虫或成蜂体内各酶活力或产物含量变化与氟虫腈暴露时间/剂量的效应关系并不十分明确,如在成蜂暴露体系中,CAT酶活力在暴露7 d时整体呈现上升趋势而14 d则呈下降趋势;MDA含量在低浓度时无显著变化,但在高浓度10 μg·L-1处理组中,暴露7 d时MDA含量显著低于对照组,而14 d时显著高于对照组。这可能与蜜蜂对外界胁迫的时间适应机制相关。Chakrabarti等[38]发现氟吡呋喃酮可显著增加蜜蜂体内ROS/RNS的浓度,但蜜蜂暴露10 d时体内ROS/RNS浓度显著低于暴露6 h时的浓度水平,说明蜜蜂在长期接触外源毒性物质时可自发调节自身生理反应,缓解其带来的危害,但对于毒性较高的化合物或当暴露时间足够长时,蜜蜂的这种适应机制仍然不能达到保护自身的目的。Mulvey和Cresswell[39]研究了吡虫啉、噻虫嗪和氟虫腈对熊蜂的时间依赖毒性,发现氟虫腈不易被降解、排出体外,对熊峰的生存具有显著的剂量效应关系和很强的TRT效应,噻虫嗪与氟虫腈作用相似但TRT效应中等,而吡虫啉仅在最高浓度处理组中出现死亡和TRT效应。Simon-Delso等[40]亦发现了啶酰菌胺对蜜蜂的TRT效应,推测这可能是由于蜜蜂长期接触毒性物质,导致体质变弱,降低了处理有毒物质的能力。我们之前的研究发现氟氯苯氰菊酯暴露对蜜蜂也具有相似的时间效应[41],因此建议未来应加强对环境浓度下农药或其他环境污染物对蜜蜂在个体及群体上的时间-依赖风险评估,尤其是低剂量的长期暴露风险,建立相应风险阈值,降低化合物对蜜蜂等授粉昆虫的影响。
3.3 亚致死剂量氟虫腈激活蜜蜂解毒反应
蜜蜂对外源物的解毒方式主要包括细胞色素P450s、羧酸酯酶(carboxylesterases)、GST和药物转运蛋白4个途径[42],其中GST是昆虫体内常见的解毒酶,通过催化GSH与环氧化合物结合,可以促进大量被细胞色素P450家族氧化的化合物的二次代谢,转化多种内源性和外源性化合物,包括除草剂和杀虫剂等[43]。本研究中,氟虫腈暴露处理的幼虫体内GST酶活力均显著低于对照组,与此相对应的,GSH在幼虫体内的含量随氟虫腈暴露浓度的上升而逐渐上升;成蜂体内GST酶活力在氟虫腈处理组中亦显著低于对照组,但GSH含量变化在暴露7 d时不显著,在暴露14 d后GSH的含量开始随氟虫腈浓度的增加而逐渐下降;由此推测GST介导了氟虫腈在蜜蜂体内的降解代谢。本研究结果与Nielsen等[44]的报道相似,Nielsen等[44]测定了氟氯苯氰菊酯对不同阶段蜜蜂解毒酶的影响,发现氟氯苯氰菊酯暴露可显著增加蜜蜂幼虫和蛹期的GST活力,但在采集蜂内GST活力显著降低。此外,Smirle[45]早在1993年就发现幼龄工蜂所具有的解毒酶特异性低,导致了幼龄工蜂对各种环境氧化物更敏感。值得注意的是,与其他昆虫相比,西方蜜蜂基因组中解毒和免疫基因数量相对较少[42,46],以GST为例,西方蜜蜂体内仅含有10个GST相关功能基因,且主要为σ类型,解毒能力的不足也是导致蜜蜂对外源物敏感的一个重要原因。氟虫腈诱导的GST和GSH变化也证明了二者在蜜蜂应对外界胁迫时发挥着积极的保护作用。
3.4 亚致死量氟虫腈影响蜜蜂AChE活力
AChE是评价神经毒性化合物的常用指标[47]。本研究中蜜蜂幼虫和成蜂头部AChE活力显著降低,再次证明了氟虫腈对蜜蜂的神经毒性。Roat等[48]以10 pg氟虫腈·蜂-1的剂量饲喂非洲化蜜蜂5 d,发现氟虫腈会导致幼龄工蜂脑部某些蛋白质表达模式的改变,造成神经化学压力,神经元蛋白质发生错误折叠,细胞凋亡率升高,损害突触形成,大脑发生退化,导致记忆和学习功能障碍。但Carvalho等[49]发现氟虫腈暴露48 h后不会影响蜜蜂头部的AChE活力,造成这种差异的原因可能是由于氟虫腈的作用靶标是GABA受体,短时间暴露时可能不会诱导AChE活力变化,而当暴露时间较长时,蜜蜂受到的神经损伤较重,可通过AChE活力变化表现出来。据报道,多种农药可影响蜜蜂AChE活力,如吡虫啉、噻虫胺和高灭磷等,进而影响蜜蜂正常的生理功能,导致蜂群崩溃死亡[50-52]。
昆虫AChE是杀虫剂的重要靶标之一,其突变及表达量的变化均是导致昆虫产生抗药性的主要原因[53-54]。昆虫具有2个AChE基因,其在不同季节、昆虫不同组织内表达不同,且功能不同,在头部AChE主要承担水解神经递质等催化功能,而在其他组织内可能具有与催化作用无关的生理功能[55]。Kim等[56]对蜜蜂AChE基因表达量和表达部位测定时发现,AChE1主要在蜜蜂头部和腹部表达且表达量高于AChE2,最高表达量出现在春冬季节,AChE2表达量随季节变化不明显,在一年各月份中均可表达。此外,不同分工蜜蜂体内的AChE分布不同,Shapira等[57]研究发现采集蜂头部AChE活力显著低于内勤蜂,这也可能是采集蜂对农药敏感性较高的原因之一。本研究中仅针对蜜蜂幼虫和幼龄工蜂头部AChE的活力进行了测定,未来可针对不同季节、不同日龄、不同级型和不同蜜蜂组织AChE进行监测,探索其在蜜蜂中毒预警中应用的可能。
综合本研究的发现可知,亚致死剂量的氟虫腈对蜜蜂幼虫和幼龄工蜂均可产生显著的影响,且这种影响会随着暴露浓度和时间的延长而加剧,对蜜蜂健康造成的更大的风险。为避免蜂群接触到高残留剂量的氟虫腈,应严格遵守用药规定和蜂群管理措施,尽可能的保证蜂群中各个级型蜜蜂的健康。除农业生产外,氟虫腈亦是一种重要的卫生杀虫剂,可以杀灭跳蚤、螨和虱等卫生害虫,氟虫腈被世界卫生组织列为“对人类有中等毒性”的化合物,在环境或生物体内代谢产生氟甲腈、氟虫腈硫醚和氟虫腈砜3种代谢物,而这3种代谢物的毒性要高于氟虫腈原药[58]。鉴于氟虫腈的使用特点和对蜜蜂的高风险性,未来的研究一方面可以围绕环境中氟虫腈代谢产物是否对蜜蜂存在暴露风险开展,另一方面可以通过新型生理指标(肠道菌群、基因表达和代谢组学变化等)的应用进一步评价氟虫腈单一或与其他药物协同作用时对蜜蜂的毒性作用。

