微塑料与有毒污染物相互作用及联合毒性作用研究进展
赵美静,夏斌,朱琳,#,孙雪梅,赵信国,戴伟,陈碧鹃,曲克明
1. 天津农学院水产学院,天津 300384 2. 农业部海洋渔业资源可持续发展重点实验室,山东省渔业资源与生态环境重点实验室,中国水产科学研究院黄海水产研究所,青岛 266071 3. 青岛海洋科学与技术试点国家实验室海洋生态与环境科学功能实验室,青岛 266237
海洋塑料污染已成为当今全球性的重大环境问题。塑料因具有耐用、防水、质轻、价廉等优点,被广泛应用于生产和日常生活中。据统计,2019年全球塑料产量高达3.68亿t[1]。然而,数量庞大的塑料垃圾进入到海洋环境中,预计到2025年,全球海洋中的塑料垃圾量将高达2.5亿t[2]。在海洋生态系统中,这些塑料垃圾在机械作用、光辐射和生物降解等过程中逐渐破碎分解成小的塑料微粒[3],其中尺寸<5 mm的塑料微粒被称为微塑料(microplastics, MPs)[4],普遍存在于全球范围内的海水、沉积物和海洋生物中[5]。微塑料的体积小、比表面积大,可被多种海洋生物摄食,并对其产生毒性效应。微塑料的大比表面积有助于吸附环境中的有毒污染物,如多溴联苯醚(poly brominated diphenyl ethers, PBDEs)、多环芳烃(polycyclic aromatic hydrocarbons, PAHs)、多氯联苯(polychlorinated biphenyls, PCBs)和重金属等。因此,微塑料可能作为载体携带有毒污染物进入生物体,并在生物体内累积。此外,塑料本身被掺入了各种添加剂(如双酚A、溴化阻燃剂、邻苯二甲酸酯和三氯生等),这些添加剂会渗入水环境,对水生生物产生内分泌干扰、致癌或致突变作用等[6]。由此可知,微塑料不仅会对海洋生物构成直接威胁,而且还会通过吸附或释放有毒污染物对海洋生物造成间接威胁。
微塑料在海洋环境中普遍存在,可以作为“载体”运输和传送多种有毒污染物,但人们对微塑料和有毒污染物的联合毒性及其机制了解的相对较少。本文首先归纳了微塑料对海洋生物的毒性效应及其致毒机制;然后总结了微塑料与有机污染物、重金属及纳米颗粒的联合毒性效应,分别从微塑料对有毒污染物的吸附、富集和载体效应,以及微塑料增强或抑制有毒污染物的毒性及其机制两大方面进行探讨(图1);最后对目前研究的不足及未来的研究方向进行展望和建议。
1 微塑料对海洋生物的毒性效应及机制(Toxic effects and mechanisms of microplastics on marine organisms)
近年来,有关微塑料对海洋生物的毒性效应受到越来越多的关注。目前,研究发现微塑料对浮游植物[7-9]、浮游动物[10-11]、底栖生物[12-13]以及鱼类[14-15]等都表现出一定的生物毒性效应,其毒性影响主要集中在以下几个方面。(1)遮蔽效应:悬浮在水中的微塑料可以降低水体的透光性,而附着在藻细胞表面的微塑料也可以产生遮蔽效应。微塑料能够包裹在海洋尖尾藻(Oxyrrhismarina)和中肋骨条藻(Skeletonemacostatum)细胞表面,导致藻细胞吸收的光能减少,叶绿素含量降低、光合效率下降,从而影响了微藻光合作用的正常进行[7-9]。(2)氧化应激:微塑料还会诱导海洋生物体内的氧化应激状态,导致超氧化物歧化酶(superoxide dismutase, SOD)、过氧化氢酶(catalase, CAT)等抗氧化酶活性的增加[16],细胞内积累过量的活性氧(reactive oxygen species,ROS)[17-18],并产生脂质过氧化[16]。(3)免疫毒性:单次和重复暴露微塑料均能够引发地中海贻贝(Mytilusgalloprovincialis)的免疫系统调节和稳态改变,诱导应激和免疫相关蛋白的产生,更多的能量被用于免疫调节,使得分配给生长的能量减少[19]。暴露于聚苯乙烯(polystyrene, PS)微塑料后,泥蚶(Tegillarcagranosa)体内的具有免疫活性的红细胞数量和比例下降,血细胞对外源物质的识别、吞噬和降解被限制,与免疫、Ca2+信号和凋亡相关的分子通路被阻断,微塑料可能通过一系列相互依存的生理和分子过程阻碍血蛤的免疫反应[20]。(4)生殖毒性:PS纳米塑料对太平洋牡蛎(Crassostreagigas)的早期生活史阶段(受精、胚胎发生和变态)产生不利影响,显著降低了受精成功率、延缓了胚胎幼体发育过程并诱导出现大量畸形个体[13]。(5)遗传毒性:将日本虎斑猛水蚤(Tigriopusjaponicus)无节幼体连续暴露在微塑料环境中超过2个世代,不仅F0代的死亡率增加,其产生的F1代无节幼体的死亡率也出现升高[21]。(6)神经毒性:将斧蛤(Donaxtrunculus)暴露于聚乙烯(polyethylene, PE)和聚丙烯(polypropylene, PP)微塑料混合物中,鳃、消化腺和蛤肉中的乙酰胆碱酯酶(acetylcholinesterase, AChE)活性被抑制,这表明微塑料混合物诱导了斧蛤体内的神经信号传导紊乱[22]。PS微塑料暴露后泥蚶体内3种重要神经递质(γ-氨基丁酸(GABA)、多巴胺(DA)和乙酰胆碱(ACh))含量增加,但是编码这些神经递质的调节酶和受体的基因表达减少,表明微塑料对泥蚶有明显的神经毒性[23]。(7)行为毒性:PS微塑料暴露后,许氏平鮋的摄食活性、游泳速度和活动范围出现下降[15];类似地,海洋桡足类动物海岛哲水蚤(Calanushelgolandicus)对饵料藻细胞的摄食率也出现减少[11],动物摄食行为的减少以及摄食量的降低会导致自身的能量供给不足。综上所述,不同营养级的生物个体对微塑料表现出不同的生理响应,可能会对海洋生态系统的结构与功能带来诸多生态风险。

图1 微塑料与有机物、重金属和纳米颗粒的联合毒性注:SOD表示超氧化物歧化酶,MDA表示丙二醛,mRNA表示信使RNA。Fig. 1 Combined toxicity of microplastics and organic pollutants, heavy metals and nanoparticlesNote: SOD represents superoxide dismutase, MDA represents malondialdehyde, and mRNA represents messenger RNA.
2 微塑料与有机污染物的联合毒性效应(Combined toxic effects of microplastics and organic pollutants)
2.1 海洋微塑料对有机污染物的吸附、富集和载体效应
长期存在于海洋中的微塑料通过一系列复杂的相互作用吸附环境中的有机污染物,使污染物在微塑料上富集,并作为载体携带有机污染物进入海洋生物体内。研究发现,微塑料能够吸附PAHs、PCBs、全氟烷基化合物(polyfluoroalkyl substances, PFASs)、有机氯农药(organochlorine pesticides, OCPs)、抗生素等多种有机污染物[24],其吸附机制主要包括表面吸附、小孔填充和分配作用等[25]。Llorca等[26]对比研究了高密度聚乙烯(high-density polyethylene, HDPE)微塑料、PS微塑料和羧基改性PS微塑料对18种PFASs的吸附能力,发现PS微塑料和羧基改性PS微塑料对PFASs的亲和力比HDPE微塑料更强,相较于淡水环境,海水环境中的高电导率和高pH更有利于微塑料与PFASs达到吸附平衡。Fang等[27]研究发现微塑料能够吸附三唑类杀菌剂,因此可能成为水环境中该类杀虫剂的“汇”,二者间的吸附主要是通过疏水作用和静电相互作用形成,同时会受到微塑料尺寸大小和pH、盐离子强度等环境因素的影响。Ateia等[28]进一步研究了环境特征微塑料对PFASs、阿特拉津杀虫剂和对乙酰氨基酚药物等微量有机污染物的吸附作用,发现环境微塑料比微塑料标准品吸附了更多的污染物,推测这可能是由于环境微塑料表面结构粗糙以及存在内部填料等的原因,提示研究人员使用环境微塑料而非标准品以获得具有真实环境意义的研究结果。此外,不同种类有机污染物与环境微塑料之间的吸附机理有差异,阿特拉津和对乙酰氨基酚主要以中性和弱极性存在,因此它们的吸附主要是由疏水性和π-π电子供体-受体相互作用驱动的;而PFASs的吸附主要是由于疏水作用。
由于微塑料粒径小、相对比表面积大且表面疏水,易从周围环境中富集有机污染物[29]。Ogata等[30]从全世界17个国家的30个海滩上收集的微塑料中检测到了PCBs、滴滴涕(dichlorodiphenyltrichloroethanes, DDTs)和六氯环己烷(hexachlorocyclohexane, HCHs)等多种持久性有机污染物。Fisner等[31]在巴西Santos Bay海滩上设置了30个采样站位,收集沉积物中的塑料颗粒并检测其中PAHs的含量,结果发现塑料颗粒吸附了较多的PAHs(130~27 735 ng·g-1)。Hirai等[32]收集了开放海域、偏远及市区海滩上的塑料碎片(<10 mm),检测发现这些塑料碎片上吸附的PCBs、PAHs和DDTs等有机污染物的最高浓度分别达到436、9 300和124 ng·g-1。Mato等[33]首先检测了采集自日本海滩的PP树脂颗粒上PCBs和二氯乙烯(DDE)的浓度,随后通过原位吸附实验证实PP树脂上的PCBs和DDE是从海水环境中富集而来的,吸附作用使得PP树脂上PCBs和DDE的浓度比周围海水环境中高出105~106倍。Zhang等[34]的吸附动力学实验结果表明,9-硝基蒽易被吸附在PE、PP和PS等类型的微塑料上,尤其是PE,其对9-硝基蒽的吸附量可达734 μg·g-1。模拟实验研究发现,微塑料不仅能够选择性地富集海水中的抗生素,还能够富集抗生素耐药基因,并对微塑料上的细菌群落结构产生一定的影响[35]。
微塑料可能作为载体携带有机污染物,并且增加污染物的生物可利用性。Xia等[36]研究了微塑料(2.0 μm)对栉孔扇贝(Chlamysfarreri)生物富集多溴联苯醚BDE-209的影响,发现微塑料对BDE-209具有载体和清除的双重作用,但从总体而言载体作用大于清除作用,因而微塑料促进了栉孔扇贝对BDE-209的吸收,进而对生物体产生更大程度的毒性效应。然而,也有研究得出完全相反的结论,它们认为微塑料并不是污染物重要的传输载体[37-38]。研究者首先假设了在海洋环境中微塑料对疏水性有机物(hydrophobic organic chemicals, HOCs)是平衡吸附的,在此基础上利用计算生物学的方法得出结论:海洋生物体内的HOCs主要来源于被捕食的猎物,而摄入微塑料可能并不会增加生物对HOCs的暴露风险[37-38]。Beckingham和Ghosh[38]的实验数据也支持了上述结论,由于PP塑料微球(35 μm)吸附PCBs的分配系数较高、肠道溶解较低,因此底栖动物海沙蠋(Arenicolamarina)和夹杂带丝蚓(Lumbriculusvariegatus)对PP塑料微球吸附的PCBs具有较低的生物可利用性。
2.2 微塑料增强有机污染物的毒性及其机制
当微塑料与有机污染物共存时,微塑料可能会增强有机污染物的毒性,产生这种现象的原因和机制主要包括以下几个方面:微塑料可以浓缩有机污染物,使有机污染物的局部浓度增大;并作为有机污染物的载体,增加有机污染物与生物体的接触,使污染物的生物有效性增加;另外,微塑料能够干扰生物体对有机污染物的防御机制,增加有机污染物对生物体的毒性。在表1中归纳了目前微塑料增强有机污染物毒性效应的研究,具体分析如下:
(1)微塑料可以作为环境中有机污染物的“汇”。微塑料通过对有机污染物的吸附作用,使得微塑料上的有机污染物浓度大大增加,从而对生物产生更强的毒性效应。Rochman等[39]将低密度聚乙烯(low density polyethylene, LDPE)微塑料放置在San Diego Bay海洋环境中3个月后,检测发现LDPE微塑料上吸附的PAHs、PCBs和PBDEs含量分别了增加4倍、15倍和1.4倍;随后又将该LDPE微塑料掺入到饵料中投喂青鳉鱼(Oryziaslatipes),发现鱼体内的PAHs、PCBs和PBDEs含量分别增加了2.4倍、1.2倍和1.8倍,同时青鳉鱼出现糖原耗竭、脂肪空泡化和细胞坏死等肝脏损伤。另一项研究以5 μm PS微塑料和6:2氯代聚氟醚磺酸盐(6:2 chlorinated polyfluorinated ether sulfonate, F-53B)共同染毒淡水模式生物斑马鱼(Daniorerio),发现由于PS微塑料对F-53B有较强的吸附,使得斑马鱼对F-53B的生物可利用度和生物蓄积有所降低,然而即便如此,PS微塑料和F-53B共同暴露仍然诱导了斑马鱼体内更为严重的氧化应激和炎症反应[40]。
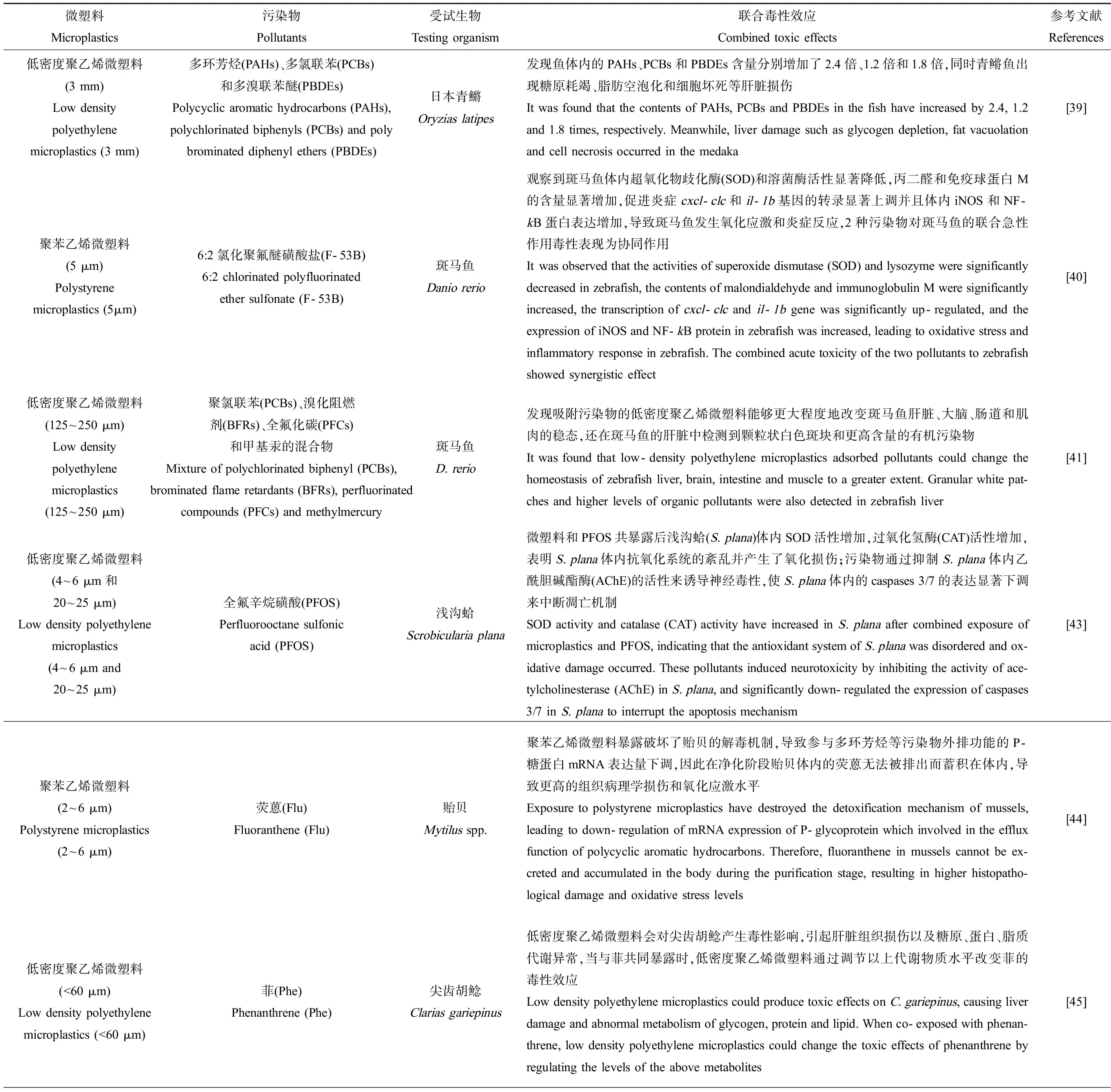
表1 微塑料增强有机污染物的毒性效应Table 1 Enhanced toxicity of organic pollutants by microplastics
(2)微塑料对有机污染物具有载体作用,吸附的有机污染物随微塑料进入生物体内,随后经体内代谢过程进入血液,进而被运输至生物体的其他器官,增强对生物体的毒性。Rainieri等[41]在斑马鱼饲料中分别添加了LDPE微塑料(125~250 μm),有机污染物PCBs、溴化阻燃剂、全氟碳化合物和甲基汞的混合物以及吸附了上述有机污染物的LDPE微塑料,喂食3周后发现吸附污染物的LDPE微塑料能够更大程度地改变斑马鱼肝脏、大脑、肠道和肌肉的稳态,还在斑马鱼的肝脏中检测到颗粒状白色斑块和更高含量的有机污染物。虽然作者没有进一步分析斑马鱼肝脏中微塑料的含量,但是有学者观察到0.60 mm微塑料能够从胭脂鱼(Mugilcephalus)的胃部转移至肝脏中[42],依据以上研究结果可以推测,吸附了有机污染物的微塑料已经转移至斑马鱼的肝脏中,从而导致有机污染物在斑马鱼肝脏中富集以及更高的肝脏毒性。Islam等[43]以吸附了全氟辛烷磺酸(perfluorooctane sulfonic acid, PFOS)的LDPE微塑料(4~6 μm和20~25 μm)染毒浅沟蛤(Scrobiculariaplana),随后在软组织中分别检测到LDPE微塑料和PFOS,这表明LDPE微塑料作为载体携带PFOS蓄积在S.plana体内,并且诱导了S.plana体内的氧化应激和神经毒性。
(3)微塑料干扰生物体的代谢机制,抑制生物体对有机污染物胁迫的防御反应,从而增加对生物的毒性。Paul-Pont等[44]研究了PS微球(2~6 μm)对荧蒽在贻贝(Mytilusspp.)体内富集动力学和毒性的影响,发现添加PS微球并没有改变荧蒽在贻贝体内的富集,由此推测PS微球对荧蒽在贻贝体内的转移影响较小;然而,PS微球暴露破坏了贻贝的解毒机制,导致参与多环芳烃等污染物外排功能的P-糖蛋白mRNA表达量下调,因此在净化阶段贻贝体内的荧蒽无法被排出而蓄积在体内,导致更高的组织病理学损伤和氧化应激水平。另一项研究发现,LDPE微塑料(<60 μm)会对尖齿胡鲶(Clariasgariepinus)产生毒性影响,引起肝脏组织损伤以及糖原、蛋白、脂质代谢异常,而这些物质通常在机体的免疫反应、渗透压调节、生殖调控等生理机能中发挥重要作用;当与菲共同暴露时,LDPE微塑料通过调节以上代谢物质水平改变菲的毒性效应[45]。还有研究发现,当PS微塑料(500 nm)与不同种抗生素共存时,由于微塑料能够显著抑制贝类体内解毒代谢酶谷胱甘肽巯基转移酶(GST)活性以及相关解毒代谢基因的表达,从而干扰抗生素在贝类体内的降解、转运和外排过程,最终导致贝类生物蓄积的抗生素增加[46-47]。
2.3 微塑料抑制有机污染物的毒性及其机制
一些研究结果显示,当微塑料与有机污染物共存时,微塑料也可能会降低有机污染物的毒性,产生这种现象的原因和机制可能是:微塑料一方面可以吸附污染物或者形成复合物,从而减少水体中游离的污染物,降低环境中有机污染物的生物可利用性;另一方面,微塑料可以调动生物体内的毒性响应机制,使生物体对有机污染物的抵御性增强,降低有机污染物的毒性。在表2中归纳了目前微塑料抑制有机污染物毒性效应的研究,具体分析如下:
(1)微塑料与有机污染物通过分配作用或高亲和力发生吸附,减少水中游离的有机污染物,从而削弱了有机污染物的毒性。研究发现,PE微塑料(40~48 μm)能够通过分配作用吸附水体中的8种农药,从而降低水体中的农药残留[48]。将PBDEs吸附在5 mm微塑料上以后,端足目动物Allorchetescompressa对PBDEs吸收量会减少[49]。由于微塑料(200~250 μm)对水体中菲和17α-乙炔基雌二醇(17α-ethinylestradiol, EE2)的吸附作用,使得菲和EE2的生物利用度分别降低了33%和48%,从而减轻了它们对斑马鱼的毒性[50]。氨基改性PS纳米塑料(200 nm)的氨基基团容易与草甘膦的羧基基团结合,因此氨基改性PS纳米塑料对草甘膦具有较强的吸附能力,故而当二者联合暴露时对铜绿微囊藻(Microcystisaeruginosa)的生长抑制呈现拮抗效应[51]。
(2)微塑料吸附污染物后,颗粒团聚增加,因此降低有机污染物的生物可利用性。Trevisan等[52]研究发现,当PS纳米塑料和环境中的多环芳烃提取物(Elizabeth River sediment extract, ERSE)共暴露时,多环芳烃会吸附在纳米塑料表面,这种吸附又会促进纳米塑料发生团聚,由此游离多环芳烃和纳米塑料的浓度降低,斑马鱼对多环芳烃和纳米塑料的吸收减少,同时由ERSE引起的发育畸形和血管发育障碍减轻。
(3)微塑料能够调动生物体内的毒性响应机制,从而削弱对生物的毒性。Zhang等[53]研究了微塑料(0.1 μm)对罗红霉素(roxithromycin, ROX)蓄积和毒性的影响,对罗非鱼(Oreochromisniloticus)暴露14 d后发现,与单独使用ROX相比,尽管微塑料的出现导致鱼体内ROX的富集量增加,但是微塑料的存在减轻了由ROX引起的神经毒性,同时诱导鱼体内抗氧化酶SOD活性,从而削弱了ROX对肝脏的氧化损伤。

表2 微塑料抑制有机污染物的毒性效应Table 2 Suppressed toxicity of organic pollutants by microplastics
3 微塑料与金属污染物的联合毒性效应(Combined toxic effects of microplastics and metal contaminants)
3.1 海洋微塑料对金属污染物的吸附、富集和载体效应
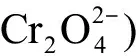
环境监测结果表明,塑料碎片可以富集周围环境中的金属[60]。Holmes等[58]在海滩收集的塑料颗粒中检测到Al、Fe、Mn、Cu、Pb和Zn浓度之和达到180 μg·g-1,Cd、Cr、Co和Ni浓度之和达到0.92 ng·g-1,其中Zn、Pb、Cd、Cr和Co等金属的浓度接近或高于周围环境中的金属浓度。Gao等[35]在野外试验中将PP、PVC微塑料浸没于我国近岸海水中6个月,随后分别检测了微塑料和海水中Cr、Mn、Cu、Zn、As、Cd和Pb等重金属的含量,结果发现2种微塑料较多地富集了Mn、Cu和Pb等重金属,其分配系数(Kpw)高达34.02~9 019.34;同时作者发现微塑料对重金属富集量的差异与海水中重金属浓度和聚合物类型密切相关。类似的,Johansen等[61]发现微塑料能够从河口和淡水环境中吸附放射性金属Cs和Sr,分配系数均>1,并推测表面风化和生物膜形成可能会增加微塑料对2种金属的吸附。
微塑料对重金属有很高的亲和力,可以成为海洋环境中重金属污染物的载体。实验结果证实,PE塑料微球(2~4 μm)能够富集海水中的金属Cd,并作为载体携带Cd一同被蒙古裸腹溞(Moinamonogolica)摄食;不仅如此,携带Cd的塑料微球会对蒙古裸腹溞产生了更为严重的生殖毒性,甚至会导致后代个体死亡或营养不良,作者认为产生这一后果的原因是PE塑料微球上吸附的Cd在酸性消化道或胃肠道内被释放,随后被转运至生物体的其他组织,因此产生了比单纯PE塑料微球更强的毒性[62]。
3.2 微塑料增强金属污染物的毒性及其机制
当微塑料与重金属共存时,微塑料增强重金属毒性的联合作用机制与有机污染相似。一方面,微塑料吸附重金属,并作为重金属的载体被生物体摄入,增加生物体对重金属的富集;另一方面,微塑料与重金属之间存在相加作用或协同作用,这种交互效应增加了重金属的毒性;再一方面,当两者共存时,更易于破坏生物体的健康状态,对生物体的健康造成威胁。
(1)微塑料可以吸附重金属,并携带重金属进入生物体内,使得生物体对重金属的富集量增加,从而增强了重金属对生物的毒性效应。Sun等[63]制备了重金属-微塑料-糠虾复合饵料并以此饵料投喂海马(HippocampuskudaBleeker),随后检测发现海马体内富集了重金属(Cu2+、Cd2+和Pb2+),作者还发现正是由于重金属的富集导致海马的体长、体质量、生长速率和存活率等生长参数显著降低。Lu等[64]研究发现,5 μm塑料微球的存在增加了斑马鱼鳃、肠和肝脏组织中Cd的富集量,且当塑料微球的浓度由20 μg·L-1增加到200 μg·L-1时,上述组织中富集的Cd含量进一步增加。作者认为,由于塑料微球对Cd具有吸附作用,同时5 μm的塑料微球能够进入斑马鱼的鳃、肠和肝脏组织中[65],因此更多的Cd随着塑料微球被运输至各组织中。不仅如此,塑料微球的存在还增强了Cd对斑马鱼的毒性,二者共同暴露引起斑马鱼组织发生氧化损伤和炎症反应。
(2)微塑料和重金属之间存在相加作用或协同作用,因此联合暴露增加对生物的毒性效应。Barboza等[16]研究发现,微塑料(1~5 μm)的存在不仅增加了欧洲鲈鱼(D.labrax)幼鱼鳃和肝脏中Hg的富集量,而且还诱导鳃和肝脏器官中发生氧化应激。这是因为微塑料与Hg存在交互效应,在鳃中,二者对总抗氧化酶活性的诱导呈相加作用;而在肝脏中,呈相加或协同作用。此外,双因素方差分析结果显示,微塑料与Cd联合暴露对鲤鱼(Cyprinuscarpio)的毒性效应增加,对血浆中多项酶活指标、生化指标和免疫指标均呈现协同作用[66]。
(3)当微塑料与重金属共存时,可能会改变生物体的血液生化指标和细胞稳态,对生物体的健康构成危害。研究表明,与微塑料或Cd单独暴露相比,微塑料和Cd联合暴露30 d后,鲤鱼(C.carpio)血浆中AChE、谷氨酰转移酶(gammaglutamyl-transferase, GGT)酶活进一步降低,谷丙转氨酶(alanine aminotransferase, ALT)、乳酸脱氢酶(lactate dehydrogenase, LDH)酶活进一步升高,这表明鲤鱼的生理状态出现异常;此外,固有免疫因子溶菌酶活性、补体旁路溶血活性及总免疫球蛋白水平、补体C3和C4水平进一步下降,而免疫系统功能的失调可能会使鱼类更容易感染疾病[66]。在另一项研究中,微塑料(500 μg·L-1)和Cd(50 μg·L-1)联合暴露增加了对七彩神仙鱼(Symphysodonaequifasciatus)的氧化损伤,鱼体内累积了较多的蛋白质氧化产物[67]。
3.3 微塑料抑制金属污染物的毒性及其机制
也有少数研究认为,由于微塑料与重金属之间存在吸附作用,当低密度的微塑料漂浮在水面上时,吸附在微塑料上的重金属也一同漂浮在水面上,从而降低了重金属的生物利用度,进一步还可能会改变重金属的毒性。Khan等[68]首先将Ag吸附在微塑料上(~75% Ag),然后对斑马鱼(D.rerio)进行暴露,实验结果表明斑马鱼对Ag的摄取量显著减少,作者认为这是由于密度为0.96 g·cm-3的PE微塑料(10~106 μm)倾向于漂浮在水面上,因此斑马鱼对吸附态Ag的生物可利用度减少。对于目前微塑料与重金属联合毒性效应的研究归纳于表3中。
4 微塑料与纳米颗粒的联合毒性效应(Combined toxic effects of microplastics and nanoparticles)
4.1 海洋微塑料对纳米颗粒的吸附、富集和载体效应
当前的研究主要关注微塑料对持久性有机污染物、重金属的吸附,微塑料与纳米颗粒之间的相互作用研究极少。纳米颗粒与有机污染物、重金属最大的区别在于纳米颗粒是颗粒态的,正因此它们与微塑料的相互作用机制可能会有所不同。Li等[69]首次研究了水环境中Ag纳米颗粒(silver nanoparticles, AgNPs)与PE、PP和PS微塑料之间的相互作用,结果仅在AgNPs与PS微塑料之间观察到了吸附现象,产生这一现象的主要原因可能是由于PS含有苯环结构,由此产生了π-π相互作用、多孔表面结构、高比表面积、低结晶度等特征,促进了PS微塑料对AgNPs的吸附。此外,研究者还观察到AgNPs在PS微塑料表面主要以纳米颗粒而非Ag+的形式存在,其吸附过程为单分子层吸附,且AgNPs和PS微塑料的质量比对吸附过程影响较大。该研究增进了对水环境中纳米颗粒和微塑料之间相互作用的理解,然而目前关于微塑料对纳米颗粒的富集和载体效应知之甚少,未来应加强这方面的研究。对于目前微塑料与纳米颗粒联合毒性效应的研究归纳在表4中。
4.2 微塑料增强纳米颗粒的毒性及其机制
人工纳米颗粒是另一种新型污染物,环境中存在的纳米颗粒种类多样,如金属及金属氧化物纳米颗粒、碳纳米颗粒和量子点等。目前已经在地表水中检测到了纳米颗粒[70],并且在海洋软体动物(牡蛎、贻贝、扇贝、蛤蜊和赤贝)体内检测到含钛、铜、锌和银的纳米粒子[71]。因此,厘清微塑料与纳米颗粒的联合毒性在微塑料的环境风险评估中也是不容忽视的。以下内容分析了微塑料增强纳米颗粒毒性效应的可能机制。
(1)微塑料与生物体之间易形成异聚体,一方面可能会破坏细胞表面结构,促进纳米颗粒的内化;另一方面,微塑料和纳米颗粒附着在生物体表面,干扰细胞内外必需的物质交换,从而增加对生物的毒性。向二氧化钛纳米颗粒(titanium dioxide nanoparticles, TiO2NPs)中分别添加无改性的PS微塑料和氨基改性PS微塑料,微塑料和TiO2NPs混合暴露增加了对小球藻(Chlorellasp.)的毒性,并产生更多的ROS[72]。观察SEM电镜图片发现,PS或氨基改性PS微塑料与小球藻之间形成了异聚体,这些异聚体的形成可能会破坏小球藻的表面结构,并因此增加TiO2NPs进入藻细胞的机会[72]。同时,藻细胞表面团聚的PS还可能会干扰藻细胞的营养盐吸收和气体交换[72]。Davarpanah和Guilhermino[73]的实验研究也发现,单独暴露于3 mg·L-1金纳米颗粒(gold nanoparticles, Au NPs)或4 mg·L-1微塑料并不会显著降低海洋微藻朱氏四爿藻(Tetraselmischuii)的平均比生长率,而同时暴露于3 mg·L-1Au NPs和4 mg·L-1微塑料能够显著降低微藻的比生长率,这表明Au NPs和微塑料在混合后增加了对微藻的毒性,作者推测产生这一现象的原因可能有以下几点:微塑料能够吸附在藻细胞壁上并造成细胞壁破损,由此可能会促进Au NPs进入藻细胞内;另外,Au NPs也可以附着在藻细胞壁上,微塑料和Au NPs可能会共同抑制藻细胞的运动性以及藻细胞对营养物质的吸收和/或对O2/CO2气体交换。
(2)微塑料与纳米颗粒之间存在协同作用,二者联合暴露增加对生物的毒性效应。有研究发现,共同暴露于Ag NPs和PS纳米塑料时,尽管棕鞭藻(Ochromonasdanica)细胞中蓄积的Ag和纳米塑料减少,但是Ag NPs与纳米塑料对O.danica的联合毒性是增强的,表明这2种颗粒的联合毒性是协同的[74]。Pacheco等[75]将大型溞(Daphniamagna)分别暴露于Au NPs(5 nm)和PE微塑料(1~5 μm)以及二者的混合物中,发现暴露于混合物导致的死亡率高于分别暴露于Au NPs或微塑料引起的死亡率之和,这表明暴露于Au NPs和微塑料对大型溞具有协同致死效应。

表3 微塑料与金属污染物的联合毒性效应Table 3 Combined toxicity of microplastics and heavy metals

表4 微塑料与纳米颗粒的联合毒性效应Table 4 Combined toxicity of microplastics and nanoparticles
(3)微塑料能够增加生物体质膜的渗透性,促使纳米颗粒释放的金属离子在细胞内积累,因此增加微塑料与纳米颗粒的联合毒性。Huang等[74]研究了Ag NPs和PS纳米塑料对莱茵衣藻(Chlamydomonasreinhardtii)的单一毒性和联合毒性,由于莱茵衣藻具有细胞壁,不能吸收纳米颗粒,因此Ag NPs对莱茵衣藻的毒性应归因于释放的Ag+。PS纳米塑料的出现增加了莱茵衣藻质膜的渗透性,使得莱茵衣藻积累的Ag+增多,二者的联合毒性增大。
4.3 微塑料抑制纳米颗粒的毒性及其机制
另外一些研究结果发现,微塑料也可能会抑制纳米颗粒的毒性,产生这种现象的原因主要归因于微塑料与纳米颗粒之间的异相团聚或微塑料对纳米颗粒释放离子的吸附,最终导致二者的联合毒性降低。Zhu等[76]研究了铜纳米颗粒(copper nanoparticles, Cu NPs)和PVC微塑料单一暴露和共同暴露下对S.costatum的毒性作用,发现共同暴露组对S.costatum的生长抑制要低于Cu NPs单一暴露组,可见微塑料的加入降低了Cu NPs的毒性。进一步分析发现,微塑料不仅吸附了藻培养液中的Cu2+,还与Cu NPs发生团聚,这可能就是微塑料降低Cu NPs毒性的主要原因。类似地,带负电荷的羧基改性PS微塑料也降低了TiO2NPs对Chlorellasp.的毒性,且混合暴露后藻细胞内产生的ROS减少,作者推测羧基改性PS微塑料和TiO2NPs之间的异源团聚和沉淀产生这一现象的主要原因[72]。
5 展望(Future)
塑料碎片在海洋环境中广泛存在,由于体积微小,微塑料可被海洋环境中的各种生物摄入。对于海洋生物来说,摄入微塑料的风险不仅来自于微塑料本身,还来自于它们吸收和富集周围环境中的有毒污染物,并且微塑料与吸附态污染物有可能通过食物链发生传递。由于微塑料与污染物广泛存在于环境中,迫切需要研究其对生物体的影响。目前有关对微塑料与污染物相互作用的研究尚处于初级阶段,未来应加强对环境特征微塑料、污染物和海洋渔业生物的研究,以便发现它们潜在的毒性机制以及微塑料对海洋生态系统及人体健康的潜在影响,对于评价微塑料对海洋生态环境的潜在风险具有重要的意义。未来应加强以下几方面的研究:
(1)微塑料与有毒污染物的相互作用以及二者对海洋生物的联合毒性机制是复杂的,会受到微塑料特征(如尺寸、成分和表面官能团等)、污染物的理化特征、测试生物物种和暴露环境等多种因素的共同影响。然而,先前的研究往往重点关注某一环节(如仅研究水环境中微塑料与污染物的吸附行为或微塑料与污染物联合暴露后的生物响应),目前仍然缺乏对微塑料和污染物的系统性研究。未来应对微塑料与污染物的联合作用机制开展更为深入的研究,充分考虑微塑料与污染物共存时的环境行为,例如微塑料在环境介质中的稳定性、污染物的形态转换、二者进入生物体内以后发生的吸附/解吸等,进而阐明微塑料与污染物相互作用对生物毒性效应的影响机制以及微塑料在其中所起的载体作用。
(2)目前开展的微塑料与有毒污染物联合毒性作用研究主要以确定大小的初生微塑料为主。然而,在实际环境中,微塑料主要以次生微塑料为主。在波浪、光照和生物作用下次生微塑料的粗糙度、官能团、尺寸和比表面积等性能与初生微塑料相差较大,这就可能会改变其与有毒污染物的相互作用进而加强或抑制二者的联合毒性。因此,未来的研究中建议使用环境特征的次生微塑料开展相关研究。此外,相关研究主要集中于对PS、PE、PP和PVC等类型微塑料的研究,这可能是由于这些微塑料是海洋环境中较为常见的类型同时容易购买获取微塑料标准品。然而由于不同类型的微塑料对有毒污染物的吸附能力有较大差异,因此对于海洋生物摄入较多的微塑料类型,如聚酯、丙烯酸和玻璃纸等,也应该获得足够的关注。
(3)目前的研究主要集中于对单一物种的影响,未来还应明确微塑料与有毒污染物是否会沿着食物链/网迁移以及在不同营养级水平上是否存在生物浓缩和生物放大效应,最终阐明微塑料和有毒污染物是否会影响水产品质量安全,从而对人类健康产生危害。水环境中微塑料的丰度和污染物的浓度、被捕食者体内微塑料和污染物的含量、捕食者对微塑料和污染物的净化能力和半衰期都可能会对此产生影响。

