基于习性和食物网的白洋淀大型底栖动物群落恢复研究
陈泽豪,王颖,*,王乔,付军,裴元生
1. 北京师范大学环境学院水沙科学教育部重点实验室,北京 100875 2. 中日友好环境保护中心,北京 100029
大型底栖动物主要指生命周期的全部或者大部分时间生活在水底、肉眼可见(能被500 μm孔径网筛截留)的水生无脊椎动物群[1],是湖泊水生态系统中的重要生态类群,在食物网的能量流动和物质循环中起着重要作用[2]。多数大型底栖动物迁移能力有限,活动范围小,回避湖泊环境变化的反应能力较弱,因此在受到外来干扰时容易遭受破坏[3-4]。
湖泊生境状况与底栖动物群落息息相关。文献报道,生境水体溶解氧浓度、水温、底质粒径和氮磷营养盐等影响大型底栖动物群落的生长和发育[5-9]。因此,生境改善是大型底栖动物恢复的重要前提。目前,受损大型底栖动物群落的恢复着重于对生境的恢复和优势种经验投加,包括底质改造[10-11]、沉水植物恢复[12-13]和优势种的增殖放流[14]等。在实际天然水体中,大型底栖动物与其他水生生物如沉水植物、藻类等水生生物存在错综复杂的关系,进而形成食物网。在食物网中,沉水植物为大型底栖动物提供安全的庇护所和营养物质,促使其整体密度和生物量的提高[12]。鱼类等高级消费者以底栖动物为食,影响大型底栖动物生长发育速率,对现存生物量产生负面影响[15]。食物网中所有水生生物之间相互联系,每个水生生物的能量输入与输出保持平衡,生物之间相互影响,维持着整个食物网的稳定性和完整性[16]。生境改善和优势种经验直接投加的方式,未充分考虑恢复物种与其他生物在食物网内部的联系,可能会导致投加物种单一、过量,进而破坏食物网的稳定性。因此,大型底栖动物恢复关键物种的确定和生物量的合理投加,需要基于食物网、实际调研和工程经验多方面综合分析科学确定,才能更好地保障整个生态系统的整体稳定性。由Polovina[17]提出的Ecopath食物网模型,以食物网为主线,以建模方式量化生态系统各特征参数,能够较为清晰地反映出生态系统的发展情况,明确食物网的关键物种,并提出合理的生态容量调控,达到科学生态修复目的[18]。
白洋淀作为雄安新区的重要组成部分,是大清河水系重要的水量调节枢纽,是维持京津冀地区生态平衡的重要水体。从20世纪80年代开始,由于干旱以及人类活动等原因,白洋淀湖泊出现干涸,淀区数量锐减,淀区湿地面积减少了近1/3,淀区水质以Ⅳ和Ⅴ为主。1980—2010年间人类活动的加剧导致白洋淀底栖动物种类减少,优势种主要以耐污种为主,生物多样性降低[19]。为此,国家在白洋淀设立了“十三五”水专项项目,开展了生态清淤试点工程,通过清淤削减湖泊的内源污染实现水质净化[20-21]。然而,大型底栖动物群落在清淤过程中容易遭到严重破坏,与之密切联系的底栖食物网容易受到影响,清淤后大型底栖动物群落如何更科学地恢复并维持长效稳定性,急需寻求解决方案。因此,本研究在充分调研白洋淀大型底栖动物群落特征基础上,拟通过食物网模型确定大型底栖动物恢复的关键物种,计算关键物种的合理生物量范围,结合大型底栖动物的习性特征,建立基于食物网和习性特征的底栖动物恢复方案;根据所建立食物网模型,提出恢复后期大型底栖动物群落优化调控管理方案,进而为湖泊大型底栖动物整体群落的生态恢复提供参考。本研究结果对于白洋淀以及我国北方浅水湖泊的生态恢复具有一定参考价值,可支撑河北雄安新区生态建设。
1 样品收集与分析(Sampling collection and analysis)
1.1 样品采集
本研究对2010年和2018年白洋淀大型底栖动物、鱼类、沉水植物、浮游植物、浮游动物和底栖藻类等生物样品进行采集。2018年的数据来自春季(4月)、夏季(7月)和秋季(11月)白洋淀本土调研,共20个采样点。布点区域主要分布于白洋淀北部和中部以南开阔水面。西部藻苲淀区干涸化,东部及西部以南地区为围堤围捻和鱼塘,故不进行采样布点。主要采样点点位如图1所示。2010年的数据来自文献调研[22-25],取自2009年8月—2010年3月3个季节(春季、夏季和秋季)共14个点位的平均值。大致点位包括:烧车淀、王家寨、杨庄子、枣林庄、鸳鸯岛、南刘庄、府河入淀口、寨南、光淀张庄、捞王淀、圈头、端村、东田庄和采蒲台,与2018年的点位基本相似,且覆盖白洋淀大多数区域,采样方法一致。
大型底栖动物、鱼类、沉水植物、浮游植物、浮游动物和底栖藻类等生物样品数据的采集和获取均参考《湖泊富营养化调查规范》[26]。大型底栖动物主要利用彼得森采样器从湖泊获取表层0~30 cm的沉积物样品,经0.5 mm的金属网筛过滤清洗后,分拣并用75%酒精进行固定和保存。在实验室利用显微镜对底栖动物样品进行鉴定、计数和称量,从而获得其生物量。浮游植物和浮游动物通过浮游生物网采集水面下20 cm处水样后用0.2 μm滤膜过滤后的获取样品,进行显微鉴定和计数。底栖藻类在水生植物、动物和石头等天然基质表面获取。浮游植物、浮游动物和底栖藻类的计数方法根据细胞平均湿质量指标将浮游动物、浮游植物和底栖藻类的细胞数量换算为生物量。沉水植物在采样区布置2 m×2 m的样方采集后,于60~80 ℃温度下烘干至恒重称量。鱼类在采样区布置2 m×2 m的样方用白洋淀淀区渔网采集,并称量分类。

图1 2018年白洋淀采样点位注:S1. 府河入淀口;S2. 南刘庄;S3. 鸳鸯岛;S4. 白沟引河入淀口;S5. 烧车淀;S6. 王家寨;S7. 寨南;S8. 光淀张庄;S9. 杨庄子;S10. 枣林庄; S11. 圈头东;S12. 圈头;S13. 端村;S14. 唐河入淀口;S15. 东田庄;S16. 后塘;S17. 采蒲台;S18. 范峪淀;S19. 金龙淀;S20. 小张庄。Fig. 1 Sampling sites in Baiyangdian Lake in 2018Note: S1. The entrance of the Fuhe River; S2. Nanliuzhuang; S3. Yuanyangdao; S4. The entrance of the Baigouying River; S5. Shaochedian; S6. Wangjiazhai; S7. Zhai Nan; S8. Guangdianzhangzhuang; S9. Yangzhuangzi; S10. Zaolinzhuang; S11. Quantoudong; S12. Quantou; S13. Duancun; S14. The entrance of the Tang River; S15. Dongtianzhuang; S16. Houtang; S17. Caiputai; S18. Fanyudian; S19. Jinlongdian; S20. Xiaozhangzhuang.
1.2 数据统计学分析
1.2.1 大型底栖动物优势度计算
大型底栖动物群落特征采用优势度指数进行分析。通过计算物种优势度指数,确定底栖动物的优势种。当Y≥0.02时,该物种被认定为优势种[27]。优势度的计算公式如下:
(1)
式中:Pi为第i个物种的数量与所有物种总个体数的比值;fi为该物种出现的频率。
1.2.2 基于Ecopath模型关键物种指数、生态容量和生态系统总体特征参数的计算
在郭思雅等[28]的研究基础上,利用2010年和2018年的Ecopath食物网模型,计算对应关键物种指数KS和生态容量。
1.2.2.1 模型原理
Ecopath模型运用热力学原理,使生态系统中功能群的输入与输出保持平衡。Ecopath模型涉及到了物质平衡与能量平衡2种核心方程,最终得到方程式:
Bi×(P/B)i×EEi-Ei=∑Bj×(Q/B)j×DCij
(2)
式中:i为被捕食功能组,其中Bi为被捕食功能组i的生物量(t·km-2);(P/B)i为被捕食功能组i的生物量与生产量比值;EEi为第i组的生态营养转化效率,为捕捞量与被捕捞量之和与其生产量的比例,代表该组的生产量在系统内被利用的比例;j为捕食功能组,其中Bj为捕食功能组j的生物量;(Q/B)j为j组消耗量与生产量比值;DCij为功能组i所占捕食组j食物组成的比例,Ei为功能组i的产出量。
1.2.2.2 参数确定
Ecopath模型的构建,包括建立了包含12个功能组:(1)游藻类、(2)底栖藻类、(3)大型沉水植物、(4)浮游动物、(5)其他底栖动物、(6)螺、(7)虾、(8)草食性鱼类、(9)杂食性鱼类、(10)肉食性鱼类、(11)滤食性鱼类和(12)碎屑。各功能组的生物量的数据通过现场采集与历史数据收集等,确定模型相应参数。
生产/生物量(P/B)和消耗/生物量(Q/B)系数估算:底栖藻类、浮游植物、沉水植物P/B和Q/B参考相近生态系统[29-30]的估算值。估算底栖动物P/B参数值时,大型底栖动物生产量(P)值采用Brey的经验公式[31]进行估计,个体质量干湿比参照其他模型[29-30,32],取6∶1。鱼类功能组的P/B和Q/B值采用经验公式[33-35]计算获得,计算所需数据来自渔业资源数据库(www.Fishbase.org)。功能组食物组成矩阵的数据主要来源于渔业资源数据库fishbase(www.Fishbase.org)。
1.2.2.3 模型平衡
生态效率(EE)是指在生态系统内(通过食物网传递)种群生产量与消费量(或渔业捕获)之间的比例。EE值域为0~1,EE>1表示输入参数在理论上不可行。当EE无法通过现场测量或经验关系来估计时,可用EwE模型中的其他参数计算[36]。如果EE>1,表示模型不平衡,需要修改相关参数,直到总输入等于总输出,且所有功能组的总效率和EE都应<1。
1.2.2.4 关键物种指数
关键物种指在生态系统和食物网中具有关键作用的种类,并且其影响的大小和其自身的丰度并不一定成比例。Ecopath模型中关键度指数的计算采用的是Libralato等[37]提出的方法。Ecopath模型筛选关键种方法具有很高的准确性,并且该关键度指数的计算具有通用性。关键物种指数KS计算公式如下所示:
KSi=log[εi(1-Pi)]
(3)
(4)
(5)

1.2.2.5 底栖动物生态容量的确定
在生物量管理过程中,现有生态系统特定物种的生态容量是一个关键的调控指标。根据Ecopath模型原理,对食物网中任意功能组的生物量进行调整,会改变食物网中与之相关的功能组生态营养效率EE及其他生态系统参数。在食物网模型平衡的基础上,调整该功能组的生物量,直至模型中任意功能组的EE≥1,模型不平衡,此时该功能组的生物量即为此功能组的生态容量[38]。
1.2.2.6 基于Ecopath模型的生态系统总体特征参数
基于Ecopath模型的生态系统总体特征参数主要包括总系统初级生产/呼吸(TPP/TR)、连接指数(CI)、系统杂食指数(SOI)和Finn’s循环指数(FCI)。其数值主要通过Ecopath模型得出。其中,TPP/TR是一个描述系统成熟程度的重要比率。这个比值可以是任意的正数,也可以是无穷小的值。在系统发展的初级阶段,生产量超过呼吸量,导致其>1;当系统遭受有机污染时该比例会<1;最终在成熟的系统中比例接近于1,这时固定的能量和用于维持的消耗基本持平。CI和SOI反映了生态系统内部联系的复杂程度。CI和SOI越高,系统越稳定。FCI是系统中循环流量与总流量的比值,表明有机物流转的速度。
2 结果与讨论(Results and discussion)
2.1 基于优势种和关键种的底栖动物恢复物种确定
底栖动物恢复物种的确定主要考虑:(1)所选恢复物种为当地现存物种,适应能力强,在群落受损后能迅速恢复为原来的群落,且无外来入侵的隐患。(2)所选恢复物种应为底栖动物群落的优势种和关键种。该类物种对底栖动物群落结构影响较大,且与其他底栖生物关系密切,通过恢复该类物种有利于维持底栖生态系统的稳定。
白洋淀2018年共鉴定底栖动物5类21种,包括甲壳动物、软体动物、寡毛类、蛭类和昆虫类。其中,软体动物和昆虫类的种类最多。优势度计算结果表明,春季底栖动物优势种有6种,为中国圆田螺、中华圆田螺、梨形环棱螺、日本沼虾、中华米虾和克氏螯虾,分别隶属软体动物和甲壳动物;夏季优势种有5种,为箭蜓、中国圆田螺、中华圆田螺、大红德永摇蚊和羽摇蚊,分别隶属昆虫类和软体动物;秋季优势种有4种,为中华圆田螺、大红德永摇蚊、羽摇蚊和拟摇蚊,分别隶属软体动物和昆虫类(表1)。因此,2018年底栖动物优势种春季为软体动物和甲壳动物,夏季和秋季为软体动物和昆虫类动物。根据全年各季节底栖动物出现的频次可知,以出现频次为2~3次作为全年主要优势物种,全年底栖动物主要优势物种为中华圆田螺、中国圆田螺、羽摇蚊和大红德永摇蚊(表3)。对比2007—2015年底栖动物的优势种组成(表2)[39-40],2018年所确定的优势种种类均在历年出现过,主要为摇蚊幼虫和软体动物。这是由于摇蚊幼虫和软体动物为耐污种,甲壳动物等其他种类底栖动物多为兼性种或清洁种,耐污种更适应污染较大的白洋淀区域[41]。
利用Ecopath模型计算2010年和2018年白洋淀关键物种KS指数(图2),通过比较不同年份底栖动物的关键性指数,发现2010年:软体动物>其他底栖动物>甲壳类;2018年:软体动物>甲壳类>其他底栖动物。因此,软体动物为2010年和2018年主要的关键功能组。
综合考虑白洋淀底栖动物的关键种和优势种,恢复物种主要选择软体动物、摇蚊幼虫和甲壳动物3类。
2.2 基于习性特征的底栖动物恢复方式确定
大型底栖动物的恢复方式主要结合大型底栖动物的迁移习性和生长习性特征(表4)[42-48],依照迁移习性选择人工恢复或者自然恢复为主的恢复方式;一般迁移能力强的大型底栖动物以自然恢复为主,迁移能力弱的大型底栖动物以人工恢复为主。依照不同物种的生长习性特征,确定基本生境条件。本文基于水质状况良好的前提下,根据水体温度、溶解氧需求、食性特征、繁殖季节等基本条件对底栖动物恢复的生境条件进行确定。
根据大型底栖动物优势种和关键功能组计算结果,白洋淀大型底栖动物恢复种以虾类甲壳动物、螺类软体动物和昆虫类摇蚊幼虫为主,需要讨论其恢复方式和基本生境需求等。研究发现,甲壳动物的迁移能力最强,螺类软体动物次之。摇蚊昆虫类动物幼年较弱,成年后与甲壳动物相当。一般大型底栖动物生长适宜温度不超过30 ℃。大型底栖动物中软体动物溶解氧(DO)需求不低于3.5 mg·L-1,甲壳动物对溶解氧的要求为≥4 mg·L-1,摇蚊幼虫可以在低氧浓度(DO≤1 mg·L-1)下生长。对比不同种大型底栖动物对沉水植物群落的影响,摇蚊幼虫主要以沉积物碎屑为食,其对沉水植物群落的影响较小;甲壳动物和螺类软体动物为杂食性动物,其对沉水植物群落的影响相对较大。

图2 2010年和2018年白洋淀关键种的关键性指数(KS)指数值注:S1. 肉食性鱼类;S2. 杂食性鱼类;S3. 草食性鱼类;S4. 滤食性鱼类;S5. 甲壳动物;S6. 软体动物; S7. 其他底栖动物;S8. 浮游动物;S9. 浮游藻类;S10. 底栖藻类;S11. 沉水植物。Fig. 2 Keystone index (KS) of key macrozoobenthos species in Baiyangdian Lake in 2010 and 2018Note: S1. Predacious fishes; S2. Omnivorous fishes; S3. Herbivorous fishes; S4. Filter-feeding fishes; S5. Crustacea; S6 Mollusca; S7. Other benthos; S8. Zooplankton; S9. Planktonic algae; S10. Benthic algae; S11. Submerged plants.
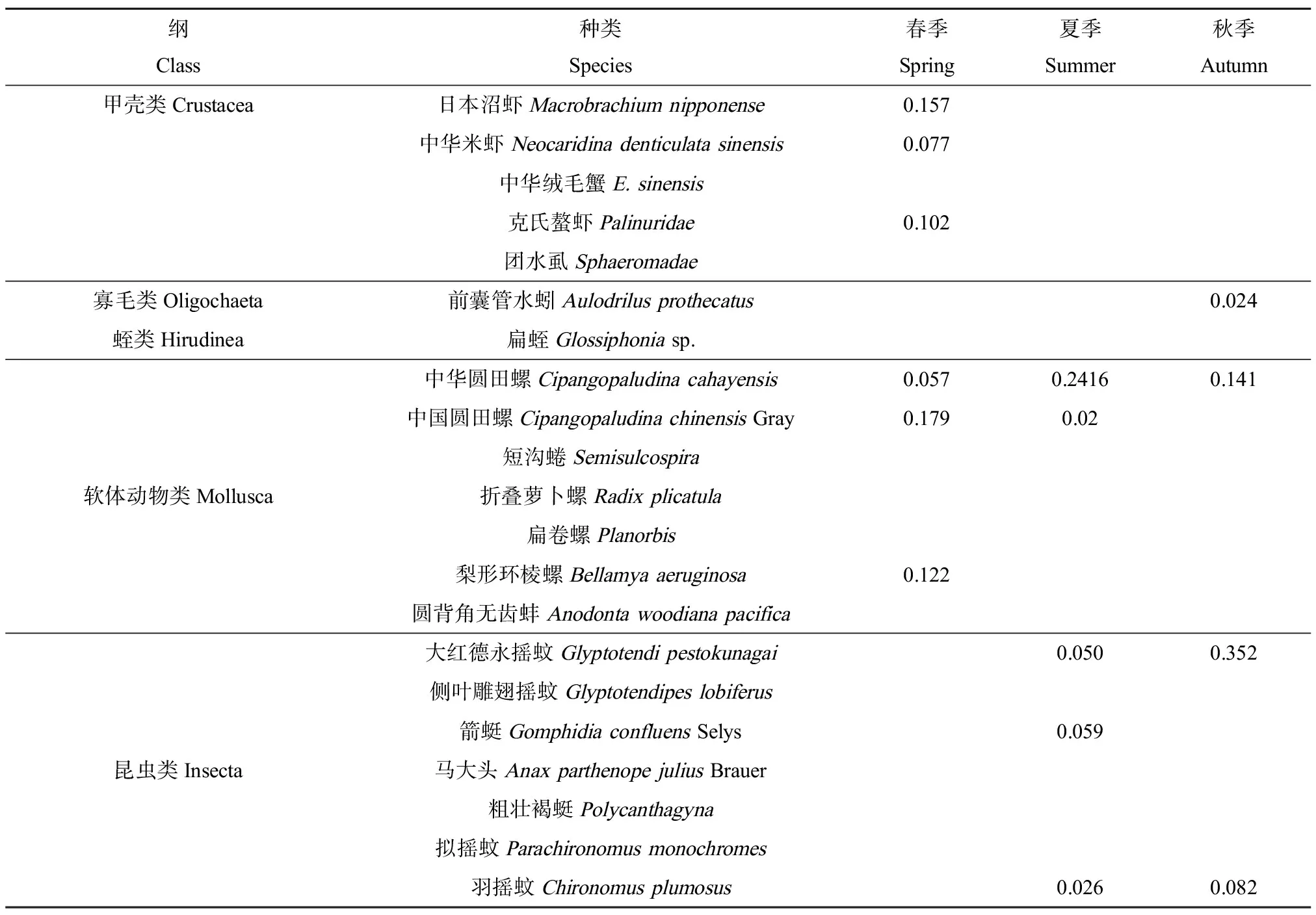
表1 2018年白洋淀大型底栖动物优势度计算结果Table 1 Calculation results of dominant species of macrozoobenthos in Baiyangdian Lake in 2018
因此,提出白洋淀不同迁移能力底栖动物的恢复方式如下:
(1)低迁移能力大型底栖动物(包括摇蚊幼虫类)。该类大型底栖动物的迁移能力较弱,对栖息地的依赖性较强,容易因栖息地破坏而遭到严重破坏。但该物种成长成摇蚊后具有极强的飞翔能力,只要底质适宜,可以快速恢复。该类大型底栖动物一般以自然恢复为主。
(2)中等迁移能力的大型底栖动物(包括螺类软体动物)。该类大型底栖动物迁移能力适中,少数底栖动物能通过迁移避免栖息地破坏带来的影响,群落受损程度中等,以人工恢复为主。因此,软体动物采取人工投加的方式进行恢复,依照少量多次的原则投加。恢复时间宜在夏季或秋季。恢复前须满足的生境条件为:①投加螺之前沉水植物生长较稳定(种植1个月左右);②溶解氧达到4~5 mg·L-1,且任何时刻不低于4 mg·L-1。根据2018年调研的软体动物的优势种组成,螺类软体动物恢复物种主要选中华圆田螺、中国圆田螺、梨形环棱螺和豆螺中的1~2种。

表2 白洋淀历年底栖动物优势物种Table 2 The dominated macrozoobenthos species in Baiyangdian Lake over the years

表3 2018年和2007—2018年间底栖动物出现频次Table 3 Frequency of macrozoobenthos in 2018 and current years of 2007 to 2018
(3)对于高迁移能力底栖动物(包括甲壳动物)。该类底栖动物的迁移能力较强,多数底栖动物能通过迁移避免栖息地破坏带来的影响,对群落整体影响较小,一般以自然恢复为主。但是当采取围挡且完全封闭的施工方式时,主要依照少量多次的原则进行人工投加。恢复时间宜在夏季。恢复前须满足:①沉水植物生长迅速稳定,且沉水植物覆盖率在20%~60%(约1个月左右)[48];②溶解氧达到4~5 mg·L-1,且任何时刻不低于4 mg·L-1。
2.3 基于食物网模型的大型底栖动物恢复投加量的确定
根据大型底栖动物优势种和关键功能组计算结果,已经确定螺类软体动物为恢复的关键物种,其恢复方式为人工投加,因此需要详细讨论其投加量。在进行大型底栖动物恢复时,首先需要调研恢复区大型底栖动物、鱼类、沉水植物、浮游植物、浮游动物和底栖藻类等生物样品的生物量,建立食物网模型,计算关键种软体动物螺类的生态容量。根据2018年沉水植物、大型底栖动物调研生物量、工程经验值和食物网模型确定的生态容量(表5)[49-52],确定相关大型底栖动物的投加量,并依照少量多次的原则进行投加。关键种软体动物螺类的生态容量是在2018年食物网模型基础上,通过情景分析获取。当软体动物螺类的生物量为2018年实际调研量的0.691倍~1.355倍时,各个功能组EE<1,此时生态系统处于稳态;继续减少或增加软体动物生物量会导致生态系统失衡,因此确定该范围为软体动物螺类的最小和最大生态容量。
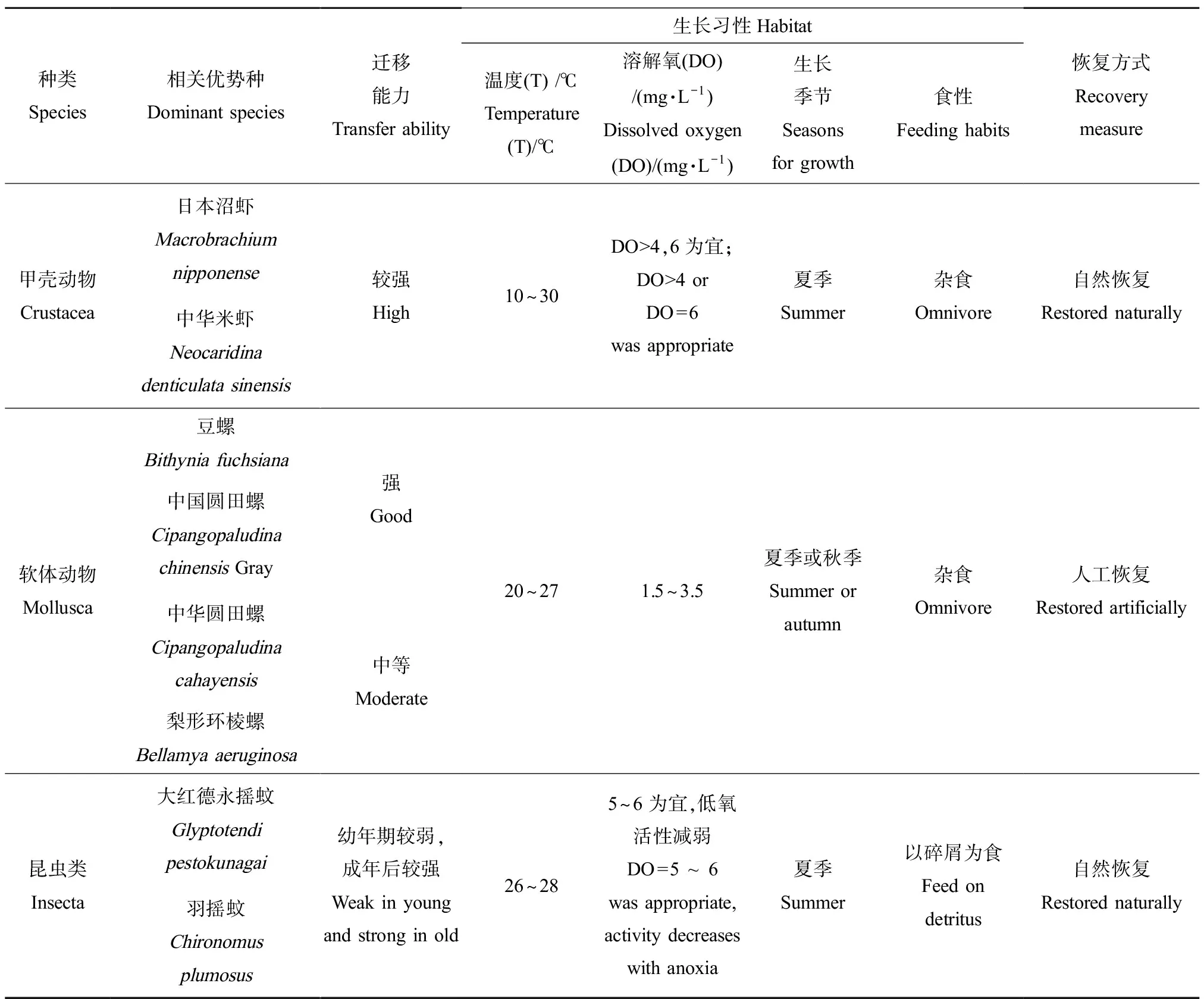
表4 大型底栖动物习性特征Table 4 Behavior characteristics of macrozoobenthos species

表5 恢复种的调研生物量、工程经验值和生态容量Table 5 Biomass from investigation, value of engineering experience and ecological capacity of restored species
2.4 基于食物网模型的底栖动物恢复优化调控方案
底栖动物优化调控方案的主要思路是通过调研、食物网模型情景分析进行优化调控。具体方案流程如图3所示。湖泊底栖动物恢复后,对修复后生态系统的底栖藻类、浮游动物、浮游植物、底栖动物、水生植物和鱼类的生物量进行采样调研。通过Ecopath模型模拟修复后生态系统,计算模型总体特征参数(包括TPP/TR、CI和SOI等),与修复前建立的Ecopath模型的总体特征参数进行对比。若生态系统成熟指标TPP/TR增加、CI和SOI等指标减小,则认为生态系统成熟度和稳定性降低,生态系统向逆向演替趋势发展,此时,需要对修复后生态系统进行进一步调控。根据食物网模型进行模拟预测,当投加过剩或过少功能组物种的生物量时,食物网成熟度和稳定性发生变化,通过食物网模拟确定人为投加或捕捞量,促进生态系统顺向发展。若生态系统成熟度指标TPP/TR减小且接近于1,CI、SOI等指标升高,则认为生态系统成熟度和稳定性升高,生态系统向顺向演替趋势发展,则认为此时生态系统修复达到效果,修复完成[53]。
修复后经过一段时间,需要再次对修复生态系统进行评价反馈调节,继续通过调研分析、情景分析进行优化调控直至生态系统成熟度和稳定性升高,修复完成。

图3 修复后底栖生态系统调控优化技术路线图Fig. 3 Technical roadmap for regulation and optimization of benthic ecosystem after restoration
本研究于2018年在白洋淀进行大型底栖动物群落调研,根据大型底栖动物习性特征和Ecopath食物网模型建立了受损后大型底栖动物的恢复重建方案。对于受损大型底栖动物的恢复,其关键是突破以往仅以生境修复、优势种经验投加为主的简单大型底栖动物修复思路,将大型底栖动物作为整体食物网的一部分,通过食物网模拟计算,确定大型底栖动物需要恢复的关键物种和生态容量,并在恢复过程中不断优化调控,促进整体生态系统良性发展,防止生态系统的剧烈波动,为安全修复生态系统提供保障。调研发现,软体动物螺类、甲壳动物虾类和摇蚊幼虫为主的昆虫类为主要优势种。食物网模型计算结果确定了软体动物为主要关键功能组。结合大型底栖动物的习性特征,提出了软体动物螺类以人工投加为主,甲壳类和摇蚊幼虫以自然恢复为主的恢复方式。根据螺类投加工程经验值、调研生物量范围和生态容量,提出了软体动物螺类的生物投加量范围,建立了以调研分析、食物网模型情景分析模拟为主的过程优化调控方案。本研究提出的大型底栖动物恢复方案可为白洋淀扩大试点工程和其他湖泊大型底栖动物的恢复提供借鉴。
——以武汉紫阳湖为例

