17α-甲基睾酮对稀有鮈鲫肝脏脂质代谢的影响
刘少贞,杨琼,周俊亮,曹信瑜,陈越,刘青,王伟伟,宋晶
山西农业大学动物科学学院,太谷 030801
环境内分泌干扰物(environmental endocrine disrupting chemicals, EDCs)是一类存在于自然环境中的具有类激素效应的化学物质,EDCs可以干扰内源性激素的合成、分泌、转运、结合和分解,内源性激素是维持生物体动态平衡、繁殖、发育和完整性的重要组成物质。大量使用EDCs会损伤生物体的生殖、发育、免疫、内分泌和神经系统,导致内分泌代谢失衡[1-2]。EDCs作为一类潜在危害性物质,大部分存在于水体环境中,对水生生物的影响较大。17α-甲基睾酮(17α-methyltestosterone, MT)作为一种常见的外源雄激素,对自然界中的生物有机体有很大的威胁,甲基睾酮易在鱼类体内富集,从而发挥雄激素效应,对自然界鱼类的种群造成结构平衡失调,影响自然界鱼类的种群结构,因此我国从2001年开始禁止在水产养殖业使用甲基睾酮[3]。MT在环境中分布范围十分广泛,2010年在北京市区废水检测到MT,浓度为4.1~7.0 ng·L-1[4],调查研究发现,2011年南京污水处理厂的MT检测浓度为1.01~4.25 ng·L-1,在水体中检测到雄激素总浓度为145.20 ng·L-1[5]。Backe等[3]的研究表明,在废水处理厂附近的水域检测到高达250 ng·L-1的MT,太平洋西北部的废水处理设施的废水中检测到约2 000 ng·L-1的雄烯二酮。Rivero-Wendt等[6]研究发现,MT(99.9%纯度)对斑马鱼具有潜在的遗传毒性,同时会破坏鱼体内正常生物酶活性代谢。Liu等[7]研究发现,MT不同浓度的处理可以抑制鳜鱼血清中类固醇相关激素睾酮(T)和雌二醇(E2)的合成,并且影响与之合成相关的基因的mRNA表达,在一定浓度范围内会促进其生长发育速度,高浓度下则会抑制鳜鱼的生长。以上研究表明,MT对鱼类生长、代谢和发育等生理过程存在一定程度的影响,因此,笔者有意愿探究MT对稀有鮈鲫肝脏脂质代谢的影响,进而了解MT干扰鱼类肝脏脂质代谢的作用途径。
脂质代谢是生命有机体维持正常生命活动的必要代谢过程,而肝脏是动物进行脂质代谢的重要场所。研究表明,邻苯二甲酸二异辛酯(diisooctyl phthalate, DEHP)可以提高大鼠脂肪和肝脏中脂质代谢相关基因的mRNA表达水平[8-9],多溴联苯醚(poly brominated diphenyl ethers, PBDEs)和壬基酚(nonyl phenol, NP)等作为饲料添加剂饲喂三刺鱼(Gasterosteusaculeatus)和海鲷(Sparusaurata),两者体内脂质合成增加,脂质代谢相关基因表达显著升高[10]。小鼠长期处于DEHP环境下会导致其肝脏脂质代谢相关mRNA水平显著升高[11]。另外,外源性雄激素可以干扰褐鳟鱼肝脏细胞的雌激素信号通路,进而影响其脂质代谢相关基因表达量[12]。研究表明,三氯生(triclosan, TCS)处理小鼠会导致小鼠肝脏功能紊乱,诱发肝细胞的结构性病变[13]。低剂量抗生素和邻苯二甲酸酯(phthalic acid ester, PAEs)可以导致小鼠肝脏脂质代谢紊乱,引起脂肪沉积[14-16]。印度囊鳃鲶(Heteropeneustesfossilis)长时间处于氯化汞环境中,肝脏中的脂肪含量会显著升高[17]。鳢(Ophiocephalusstriatus)生存在低浓度Cd2+环境中,其肝脏组织中脂质含量显著降低,而在胡子鲶(Clarisfuscus)中则发现其肝脏中脂质含量显著升高[18-20]。高浓度的双酚A(bisphenol A, BPA)处理斑马鱼60 d可使得其肝脏脂质含量明显升高[21],17β-E2处理虹鳟鱼(Oncorhynchusmykiss)可以引起其肝脏脂质含量显著升高[22]。壬基酚(NP)处理的虹鳟鱼会显著增加虹鳟鱼肝脏脂质积累[23]。BPA会干扰大鼠脂质代谢和合成过程,引起肝脏中脂质积累加剧[24]。金枪鱼在多氯联苯(polychlorinated biphenyl, PCBs)处理下,肝脏出现明显的细胞结构变化,出现了大量的组织空泡化等现象[25]。BPA会导致大鼠肝细胞萎缩,细胞胞浆呈现弥散状,出现肉眼可见的脂滴[26]。二苯甲酮(benzophenone-3, BP-3)处理斑马鱼会导致其肝细胞出现排列高度紊乱、肝细胞分裂、细胞核肥大以及空泡化等现象出现,破坏肝脏的正常结构和生物学功能,引起脂质代谢紊乱[27]。氟化物可以对蟾蜍幼虫的肝脏组织造成损伤,引起肝细胞结构紊乱,进而导致肝脏脂质代谢与合成过程发生紊乱,降低肝脏中脂质合成过程[28]。综上所述,大量的EDCs会对动物肝脏脂质代谢造成不同程度的影响,在实验过程中我们发现稀有鮈鲫腹腔内存在大量脂肪沉积,因此我们推测MT也可能影响稀有鮈鲫肝脏脂质代谢过程。
脂质代谢过程是在多种酶的共同作用催化完成,其中主要包括乙酰辅酶A羧化酶(acetyl CoA-carboxylase, ACC)、脂肪酸合成酶(fatty acid synthase, FASN)、肉毒碱棕榈酰基转移酶(carnitine palmitoyl transferase, CPT)和3磷酸甘油酰基转移酶(glyceryl transferase 3 phosphate 1, GPAT)等。乙酰辅酶A(acetyl CoA)是脂肪酸从头合成的底物,主要来源是经ATP柠檬酸裂解酶(ATP citrate lyase,ACLY)催化柠檬酸产生的。在ACC的催化作用下,乙酰辅酶A会生成丙二酰辅酶A(malonyl-CoA, MA),ACC是脂肪酸从头合成的限速酶,它有2种亚型,ACC1和ACC2分别由acaca和acacb基因编码合成[28]。脂肪酸合成酶(fatty acid synthase, FAS)是脂肪酸合成的关键酶[29-30],脂肪酸合成酶(fatty acid synthase, FASN)是由7种不同功能的酶与1种酰基载体蛋白(acyl carrier protein, ACP)聚合而成的多酶复合体,它被fasn基因编码合成,主要在肝脏和脂肪组织中表达[31]。FASN是将小分子碳单元聚合成长链脂肪酸的关键酶[32-33],因此可以通过调控fasn基因表达以及FASN的酶活性从而达到调控脂肪酸的合成效率,进而改变脂肪沉积效率[34]。肉碱脂酰转移酶1(CPT1)是脂肪酸β氧化过程中的限速酶。不同组织中的CPT1的活性不同,其中肝脏中的CPT1活性最强[35-36]。GPAT1可以催化脂肪酸中间产物脂酰辅酶A和外源摄取的脂肪酸形成溶血磷脂酸,而后进一步在多种酶复合反应下形成甘油三酯,是甘油三酯形成过程中重要的催化酶[37]。
研究发现,雄激素睾酮可以直接影响脂肪细胞关键功能,作为一种外源调节物质参与脂质代谢过程[38-39]。甲基睾酮可以减少雌仓鼠胆汁酸的分泌,促进胆固醇和磷脂合成[40]。甲基睾酮可以干扰脂质代谢过程紊乱增加其腹部脂肪积累,促进极低密度脂蛋白(very low density lipoprotein, VLDL)合成,从而引起脂质代谢紊乱[41]。注射不同形式和水平的睾酮和睾酮类似物可以显著增加肝脏中甘油三脂含量,而甘油三酯是脂质代谢过程中的重要组成物质,其含量变化会导致动物肝脏脂质代谢紊乱,引起脂肪沉积[42-43]。
本文选择稀有鮈鲫作为试验动物,探究MT对稀有鮈鲫肝脏脂质代谢的影响,可以为评估水生环境健康风险提供实验指导,为阐明MT在稀有鮈鲫体内的作用机理提供理论依据,同时为推进稀有鮈鲫成为我国特有水生模式生物提供数据支持。
1 材料与方法(Materials and methods)
1.1 暴露实验
实验用鱼为实验室繁殖的同一批8月龄稀有鮈鲫,平均体长(4.34±0.39) cm;平均体质量:雌鱼(1.4840±0.3875) g,雄鱼(1.3228±0.3557) g。每天9:00投喂红虫1次,投喂量为试验鱼体质量的3%,每次投喂的饵料试验组鱼都会在5 min内摄食完毕,在其摄食1 h后待其排泄后进行换水加药。水温控制在(25±1) ℃,光∶暗周期为14 h∶10 h。实验设置对照组和处理组,MT分别为0、25、50和100 ng·L-1[44-45],每组3个重复,雌雄鱼分开,共24个水族箱,每个水族箱中60 L水,36尾稀有鮈鲫,采用半静水暴露试验[46]。换水为曝气和过滤24 h的自来水,温度与水族箱中水的温度保持一致;换水一半后在水族箱中加入相应量的MT溶液,使同一浓度实验组的所有水族箱中MT浓度保持一致。取样前1 d停止投饵。稀有鮈鲫暴露于MT中7、14和21 d,每缸随机选取8尾鱼,每个处理组共24尾鱼,12尾鱼摘取肝脏置于波恩试液中,用于石蜡组织切片观察,另外4尾鱼肝脏用Trizol研磨充分裂解后置于-80 ℃冰箱保存备用。
1.2 石蜡组织切片制备
取出固定24 h后的组织,放置于组织包埋盒中,自来水缓冲12~14 h,将组织包埋盒取出脱水(50%、70%、80%、95%和100%乙醇中进行),二甲苯进行透明处理;将透明好的组织浸蜡包埋(多次熬制去除大部分杂质的石蜡),用镊子把组织放于石蜡模具中,去除气泡,放于65 ℃烘箱中透蜡30~60 min,取出后除去组织旁边的气泡自然降温凝固;修整石蜡模块,使用切片机将组织石蜡切成6 μm厚的组织切片,H-E染色法染色,中性树脂胶封片处理,置于显微镜下观察肝脏组织病理学变化。
1.3 总RNA提取及cDNA第一链合成
参照RNAiso Plus试剂盒说明书对稀有鮈鲫肝脏组织样本进行总RNA的提取,1%琼脂糖凝胶电泳检测RNA完整性,Nanodrop ND1000分光光度计测定其纯度和浓度。取1 000 ng RNA,使用Prime ScriptTMRT Reagent Kit with gDNA Eraser (Perfect Real Time, TaKaRa)反转录合成cDNA第一链,获得cDNA模板,合成后于-80 ℃保存备用。
1.4 实时荧光定量PCR引物
参考文献[34, 47-48]中内参基因引物和脂质代谢相关基因引物(表1)。上海生工(Sangon Biotech)生物工程股份有限公司合成,为降低设计的引物的特异性以及引物二聚体和非特异性扩增产物对qRT-PCR的影响,对内参基因的普通PCR扩增产物进行凝胶电泳检测,凝胶电泳条带单一,清晰可见。
1.5 内参基因筛选
进行qRT-PCR之前,需要对稀有鮈鲫肝脏内参基因进行筛选,确定MT胁迫下稀有鮈鲫肝脏最稳定内参基因,选择β-actin、ef1a、gapdh、tuba1和g6pd作为候选内参基因,采用geNorm、NormFinder和BestKeeper这3种方法对内参基因数据进行分析评估。
1.6 实时荧光定量PCR
qRT-PCR检测肝脏脂质代谢相关基因(acaca、acacb、fasn、gpat1和cpt1a)相对表达量以及稀有鮈鲫qRT-PCR引物参考,送上海生工(Sangon Biotech)生物工程股份有限公司合成。
实验采用TB Premix Ex TaqTMⅡ(Tli RNase H Plus)试剂盒(TaKaRa,大连)进行qRT-PCR实验,每个组织设置3个重复,qPCR为20 μL体系(上下游引物各0.8 μL,cDNA模板2 μL(100 ng),荧光染料SYBR Green Ⅱ 10 μL,灭菌超纯水ddH2O补充至20 μL),混合均匀,置于冰上快速加到八连管中。PCR程序为95 ℃预变性3 min,95 ℃变性5 s、60 ℃退火30 s、72 ℃复性30 s;40个循环;熔解曲线(95 ℃ 10 s,52 ℃,0.5 ℃)。
1.7 甘油三酯含量测定
将肝脏组织从-80 ℃取出,按照组织质量与预冷磷酸缓冲液(PBS)体积1∶9的比例将肝脏研磨匀浆,匀浆过程中保持在冰上操作,同时保证组织研磨充分,确保组织中的蛋白充分释放,匀浆液呈均匀分布。制备好的10%组织匀浆液使用高速低温离心机离心,2 000 g·min-1、4 ℃、10 min,取上清液,弃掉下面的沉淀,使用全功能微孔板检测仪进行预试验,确定组织匀浆是否需要稀释,若浓度过高则稀释1倍~10倍,作为使用液测定其蛋白含量,使用甘油三酯试剂盒(GPO-PAP酶法,南京建成生物工程研究所)测定,ELISA方法测定其OD值,蛋白定量(TP)测定试剂盒(南京建成生物工程研究所)测定,BCA微板法校准蛋白浓度,根据说明书公式,乘以稀释倍数计算其最终样本浓度。
1.8 数据处理与分析
按照geNorm、NormFinder和BestKeeper这3种方法[49]的数据处理要求,对Cq值进行处理,对内参基因的表达稳定性进行评估,最终确定最合适的内参基因。RT-qPCR数据处理采用2-ΔΔCq,计算公式为F=2-ΔΔCq,ΔCq处理组=(Cq目的基因处理组平均值-Cq内参);ΔCq对照组=(Cq目的基因对照组平均值-Cq内参),ΔΔCq=ΔCq处理组-ΔCq对照组[50-51]。用SPSS 24.0软件One-way ANOVE方法分析组间差异,并利用GraphPad Prism 8.0制作统计分析表,用Duncan's多重比较来确定组间差异,P<0.05、P<0.01为差异显著。

表1 稀有鮈鲫基因引物合成序列Table 1 Sequence of primers for gene synthesis in G. rarus
2 结果(Results)
2.1 肝脏组织变化
2.1.1 MT对稀有鮈鲫雌鱼肝脏组织学影响
石蜡组织切片结果显示,对照组稀有鮈鲫雌鱼肝脏组织结构完好,细胞呈现正常肝细胞索,排列整齐,细胞核完好,结构完整(图1A、1A1和1A2);MT不同浓度处理组均出现了不同程度的组织结构损伤。25 ng·L-1MT处理稀有鮈鲫7 d,稀有鮈鲫肝脏组织细胞发生了细胞核溶解和细胞核偏移,细胞排列散乱,细胞间隙明显增大(图1B);延长处理至14 d,肝脏组织细胞出现大量水样变性、空泡化、核溶解以及肝细胞肿胀,胞浆内有大小不等的空泡等(图1B1);延长处理至21 d,组织细胞出现核溶解、肝血窦淤血以及细胞核固缩等情况,细胞不规则的散乱排列(图1B2)。50 ng·L-1MT处理稀有鮈鲫7 d,组织细胞结构出现空泡化、细胞核大量溶解,图中细胞明显变少(图1C);延长处理至14 d,组织细胞出现了大量的空泡化和肝脏组织细胞脂肪变性,细胞核溶解增多(图1C1);延长处理至21 d,组织大面积的细胞核消失,脂肪变性和颗粒细胞变性和肝血窦淤血,组织呈现明显的病理变化(图1C2)。100 ng·L-1MT处理稀有鮈鲫7 d,肝脏组织变化明显,组织出现了区域性坏死、肝细胞脂肪变性以及细胞核溶解(图1D);延长处理至14 d,肝脏颗粒变性、肝脂肪变性、细胞溶解、细胞缩小、细胞核偏移以及细胞结构散乱,组织的结构完整性被破坏(图1D1);延长处理至21 d,出现了肝颗粒细胞变性、核固缩、肝脂肪变化和肝血窦淤血等(图1D2)。
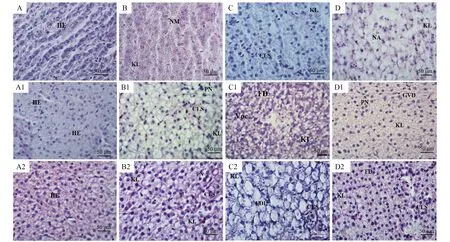
图1 稀有鮈鲫雌鱼肝脏组织病理变化注:A、B、C和D为17α-甲基睾酮(MT)(对照组、25、50和100 ng·L-1)处理雌鱼7 d肝脏组织;A1、B1、C1和D1为MT(对照组、25、50 和100 ng·L-1)处理雌鱼14 d肝脏组织;A2、B2、C2和D2为MT(对照组、25、50和100 ng·L-1)处理雌鱼21 d肝脏组织;HE为正常的 肝细胞,KL为细胞核溶解,NM为细胞核偏移,Voc为空泡化,NA为组织细胞坏死区域,PN为细胞核固缩,FDL为肝脂肪变性, GVD为颗粒空泡变性, CLS为肝血窦淤血,FD为脂肪变性。Fig. 1 The histopathological changes in the liver of female G. rarusNote: A, B, C, and D respectively represent the liver tissue changes of the control group, 25, 50, and 100 ng·L-1 17α-methyltestosterone (MT) treatment groups of female fish for 7 d; A1, B1, C1, and D1 respectively represent the liver tissue changes of the control group, 25, 50 and 100 ng·L-1 MT treatment groups of female fish for 14 d; A2, B2, C2, and D2 respectively represent the liver tissue changes of the control group, 25, 50 and 100 ng·L-1 MT treatment groups of female fish for 21 d; HE stands for normal nucleus; KL stands for nuclear lysis; NM stands for nuclear shift; Voc stands for vacuolation; NA stands for necrotic area of tissue cell; PN stands for nucleus pyknosis; FDL stands for fatty degeneration of liver; GVD stands for granular-vacuolar degeneration; CLS stands for congestion of liver sinusoids; FD stands for fatty degeneration.
2.1.2 MT对稀有鮈鲫雄鱼肝脏组织学影响
石蜡组织切片结果显示,对照组稀有鮈鲫雄鱼肝脏组织结构完好(图2A、A1和A2)。MT(25 ng·L-1和50 ng·L-1)处理稀有鮈鲫雄鱼7 d,肝脏组织出现大量的空泡化,细胞核溶解、肝脏细胞水泡变性以及肝血窦淤血(图2B和2C)。100 ng·L-1MT处理稀有鮈鲫7 d,肝脏组织细胞出现了颗粒空泡变性和肝脂肪变性(图2D)。25 ng·L-1MT处理稀有鮈鲫雄鱼14 d,稀有鮈鲫肝脏组织细胞排列散乱,肝细胞索出现排列不整齐,出现细胞溶解、细胞核溶解以及细胞核固缩等变化(图2B1)。50 ng·L-1MT处理稀有鮈鲫雄鱼14 d,组织细胞出现了大面积肝颗粒空泡变性和细胞核溶解,细胞呈现不规则形态(图2C1)。100 ng·L-1MT处理稀有鮈鲫雄鱼14 d,细胞核溶解,细胞部分溶解,细胞所占比例较少(图2D1)。25 ng·L-1MT处理稀有鮈鲫雄鱼21 d,组织细胞间存在较大的间隙,细胞与细胞之间联系散乱,存在细胞核溶解现象(图2B2),MT(50 ng·L-1和100 ng·L-1)处理稀有鮈鲫雄鱼14 d,组织细胞的变化明显,组织细胞颗粒变性严重,细胞出现水泡变性和细胞溶解现象(图2C2和2D2)。
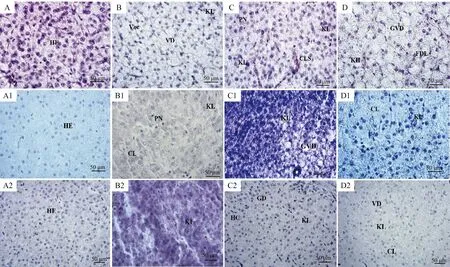
图2 稀有鮈鲫雄鱼肝脏组织病理变化注:A、B、C和D为MT(对照组、25、50和100 ng·L-1)处理雄鱼7 d肝脏组织;A1、B1、C1和D1为MT(对照组、25、50和100 ng·L-1) 处理雄鱼14 d肝脏组织;A2、B2、C2和D2为MT(对照组、25、50和100 ng·L-1)处理雄鱼21 d肝脏组织;HE为正常的肝细胞,KL为细胞 核溶解,Voc为空泡化,PN为细胞核固缩,HC为细胞核消失,FDL为肝脂肪变性,GVD为颗粒空泡变性,CL为细胞溶解,CLS为肝血窦淤血, VD为空泡变性,KH为核溢血,GD为颗粒变性。Fig. 2 The histopathological changes in the liver of male G. rarusNote: A, B, C, and D respectively represent the liver tissue changes of the control group, 25, 50, and 100 ng·L-1 MT treatment groups of male fish for 7 d; A1, B1, C1, and D1 respectively represent the liver tissue changes of the control group, 25, 50 and 100 ng·L-1 MT treatment groups of male fish for 14 d; A2, B2, C2, and D2 respectively represent the liver tissue changes of the control group, 25, 50 and 100 ng·L-1 MT treatment groups of male fish for 21 d; HE stands for normal nucleus; KL stands for nuclear lysis; Voc stands for vacuolation; PN stands for nucleus pyknosis; HC stands for disappearance of nucleus; FDL stands for fatty degeneration of liver; GVD stands for granular-vacuolar degeneration; CL stands for cell lysis; CLS stands for congestion of liver sinusoids; VD stands for vacuolar degeneration; KH stands for nuclear hemorrhage; GD stands for granular degeneration.
2.2 geNorm、NormFinder和BestKeeper方法分析内参基因稳定性结果
如geNorm结果所示,基因的相对表达量的平均稳定值(M)的大小依次为tuba1 (1.64)>g6pd(1.41)>gapdh(1.14)>β-actin和ef1a(0.92)。M值越小,则基因的稳定性越大,反之,则越不稳定。以M值以1.5为界限,若M>1.5,则基因在体内不能稳定表达(图3A)。NormFinder结果显示,内参基因M值分别为β-actin(0.314)、ef1a(0.354)、tuba1 (0.516)、g6pd(0.404)和gapdh(0.383),由此可知,5个候选内参基因稳定性大小排序为:β-actin>ef1a>gapdh>g6pd>tuba1,表明β-actin的表达稳定性最高,tuba1的表达稳定性最低(图3B)。BestKeeper分析结果显示,β-actin和gapdh的标准差和变异系数最低,β-actin的标准误差最小,β-actin的相关系数最大,其算数平均值和几何平均值都最小,其相对表达量较高。因此,基因的稳定性大小为β-actin>gapdh>ef1a>g6pd>tuba1(表2)。
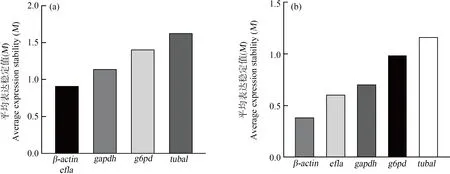
图3 MT处理稀有鮈鲫肝脏内参基因稳定性注:(a) GeNorm方法分析MT诱导稀有鮈鲫内参基因的表达稳定值(M); (b) Normfinder方法分析MT胁迫下稀有鮈鲫内参基因的表达稳定值(M)。Fig. 3 Stability of reference genes in liver of G. rarus exposed to MTNote: (a) shows GeNorm method analysis of expression stability value (M) of each internal reference gene of G. rarus induced by MT; (b) shows Normfinder method analysis of expression stability value (M) of each internal reference gene of G. rarus induced by MT.
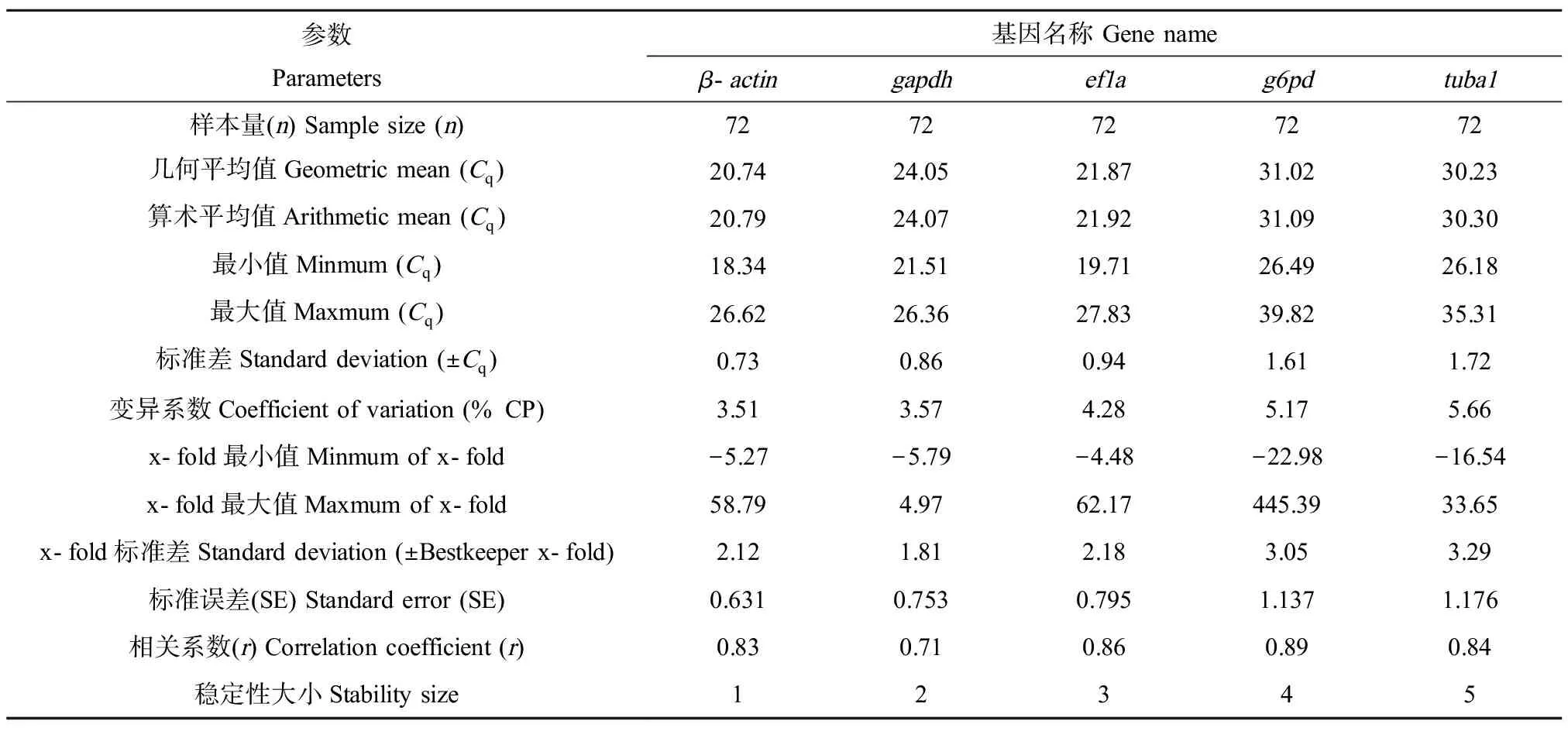
表2 Bestkeeper分析MT诱导下稀有鮈鲫内参基因表达稳定性Table 2 The expression stability of reference genes under MT exposure in G. rarus by Bestkeeper
根据上述3种方法对所有内参基因的分析评估,分别确定了不同的排序,在此基础上,对其进行加权平均值的计算,β-actin基因在3种方法中表达最稳定,可以确定为最稳定的基因。其余3个基因gapdh、g6pd和tuba1表达量和稳定性均不高,不推荐作为内参基因使用。内参基因稳定性综合排序为,β-actin>ef1a>gapdh>g6pd>tuba1,确定β-actin为最适合的内参基因(表3)。
2.3 MT对稀有鮈鲫肝脏acaca、acacb、fasn、gpat1和cpt1α mRNA相对表达量的影响
通过上述试验筛选出的最佳内参基因,对肝脏中5个脂质代谢相关基因做荧光定量PCR实验,确定基因在肝脏中的相对表达量的变化,进而根据肝脏组织学的变化联合基因相对表达量的变化情况分析MT对稀有鮈鲫肝脏脂质代谢的影响。
acaca基因mRNA表达量在50 ng·L-1浓度组处理7 d时雄鱼表达量显著升高(P<0.05,图4A1);雌鱼和雄鱼在100 ng·L-1处理7 d时都显著升高(P<0.05,图4A和4A1);延长处理至14 d时,雄鱼在3个处理组都表现为显著升高;延长处理至21 d,只有100 ng·L-1实验组雄鱼表达量显著下降(P<0.05,图4A1)。acacb基因mRNA表达量在处理7 d后,雌鱼在25 ng·L-1和50 ng·L-1组中的表达量显著降低(P<0.05,图4B),而雄鱼在100 ng·L-1处理组则表现为显著升高(P<0.05,图4B1);处理延长至14 d时,雄鱼在25 ng·L-1和50 ng·L-1处理组表达量显著降低(P<0.05,图4B1)。fasn基因mRNA表达量在处理7 d后,雌鱼在100 ng·L-1处理组表达量显著升高,而延长处理至21 d,25 ng·L-1处理组表达量显著升高(P<0.05,图4C)。雄鱼在处理7 d时,50 ng·L-1处理组fasn基因mRNA表达量显著升高,延长处理至14 d,3个处理组表达量均显著下降(P<0.05,图4C1)。3个处理组中雌鱼gpat1基因mRNA表达量并未发生显著变化(P>0.05,图4D);25 ng·L-1处理7 d后雄鱼表达量显著下降;延长处理至14 d,25 ng·L-1和50 ng·L-1处理组表达量显著下降;在处理21 d后,25 ng·L-1和50 ng·L-1处理组表达量显著升高,100 ng·L-1处理组表达量显著降低(P<0.05,图4D1)。cpt1α基因mRNA表达量在处理7 d后,25 ng·L-1处理组雌鱼表达量显著降低,50 ng·L-1和100 ng·L-1处理组显著升高;延长处理至14 d,25 ng·L-1和50 ng·L-1处理组显著升高,100 ng·L-1处理组显著降低(P<0.05,图4E)。雄鱼在25 ng·L-1和50 ng·L-1处理组处理7 d,表达量显著降低;延长处理至14 d,25 ng·L-1处理组显著升高;处理21 d时,50 ng·L-1和100 ng·L-1处理组表达量显著降低(P<0.05,图4E1)。
2.4 稀有鮈鲫肝脏甘油三脂含量变化
MT处理稀有鮈鲫雌鱼7 d,100 ng·L-1处理组中甘油三脂含量显著低于对照组;延长处理至21 d,50 ng·L-1处理组甘油三酯含量显著高于对照组(P<0.05,图5A)。MT处理稀有鮈鲫雄鱼14 d,50 ng·L-1处理组甘油三酯含量显著高于对照组,延长处理至21 d,3个处理组甘油三酯含量无显著变化(P>0.05,图5B)。
3 讨论(Discussion)
肝脏参与全身代谢活动,参与机体的脂质代谢和糖代谢等生命活动[52],脂质代谢是三大基本代谢之一,脂质种类繁多,可以作为能量代谢物质,而且作为细胞结构的支撑物质,脂质骨架结构是维持人体正常生命活动的重要组成物质[53]。脂质组学是检测脂质变化的重要手段,可以全面对环境中存在的脂质进行含量测定[54]。肝脏对脂质代谢的稳态对于所有生物都是至关重要的作用,肝脏在污染物积累和解毒过程中起着不可替代的作用。氟化物损伤中华蟾蜍幼体肝脏组织,降低肝脏中脂质合成以及脂质相关基因mRNA表达,造成蟾蜍幼体脂质代谢紊乱[28]。BPA显著抑制稀有鮈鲫肝脏acaca、acacb、fasn、gapt1和cpt1α基因的表达[34]。FAS是产生脂肪酸的主要细胞质酶[55],在肝脏中高度表达,是由fasn基因参与调控合成的,在所有生物膜中具有重要的作用,也是能量代谢的重要结构物质[56-58]。本研究表明MT干扰稀有鮈鲫肝脏中脂质代谢相关基因的mRNA表达,MT在稀有鮈鲫雌雄鱼肝脏内的作用方式存在一定差异,因此推测MT通过干扰脂质合成与代谢相关基因与酶类,影响脂质合成与代谢,进而损伤肝脏组织与细胞。
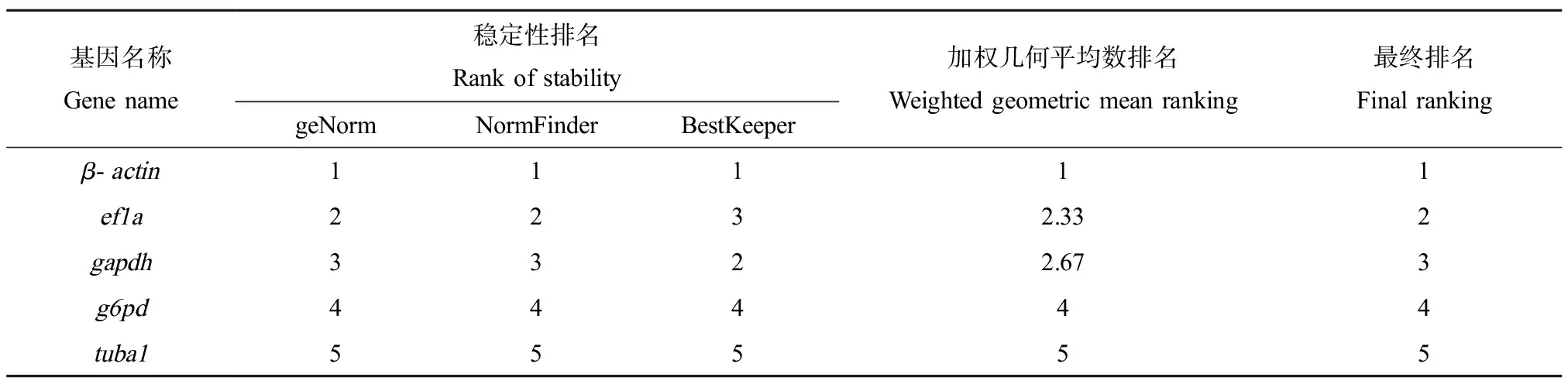
表3 MT诱导下稀有鮈鲫候选内参基因表达稳定性排名Table 3 Stability ranking of gene expression in G. rarus candidate reference under MT exposure

图4 稀有鮈鲫肝脏脂质代谢相关基因mRNA表达量变化注:A、A1为acaca基因在稀有鮈鲫雌鱼和雄鱼中的mRNA表达量;B、B1为acacb基因在稀有鮈鲫雌鱼和雄鱼中的mRNA表达量; C、C1为fasn基因在稀有鮈鲫雌鱼和雄鱼中的mRNA表达量;D、D1为gpat1基因在稀有鮈鲫雌鱼和雄鱼中的mRNA表达量;E、E1 为cpt1α基因在稀有鮈鲫雌鱼和雄鱼中的mRNA表达量,*表示显著(P<0.05),**表示显著(P<0.01),与对照组相比。Fig. 4 Changes of mRNA expression levels of genes related to lipid metabolism in liver of G. rarusNote: A, A1 show the mRNA expression of acaca gene in females and males of G. rarus; B, B1 show the mRNA expression of acacb gene in females and males of G. rarus; C, C1 show the mRNA expression of fasn gene in females and males of G. rarus; D, D1 show the mRNA expression of gpat1 gene in females and males of G. rarus; E, E1 show the mRNA expression of cpt1a gene in females and males of G. rarus; *indicates significant difference (P<0.05), **indicates significant difference (P<0.01), compared with the control.
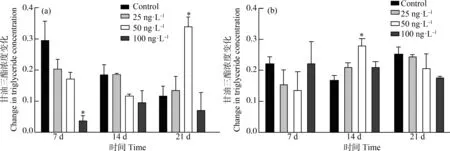
图5 MT对稀有鮈鲫肝脏甘油三酯影响注:(a)展示稀有鮈鲫雌鱼肝脏甘油三酯含量;(b)展示稀有鮈鲫雄鱼肝脏甘油三酯含量;*表示与对照组相比,差异显著(P<0.05)。Fig. 5 Effects of MT on triglyceride of liver in G. rarusNote: (a) shows the content of triglyceride in the liver of female G. rarus; (b) shows the content of triglyceride in the liver of male G. rarus; *indicates significant difference compared with the control (P<0.05).
石蜡组织切片结果表明,MT对稀有鮈鲫肝脏组织产生不可逆转的损伤,造成肝脏细胞大量的颗粒细胞变性、水泡变性、细胞溶解和肝脂肪变性等病理现象,ELISA结果显示,脂质代谢与合成相关酶表达量发生了变化,FASN、GPAT1和CPT1α等表达量的变化影响肝脏脂质沉积和甘油三酯代谢过程,从而引起了肝组织病变。MT会对主要在肝脏中合成的基因及其编码合成的蛋白产生影响,从而导致组织细胞发生病变,使其失去了部分维持正常代谢的功能,破坏了细胞的正常结构功能。研究表明,MT会引起雌仓鼠脂质代谢相关基因mRNA表达量发生变化,进而导致调控维持细胞结构的脂质结构和磷脂含量等发生变化,引起细胞结构的病变[40]。在研究MT对稀有鮈鲫的毒性效应时发现,MT会在一定浓度内发挥雄激素效应,当其浓度过高后会出现MT代谢转化为甲基雌二醇[59-61]。另外,在自然界中雄激素作用于雌激素受体,可能是由于雄激素在代谢过程中发生了芳香化,结合雌激素受体在体内发挥作用[62-63]。脂质结构是维持细胞正常形态的重要部分,其相关基因的表达量发生变化时,其编码的蛋白会随之发生变化,进而导致组织学病变。脂质代谢相关基因gpat1表达量发生变化,会影响其编码合成的蛋白表达,前人的研究表明,GPAT1可以调节脂质代谢过程中的磷脂酸合成[37],引起肝细胞的脂质分布及含量发生改变,引发脂肪变性和肝细胞颗粒变性。线粒体损伤是诱导肝细胞病变的主要原因,与肝脏脂质代谢紊乱有关,可以通过外部药物诱导,抑制线粒体脂肪酸氧化酶影响脂质代谢过程,从而引起肝脏细胞的空泡化[64]。CPT1是线粒体内的重要限制酶,因此,其表达量的变化会引起组织细胞结构的变化。在罗非鱼日粮中加入铜元素,可以严重破坏肝脏组织结构,表现出明显的肝脏细胞组织结构发生脂肪变性和浊肿变性[65]。卡马西平(carbamazepine, CBZ)引起脂质代系紊乱可能是由线粒体功能障碍引起[66]。在研究TCS对斑马鱼的影响时发现,TCS可以对斑马鱼的脂质代谢过程产生影响[67]。脂质代谢紊乱可以诱导肝脏细胞空泡化和脂肪变性等[68-70]。本研究结果表明,MT处理稀有鮈鲫7~21 d,肝脏组织细胞发生了空泡化和肝脂肪细胞变性以及细胞核溶解等现象,因此推测MT通过干扰cpt1a和gpat1基因表达引起稀有鮈鲫肝脏脂质代谢过程紊乱,进而致使肝脏组织学发生病变。
Bhattacharjee等[71]的研究表明,acaca和acacb基因编码ACCα和ACCβ这2个蛋白,在脂质代谢过程中发挥重要的作用。McClintick等[72]研究发现,在饲料中缺乏VA会导致小鼠肝脏中fasnmRNA表达量显著降低;VA可以显著提高FAS酶活性,从而提高fasnmRNA的表达量,促进肝脏脂质代谢的合成和积累[73]。紫苏和鱼油显著降低大鼠肝脏脂肪酸合成酶基因的mRNA表达[74]。HNF1α可以抑制肝脏脂质合成与代谢,促进脂肪分解,并促进胰岛素信号通路的激活[75]。肝脏miR-146a的过表达可以促进脂肪酸的氧化代谢,进而改善了葡萄糖和胰岛素耐受性以及肝脏中脂质的积累[76]。斑马鱼长期暴露在啶酰菌胺下,可以对斑马鱼肝脏造成损伤,啶酰菌胺可以显著降低肝脏中甘油三脂含量以及FAS和ACC酶活性,引起脂质代谢紊乱[77]。ZnO诱导鲫鱼(Carassiusauratusauratus)肝脏产生自由基,大量自由基会破坏细胞脂质结构,引起肝细胞结构功能异常,从而引起脂质代谢紊乱[78]。这说明了内分泌干扰物可以干扰脂质代谢过程,引起脂质合成和分解异常,对水生动物的肝脏造成一定程度的损伤。这与本研究结果相似,MT处理稀有鮈鲫的过程中,随着时间的延长,造成肝脏的脂质代谢异常以及相关基因mRNA表达量的变化,从而调控脂质代谢相关酶的合成和分解,造成肝脏脂质沉积。
acaca基因编码ACC1蛋白主要在肝脏和脂肪中表达,是参与脂肪酸的从头合成过程的重要酶,其催化产生的MA可促进脂肪合成和储存组织中脂肪酸[79]。acacb基因编码线粒体外膜蛋白ACC2,ACC2催化产生的MA可抑制CPT1,而CPT1是将长链脂肪酸转移进入线粒体的必需酶,因此,ACC2在抑制脂肪酸的氧化分解供能过程中发挥主要作用[80]。研究表明,在小鼠的肝脏细胞中,CPT1表达量的增加使甘油三酯的积累降低35%,同时也引起其分泌量降低了60%。同时体内试验也表明,CPT1表达量的升高导致瘦弱和肥胖小鼠中甘油三酯含量显著降低[81]。本研究结果显示,100 ng·L-1MT处理稀有鮈鲫雌鱼7 d,甘油三酯含量显著下降,而cpt1a基因mRNA表达量显著升高。这与前人研究结果相同。同时,acacb编码合成的ACC2(ACCβ)在催化过程中会产生MA,可以抑制CPT1的产生,而GPAT1会竞争性抑制CPT1,而CPT1是β-脂肪酸氧化过程中的限速酶,因此,CPT1酶的基因表达量会与acacb和gpat1基因的mRNA表达量成反比。RT-qPCR结果显示,acacb基因表达量与cpt1α基因表达量在雄鱼中呈负相关,但是gpat1基因表达量在50 ng·L-1MT处理14 d时,出现了相反情况,这表明MT对稀有鮈鲫产生催化作用改变其原有的作用方式,调节cpt1a基因的表达方式发生了改变,促使其表达量显著升高。FASN表达水平的升高能够显著地增加甘油三酯在体内的沉积而导致肥胖[27, 82]。MT处理稀有鮈鲫后,雌雄鱼的fasn基因mRNA表达量呈现出不同的变化趋势,雌鱼在高浓度MT处理7 d和低浓度MT处理21 d,其mRNA相对表达量显著升高。中浓度处理雄鱼7 d,fasn基因表达量显著升高,处理14 d时,所有处理组均表现为显著下降趋势,结合甘油三脂含量的变化趋势可知,fasn基因mRNA表达量与甘油三酯含量呈负相关,因为FASN是脂质代谢合成过程中的关键酶,这表明MT会降低稀有鮈鲫雄鱼肝脏FASN的合成,从而降低机体对甘油三脂的代谢,使得雄鱼肝脏甘油三酯含量显著升高。
GPAT1是催化甘油三脂形成过程中的重要酶,GPAT1主要在肝脏中表达,GPAT1位于线粒体中,参与脂肪酸的合成和酯化过程,并且可以竞争性地抑制CPT1的合成,从而在脂肪酸含量增加的情况下,确保脂肪酸进行酯化反应。同时,GPAT1参与甘油三酯和磷脂的从头合成过程,可以通过调控磷脂和甘油二酯的水平来调控脂质代谢信号[37, 83]。本研究发现,MT处理组雌鱼肝脏gpat1基因均未变化。MT处理雄鱼7 d,25 ng·L-1处理组gpat1表达量显著下降;延长处理时间至14 d,25 ng·L-1和50 ng·L-1雄鱼处理组表达量显著下降;处理21 d,25 ng·L-1和50 ng·L-1处理组表达量显著升高,100 ng·L-1处理组表达量显著降低。MT处理14 d,稀有鮈鲫雄鱼3个处理组fasn基因mRNA表达量均显著下降,而雌鱼基因表达量无显著变化。这说明,在MT处理下,雌鱼并没有受到影响,而雄鱼在中低浓度处理组随着时间的延长,所受影响呈现显著性(P<0.05)。这一结果不同于前人的研究,由此结果推测,MT可以通过对肝脏脂质代谢合成过程中相关基因mRNA表达量的调控,改变脂质代谢过程中相关酶活性的表达,进而改变肝脏脂质的沉积效率。前人的研究表明,体内雄激素在脂肪组织中的代谢途径呈性别特异性[41],外源性激素对稀有鮈鲫脂质代谢与合成的影响存在性别依赖性[34]。因此推测,MT在稀有鮈鲫雌雄鱼肝脏内代谢途径存在性别差异,在稀有鮈鲫雌鱼肝脏内MT被芳香化酶芳香化成雌激素,发挥雌激素作用。因此,MT对稀有鮈鲫脂质代谢影响存在性别差异性。
综上所述,MT可以通过影响肝脏脂质代谢相关基因mRNA表达量以及脂质合成代谢相关酶类活性,进而干扰稀有鮈鲫体内肝脏脂质代谢过程,从而调控相关脂质的合成,干扰稀有鮈鲫肝脏脂质合成与甘油三酯水平,造成肝脏脂质代谢异常,损伤稀有鮈鲫肝脏组织及细胞形态。稀有鮈鲫肝脏脂质代谢相关基因gpat1和cpt1a对环境中MT较为敏感,可以作为检测EDCs的有效生物标志物。我们将进一步深入研究MT对稀有鮈鲫脂肪组织脂质代谢相关转录因子影响及其调控机制,试图阐明MT对稀有鮈鲫脂质代谢影响机制。

