非小细胞肺癌中IGF1、IGFBP2表达与预后的相关性分析
闫明 程纪伟 孙海波 郑燕 邢文群
肺癌是一种源于支气管黏膜的高度恶性肿瘤,80%左右的肺癌患者为非小细胞肺癌,其早期症状不典型,多数患者确诊时已为晚期[1-2]。尽管目前肺癌治疗方法不断进步,更加个体化和多样化,但其疗效和预后仍不理想,严重威胁患者的生命健康[3]。寻找与非小细胞肺癌发生发展及预后相关的分子标记物,可能对预后改善有重要意义。胰岛素样生长因子1(insulin-like growth factor 1,IGF1)可通过与其受体特异性结合,参与肿瘤细胞分化[4]。胰岛素样生长因子结合蛋白2(IGF binding protein 2,IGFBP2)是一种潜在的肿瘤相关抗原,在多种人类恶性肿瘤患者中均存在表达异常[5-6]。本研究通过免疫组织化学法检测非小细胞肺癌组织IGF1、IGFBP2蛋白表达,探讨二者与非小细胞肺癌临床病理特征及预后的关系,以期为非小细胞肺癌治疗提供新靶点。
资料与方法
一、一般资料
选取2015年2月~2016年2月于本院就诊且经胸部影像学及组织病理学等确诊的226例非小细胞肺癌患者癌组织为非小细胞肺癌组,患者年龄49~76岁,平均年龄(60.48±9.26)岁,男136例(60.18%),女90例(39.82%);选取其癌旁正常组织为癌旁对照组。
纳入标准:①非小细胞肺癌患者符合诊疗规范[7];②术前未接受过放疗、化疗等辅助治疗;③病历资料齐全;④患者年龄>18岁,符合伦理学标准,且所有受试者均自愿参加,同时签署知情同意书。排除标准:①有严重肝功能异常、其他感染性疾病或肾功能异常者;②有精神障碍或认知功能障碍者;③伴有其他恶性肿瘤或有恶性肿瘤史者;④孕妇或哺乳期妇女。
二、主要试剂与仪器
IGFBP2抗体(货号:bs-1108R)购自上海科敏生物科技有限公司;IGF1抗体(货号:SPC-699D)购自加拿大StressMarq公司;通用型免疫组化试剂盒(货号:ZK-SP10449)购自深圳子科生物科技有限公司。
三、研究方法
1 一般资料收集 收集整理非小细胞肺癌患者一般资料,主要包括性别、年龄、吸烟史、肿瘤大小、肿瘤位置、淋巴结转移、组织分化程度、TNM分期。
2 治疗方案 所有患者术后1周内接受化疗,21 d为一个周期,共4个周期。化疗方案分别为:吉西他滨+奈达铂、吉西他滨+奥沙利铂、培美曲塞+奈达铂、多西他赛+奈达铂、多西他赛+顺铂。患者均未接受抗血管生成、放疗及靶向药物治疗。
3 IGF1、IGFBP2蛋白表达检测 采集非小细胞肺癌患者术中癌组织及癌旁正常组织,10%甲醛固定标本后,进行梯度脱水、透明、浸蜡、包埋及切片(厚度4 μm)。用免疫组织化学法检测癌组织及癌旁正常组织IGF1、IGFBP2蛋白表达水平。按照通用型免疫组化试剂盒说明书中操作步骤进行操作,用PBS代替一抗作阴性对照,用已知阳性的肺组织切片作阳性对照。随机选10个视野于200倍镜下进行观察,计数100个细胞,以胞浆内出现棕黄色或棕褐色定义为阳性细胞,采用半定量法进行评分。按染色强度计分:棕褐色、棕黄色、浅黄色、无色分别为3分、2分、1分、0分;按阳性细胞比例计分:阳性细胞比例1/3以下、1/3~2/3、2/3以上分别为1分、2分、3分。根据二者计分乘积为最终得分进行判定,判定标准为:≤2分为低表达,>2分为高表达。
4 随访 采用电话、门诊或入户方式随访5年,平均术后第1年每月1次,术后第2年每3个月1次,2年后每半年1次。其生存期从手术之日起计算,随访时间截至2021年2月。
四、统计学分析
采用SPSS 23.0统计分析数据,计数资料以例数(n)或百分率(%)表示,组间比较行Pearson卡方检验;采用Spearman法分析非小细胞肺癌患者癌组织IGF1与IGFBP2蛋白表达的相关性;采用Kaplan-Meier法分析非小细胞肺癌患者癌组织IGF1、IGFBP2蛋白表达与预后的关系,用Log-rank进行生存曲线显著性检验,检验水准为α=0.05;采用多因素COX回归分析影响非小细胞肺癌患者预后的因素。P<0.05代表差异有统计学意义。
结 果
一、非小细胞肺癌组和癌旁对照组IGF1、IGFBP2蛋白表达水平比较
非小细胞肺癌组IGF1、IGFBP2蛋白高表达率高于癌旁对照组,差异有统计学意义(P<0.05)(见表1、图1)。

表1 非小细胞肺癌组和癌旁对照组IGF1、IGFBP2蛋白表达水平比较[n(%)]
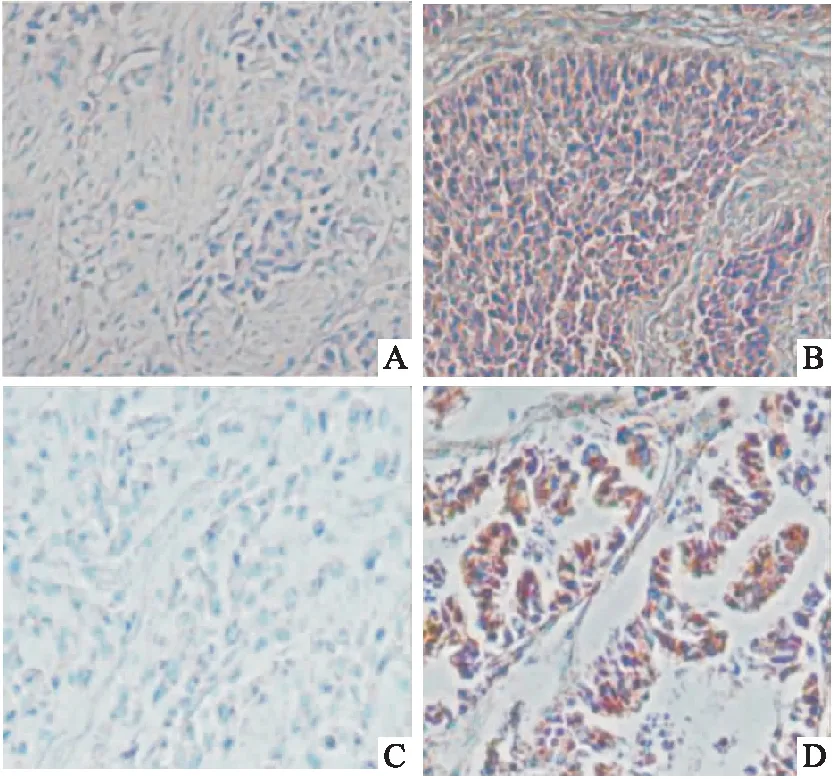
图1 非小细胞肺癌组和癌旁对照组IGF1、IGFBP2蛋白表达情况(免疫组化,×200)(A:癌旁对照组IGF1蛋白低表达;B:非小细胞肺癌组IGF1蛋白高表达;C:癌旁对照组IGFBP2蛋白低表达;D:非小细胞肺癌组IGFBP2蛋白高表达)
二、非小细胞肺癌患者癌组织IGF1、IGFBP2蛋白表达与临床病理特征的关系
根据非小细胞肺癌患者癌组织中IGF1、IGFBP2蛋白是否高表达,将患者分为IGF1低表达组60例、IGF1高表达组166例;IGFBP2低表达组69例、IGFBP2高表达组157例。结果显示,非小细胞肺癌患者癌组织IGF1、IGFBP2蛋白表达与性别、年龄、吸烟史、肿瘤位置无关(P>0.05),与肿瘤大小、淋巴结转移、组织分化程度、TNM分期有关(P<0.05)(见表2)。
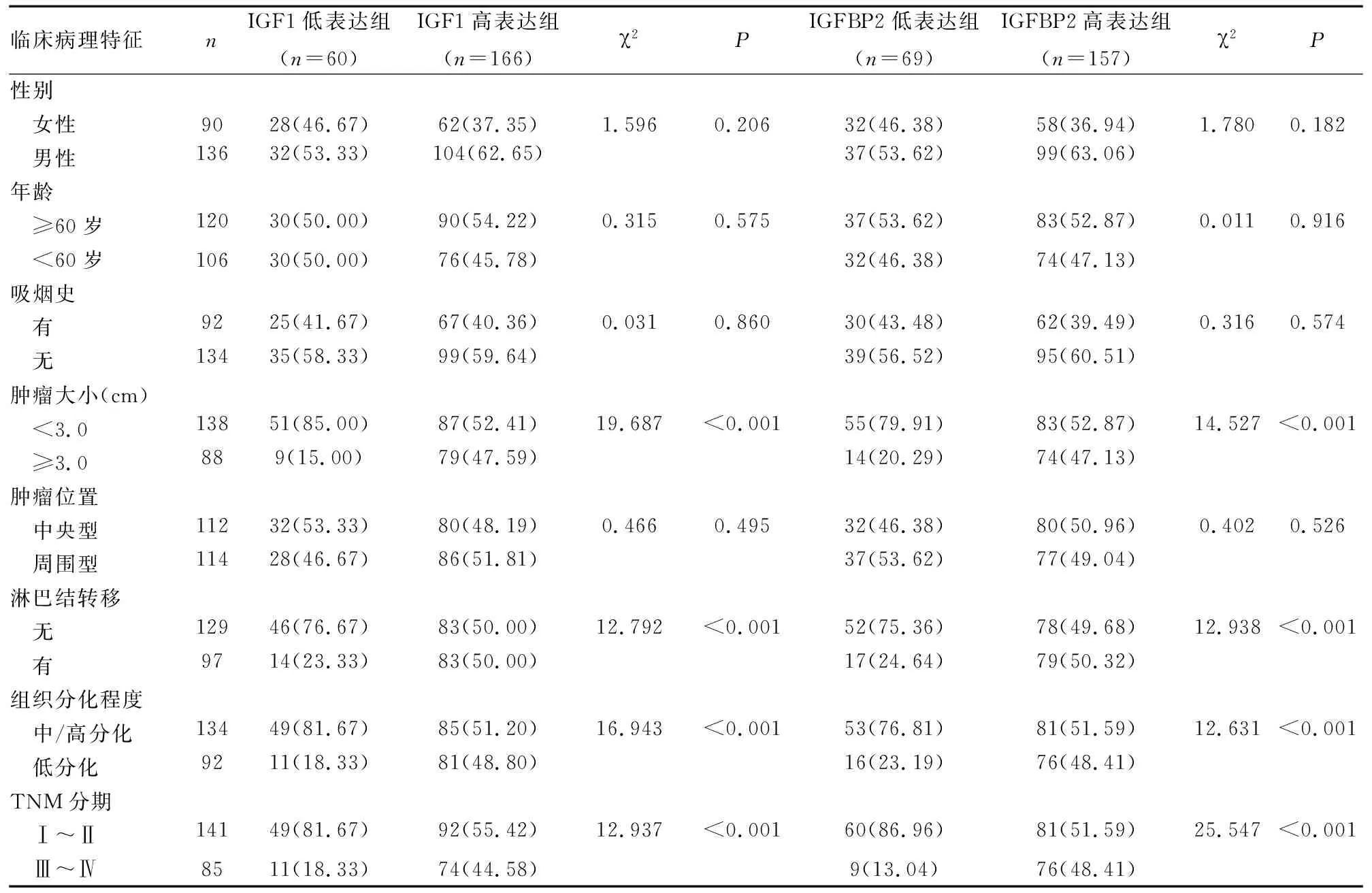
表2 非小细胞肺癌患者癌组织IGF1、IGFBP2蛋白表达与临床病理特征的关系[n(%)]
三、非小细胞肺癌患者癌组织IGF1与IGFBP2蛋白表达的相关性
Spearman分析结果显示,非小细胞肺癌患者癌组织IGF1与IGFBP2蛋白表达呈正相关(r=0.472,P<0.05)(见表3)。

表3 非小细胞肺癌患者癌组织IGF1与IGFBP2蛋白表达的相关性(n)
四、非小细胞肺癌患者癌组织IGF1、IGFBP2蛋白表达与预后的关系
采用Kaplan-Meier法分析非小细胞肺癌患者癌组织IGF1、IGFBP2蛋白表达与患者生存率的关系,结果显示IGF1高表达患者五年生存率(33.33%)低于IGF1低表达患者五年生存率(69.23%),差异有统计学意义(P<0.05,χ2=10.051);IGFBP2高表达患者五年生存率(29.41%)低于IGFBP2低表达患者五年生存率(73.33%),差异有统计学意义(P<0.05,χ2=16.397)(见图2、图3)。
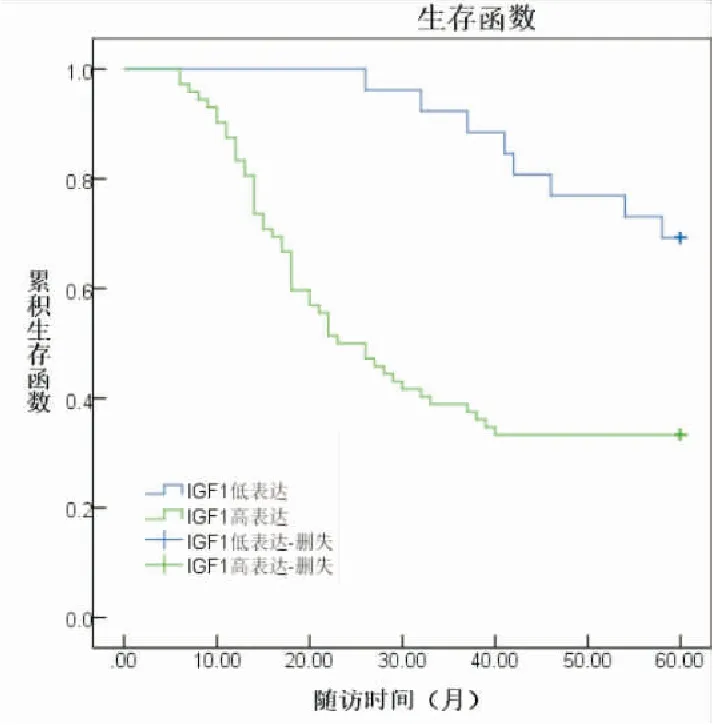
图2 非小细胞肺癌患者癌组织IGF1蛋白表达与预后的关系

图3 非小细胞肺癌患者癌组织IGFBP2蛋白表达与预后的关系
五、影响非小细胞肺癌患者预后的多因素COX回归分析
以非小细胞肺癌患者是否发生死亡(是=1,否=0)为因变量,以IGF1(高表达=1,低表达=0)、IGFBP2(高表达=1,低表达=0)、肿瘤大小(≥3.0 cm=1,<3.0 cm=0)、淋巴结转移(有=1,无=0)、组织分化程度(低分化=1,中/高分化=0)、TNM分期(Ⅲ~Ⅳ期=1,I~Ⅱ期=0)为自变量进行多因素COX回归分析,结果显示,IGF1高表达、IGFBP2高表达、TNM Ⅲ~Ⅳ期是影响非小细胞肺癌患者死亡的独立危险因素(P<0.05)(见表4)。
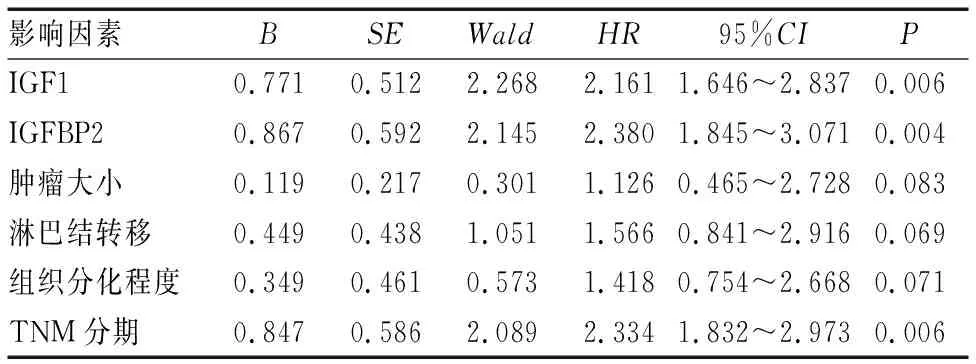
表4 影响非小细胞肺癌患者预后的多因素COX回归分析
讨 论
非小细胞肺癌是肺癌中常见的组织类型,其具体的分子机制尚未完全阐明,是由多基因参与的复杂过程,其中细胞周期紊乱是引发非小细胞肺癌的重要因素[8]。正常细胞周期受内外信号的调控,以维持其正常的细胞增殖、凋亡,然而癌细胞为非正常凋亡机制,可避免程序性死亡[9]。IGF作为调节细胞分裂的重要因子,在细胞增殖、凋亡及分化中起重要作用,其功能障碍或失调会对机体生长发育及组织稳态产生严重的影响,均可能与肿瘤的发生发展有关[10-11]。
IGF1是IGF家族的一员,主要作为一种生长激素在几乎所有细胞中发挥生物学效应,可通过调控癌细胞对内皮的粘附性以及血管生成,影响肿瘤侵袭能力[12]。此外IGF1也可通过诱导细胞内癌基因的表达,启动细胞增殖分裂、抑制细胞凋亡[13]。IGFBP2可通过调节IGF的量,来影响IGF系统,增强IGF参与代谢及有丝分裂等方面的作用,进而影响肿瘤生长[14]。IGFBP2也可不经过IGF系统影响肿瘤细胞,其主要通过促进或抑制某些肿瘤相关因子的表达水平,影响肿瘤细胞迁移、侵袭和凋亡[15]。本研究结果显示,非小细胞肺癌患者癌组织IGF1、IGFBP2蛋白高表达率高于癌旁正常组织,且非小细胞肺癌患者癌组织中二者表达呈正相关。孙宇等[16]研究结果中,IGF1在肺鳞癌患者癌组织中呈高表达,Wang等[17]研究结果显示非小细胞肺癌患者癌组织中IGFBP2表达上调,与本研究IGF1、IGFBP2表达趋势一致。提示IGF1、IGFBP2可能通过高表达,影响非小细胞肺癌的发生发展。进一步分析癌组织IGF1、IGFBP2表达与临床病理特征及预后的关系发现,IGF1、IGFBP2与非小细胞肺癌患者性别、年龄、吸烟史、肿瘤位置无关,而与肿瘤大小、淋巴结转移、组织分化程度、TNM分期有关,且IGF1、IGFBP2高表达患者5年生存率较低。提示IGF1、IGFBP2可能与非小细胞肺癌的迁移、侵袭等行为密切相关,高水平的IGF1、IGFBP2可能会增加细胞内有丝分裂信号传导、增加细胞内DNA损伤,从而增加恶性转化的发生,加速患者病情发展,不利于患者预后。然而陶绍能等[18]研究中IGF1与淋巴结转移等无关,造成此结果的差异可能与选取样本量有关,仍需进一步验证。此外,本研究采用多因素COX回归分析影响非小细胞肺癌患者预后的因素,结果显示,IGF1、IGFBP2均是影响患者死亡的独立危险因素。提示临床工作中可对IGF1、IGFBP2表达水平给予密切关注,以便及时调整患者治疗方案,改善不良预后。
综上所述,IGF1、IGFBP2高表达与非小细胞肺癌发生发展及预后密切相关,可为化疗方案的确定、提高患者诊疗效果提供新思路,同时对IGF的研究可能为今后寻找新的肿瘤标记物和治疗靶点起到积极的推动作用。然而本研究同时存在一定的不足之处,IGF1、IGFBP2蛋白表达可能与肿瘤类型、患者机体状态等多方面因素有关,有待今后纳入更多样本,进行多层次、多中心的研究来进一步证实。

