EBV相关平滑肌肿瘤1例
杨小丰,王 琨,陈志鸿,郭 伟,薛 菊,张碧溪,李艳春
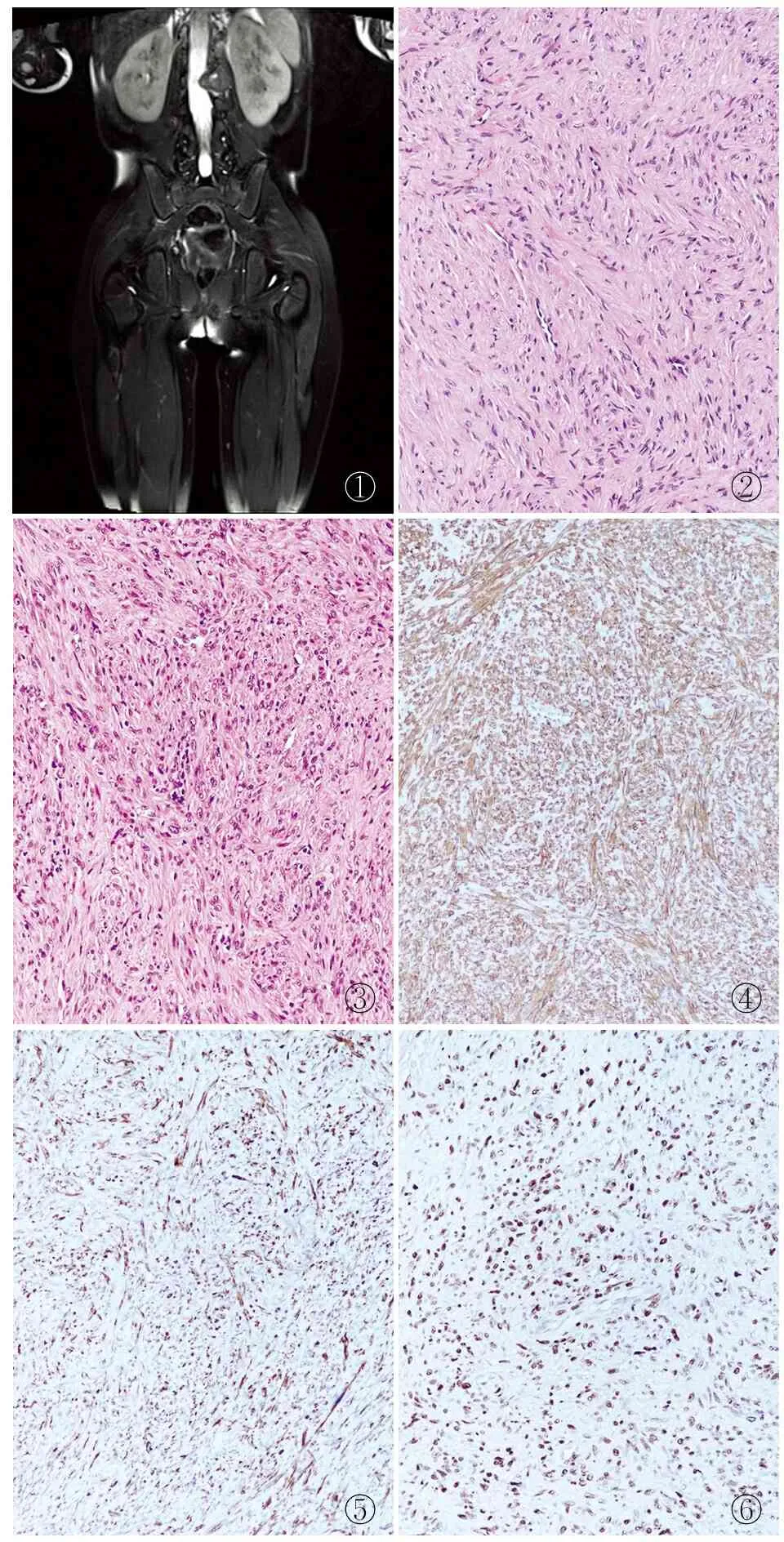
患者女童,6岁,1年前无明显诱因出现双侧髋关节阵发性疼痛,以晨起为甚,下午及晚间稍好转,疼痛每次持续1~2 min,卧床休息可缓解。腰椎MRI示:L2椎体左侧附件区溶骨性骨质破坏以及软组织肿块(图1)。遂行肿块切除术并送病理检查。
①②③④⑤⑥
病理检查眼观:灰白组织多块,大小共7.0 cm×7.0 cm×2.0 cm,部分为骨组织。镜检:瘤细胞束状排列,胞质嗜酸性,细胞核长杆状(图2),伴轻度不典型性,未见明确核分裂及肿瘤性坏死,可见原始的圆形细胞,瘤细胞之间可见多灶炎症细胞浸润(图3),周边可见骨质破坏。免疫表型:肿瘤细胞SMA(图4)、Actin、H-Cald(图5)均弥漫(+),CK、CD117、DOG1、desmin、S-100、SOX-10、CD56、SATB2、MDM2、ALK、MyoD1、Myogenin、STAT6均(-);Ki-67增殖指数<1%,EBER原位杂交分子检测(+)(图6)。
病理诊断:EB病毒相关平滑肌肿瘤(Epstein-Barr virus-associated smooth muscle tumor, EBV-SMT)。
讨论EBV-SMT是指发生在免疫抑制背景下,与EB病毒感染相关的平滑肌肿瘤。第4版WHO将此类疾病定义为EB病毒相关的平滑肌肉瘤。随着其相关病例报道增多,发现其生物学行为与病理形态学特征不呈正相关,与平滑肌肉瘤相比,其侵袭性和转移性低;而在具有良性病理形态学特征的病例中,偶有弥散侵袭性的现象。由于其独特的病理特征和不确定的恶性潜能,很难将其归类为平滑肌瘤或平滑肌肉瘤,第5版WHO将此类疾病命名为EBV-SMT。该肿瘤作为肾移植和免疫抑制的并发症,于1970年由Pritzker等[1]首次报道;1995年有两位学者指出上述肿瘤与EB病毒感染有关[2-4]。
目前EBV-SMT文献报道10篇,大多为个案报道。该肿瘤包含3种亚型:HIV相关性SMT、移植术后相关性SMT及先天性免疫缺陷综合征相关性SMT[4]。3种亚型发病占比分别为49%、45%、6%[5]。其最常见的发病部位分别是:中枢神经系统、肝脏、肺、喉[2,5]。该肿瘤可以在同一患者多部位发生,3种亚型多部位发生的概率分别是71%、54%、29%[5]。EBV-SMT总体发病中位年龄30岁(年龄范围1~66岁),女性多见(55%~67%),主要临床表现是疼痛和相关器官功能障碍[5]。病理特征:眼观,肿瘤直径0.7~21.0 cm,平均3.7 cm,切面灰白色,质硬或质韧,与周边组织界限清[5]。镜检:梭形细胞束状排列,胞质丰富、嗜酸性,核呈长杆状;HIV-SMT瘤细胞伴轻~中度非典型性,可见核分裂象和坏死;瘤细胞中见原始的圆形细胞突然或逐渐向平滑肌分化及淋巴细胞浸润[4]。免疫表型:瘤细胞SMA和H-Cald弥漫阳性,desmin灶阳性,EBER原位杂交呈阳性[4]。
目前,EBV感染诱导免疫缺陷患者平滑肌肿瘤转化的机制仍不清楚[6]。因为平滑肌细胞通常不是EBV感染的目标,免疫抑制可能允许EBV异常进入平滑肌细胞,这可能导致潜在的感染和随后的肿瘤转化[7-8]。本例患者为6岁儿童,病灶位于L2椎体左侧附件区,无HIV感染、移植手术史。基因检测显示ITK基因及RTEL1基因致病性证据不充分。ITK基因编码在T细胞中表达的细胞内酪氨酸激酶,该蛋白包含sh2和sh3两个结构域,它们通常存在于细胞内激酶中,被认为在T细胞增殖和分化中起作用[9]。该基因突变可以导致淋巴增殖综合征1型的发生,淋巴增殖综合征1型是一种罕见的免疫缺陷疾病,临床表现为极易感染EB病毒[10]。RTEL1基因编码端粒长度调节酶1,该酶作为一种DNA解旋酶蛋白,可以分解各种DNA二级结构,在端粒维持和3R进程(DNA复制、损伤和修复过程)中发挥至关重要的作用。该基因突变易导致先天性角化不良的发生,此病变临床表现为出生后生长发育迟缓、免疫缺陷等。因此目前尚无明确的证据充分证明患者存在先天性免疫缺陷综合征。
EBV-SMT是一种罕见的肿瘤,诊断时需与以下疾病相鉴别。(1)炎性平滑肌肉瘤:一种显示平滑肌分化的间叶源性的恶性肿瘤,伴有明显的炎症细胞浸润,遗传学显示近单倍体表型[11];而本例除平滑肌分化、明显的淋巴细胞浸润的特点外,还具有原始的圆形细胞区域突然或逐渐向平滑肌方向分化的特征,且EBER原位杂交阳性,故可排除。(2)胃肠道外间质瘤:其瘤细胞为梭形细胞,可呈编织状排列,免疫组化标记CD117和(或)CD34阳性,DOG-1阳性;而本例瘤细胞中可见原始的圆形细胞突然或逐渐向平滑肌方向分化及淋巴细胞浸润,CD117、DOG-1阴性,EBER原位杂交阳性,故可排除。(3)神经鞘瘤:以神经鞘细胞为主要成分,可有两种不同的形态结构,一种是富于细胞的Antoni A区,由梭形细胞构成,可见Verocay小体;另一种是细胞稀疏、排列无序的Antoni B区,免疫组化标记S-100阳性。而本例无上述两种形态结构,且S-100阴性,故可排除。
EBV-SMT罕见,目前尚无明确的治疗方案。干细胞移植对治疗伴有GATA2缺陷的EBV-SMT可完全消退[12]。同时手术治疗、降低免疫抑制、抗病毒治疗、mTOR抑制剂也可以取得一定的疗效[4]。由于组织学特点如细胞核分裂象、坏死、细胞异型性与肿瘤预后的相关性差,该肿瘤被认为是恶性潜能未定的肿瘤。肿瘤进展主要与患者的免疫状况相关。患者死亡的原因多为免疫抑制导致的严重感染,而非肿瘤进展[4]。本例患者随访3个月,目前健康状况良好。

