肠型胃腺癌组织中A3G的表达及其临床病理学意义
冯昌银,郑巧灵,黄建平,陈 瑚,连渊娥,杨映红
胃癌是全球重大公共卫生问题,我国是全球胃癌发病率最高的国家,其年龄标准化的5年存活率为27.4%[1]。中国每年胃癌病死例数占全球同期胃癌总病死例数的40%以上[2]。胃癌组织中基因突变与肿瘤的发生密切相关[3]。载脂蛋白B mRNA编辑酶3(apolipoprotein B mRNA editing enzyme catalytic polypeptide-like 3, APOBEC3)可以引起细胞基因组发生突变,从而引发肿瘤[4]。APOBEC3含有多个家族成员,其中的2个成员APOBEC3B(A3B)和APOBEC3G(A3G)被发现在多种恶性肿瘤中表达升高[5-8]。A3G在子宫颈癌[8]、卵巢浆液性癌[9]以及恶性黑色素瘤[10]中表达升高并与预后相关。然而,胃癌组织中A3G的表达情况及其与患者预后的关系尚未完全阐明。因此,本文应用免疫组化检测85例胃腺癌组织中A3G蛋白的表达情况,并结合生物信息学技术分析A3G表达与胃癌临床病理指标及预后的关系。
1 材料与方法
1.1 材料收集2014年1~12月福建医科大学附属协和医院收治的行胃癌根治性切除的病例。病例入组条件:(1)手术前均未行放、化疗;(2)具有完整的临床及随访资料;(3)病理诊断为腺癌(Lauren分型肠型)[11]。所有病例均由两位资深病理医师采用双盲法重新阅片诊断,共85例符合入组条件。其中男性65例,女性20例;年龄27~84岁,中位年龄61岁;肿瘤位于贲门部22例,胃体25例,胃窦38例。肿瘤浸润深度:黏膜或黏膜下层14例,肌层13例,浆膜下层24例,浆膜外34例。有淋巴结转移63例,无淋巴结转移22例。有远处转移4例,无远处转移81例。肿瘤TNM分期及临床分期根据第8版AJCC标准[12]。每年通过电话或门诊进行随访,随访截至2020年6月或患者死亡。本实验经福建医科大学附属协和医院伦理委员会审核通过。
1.2 胃癌组织中A3G转录水平分析用于在线工具基因表达谱动态分析(Gene Expression Profiling Interactive Analysis, GEPIA)(http: //gepia.cancer-pku.cn/index.html)的数据来自TCGA(https: //tcga-data.nci.nih.gov/tcga/)。使用GEPIA分析胃癌组织及癌旁组织中A3G转录水平的表达差异。
1.3 免疫组化检测胃癌组织中A3G蛋白水平免疫组化染色采用EliVision两步法,所有标本均经10%中性福尔马林固定,4 μm厚切片。经脱蜡、梯度乙醇至水后,经高温高压抗原修复,然后按照试剂说明书进行染色。一抗A3G(ab75560)购自Abcam公司,按照1 ∶500稀释。用PBS代替一抗作为空白对照,DAB显色,苏木精复染。
A3G免疫组化结果判读:A3G蛋白阳性为肿瘤细胞胞质着色,按照染色强度和阳性范围进行综合评分。(1)按染色强度评分:无阳性着色为0分,淡黄色为1分,棕黄色为2分,褐色为3分。(2)阳性范围评分:整张切片中的阳性肿瘤细胞/总的肿瘤细胞数。切片中肿瘤细胞染色强度评分乘以染色范围评分为该病例的A3G评分。
1.4 胃癌肿瘤浸润淋巴细胞分析在镜下评估HE切片中肿瘤浸润淋巴细胞的数量,按无浸润、局灶性、轻度、中度和重度浸润分别计为0~4五个等级。TIMER(https: //cistrome.shinyapps.io/ti-mer/)数据库利用RNA-Seq表达谱数据检测肿瘤组织中免疫细胞的浸润情况。数据库提供了6种免疫细胞(B淋巴细胞、CD4+T淋巴细胞、CD8+T淋巴细胞、中性粒细胞、巨噬细胞和树突状细胞)的浸润情况。本实验仅分析胃癌组织中B淋巴细胞、CD4+T淋巴细胞、CD8+T淋巴细胞与A3G的关系。
1.5 统计学方法所有数据应用SPSS 17.0软件进行统计学分析。计数资料采用构成比描述,组间比较采用卡方检验或Fisher精确检验。采用Spearman相关分析A3G表达与肿瘤浸润淋巴细胞的关系。以P<0.05为差异有统计学意义。
2 结果
2.1 数据库分析胃癌中A3G mRNA的表达情况通过在线工具GEPIA分析TCGA芯片数据库,数据库总共收集胃癌组织样本408例,癌旁组织样本211例,结果显示胃癌组织中A3G mRNA的表达高于癌旁组织(P<0.05,图1)。

图1 GEPIA在线分析A3G在TCGA数据库中胃癌及癌旁组织中表达
2.2 胃癌中A3G蛋白表达与临床病理特征的关系A3G蛋白表达定位在胃腺癌肿瘤细胞胞质,在不同的病例其阳性强度和范围不同(图2、3)。A3G表达评分范围0~1.8,中位数0.9,评分≤0.9的病例42例(49.4%),为A3G低表达组;评分>0.9的病例43例(50.6%),为A3G高表达组。不同T、N分期胃癌的A3G表达存在差异,T3、T4期胃癌的A3G表达高于T1、T2,N2和N3期胃癌的A3G表达高于N1,差异均有统计学意义(P<0.05,表1)。而不同年龄、性别、肿瘤部位、M分期肿瘤组织中A3G的表达差异无统计学意义(P>0.05)。

②③
2.3 胃癌中A3G表达与患者预后的关系本组胃癌中A3G高表达组的5年生存率为46.5%,低表达组为71.4%,前者明显低于后者,差异有统计学意义(P<0.05,表1,图4)。

表1 胃癌不同临床病理特征的A3G蛋白表达情况[n(%)]

图4 胃癌组织中A3G蛋白不同表达水平患者的生存曲线
2.4 胃癌中A3G表达与肿瘤浸润免疫细胞的关系本实验结果显示,胃癌中A3G蛋白表达与肿瘤浸润淋巴细胞存在相关性(r=0.327,P=0.002)。通过TIMER数据库分析表明,胃癌中A3G表达与肿瘤浸润CD8+T淋巴细胞存在相关性(r=0.668,P<0.01,图5)。
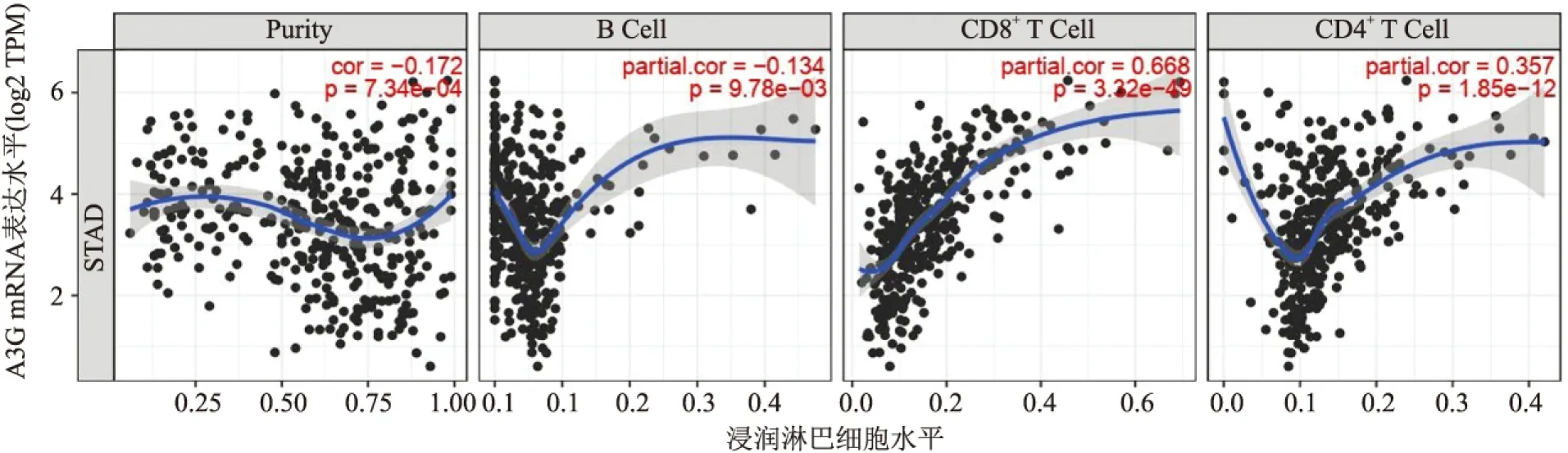
图5 胃癌组织中A3G mRNA表达与肿瘤浸润淋巴细胞的关系
3 讨论
APOBEC3基因是近几年发现的重要的致癌基因,它可以使正常细胞基因碱基发生转换而引起基因组不稳定,从而诱发肿瘤[4,6]。APOBEC3基因位于22号染色体,它包括7个家族成员,分别是A3A、A3B、A3C、A3DE、A3F、A3G和A3H[13]。所有的成员均具有一个保守的氨基酸序列H-X-E-X23-28-P-CX2-4-C(X为任意氨基酸)组成的锌指结构功能域,该结构域可以引发单链DNA中含有5′-TC模序碱基C→T的突变。A3A、A3B、A3C和A3H具有1个功能结构域,而A3DE、A3F和A3G具有2个功能结构域[14]。
A3B最早发现具有抗HIV感染和抵抗LINE-1转座的作用[15-16]。随后发现A3B在多个肿瘤细胞中表达上调,特别是在乳腺癌、头颈部癌、肺癌、膀胱癌和子宫颈癌中,可以引发细胞基因组碱基突变[7]。A3B在卵巢浆液性癌[17]、食管鳞状细胞癌[18]以及鼻咽癌[19]中表达亦升高,还可以促进肿瘤进展、转移和治疗耐药[12-13]。早期研究发现A3G在机体抗病毒过程中发挥重要作用,后来发现其在部分恶性肿瘤中也具有一定作用,但其在恶性肿瘤中的表达不如A3B广泛[20]。2016年Leonard等[9]发现卵巢高级别浆液性癌中A3G表达升高,A3G是患者预后好的指标。Iizuka等[8]发现A3G表达与子宫颈鳞状上皮内病变相关,病变越重A3G表达水平越高。Han等[10]在皮肤黑色素瘤中研究发现A3G高表达与预后较好相关。目前,A3G在胃癌中的表达情况尚未阐明。
GEPIA是新近开发的基于TCGA数据库的在线分析软件,可以分析单个基因在不同癌症中的表达情况。本实验使用GEPIA数据库分析发现,胃癌组织中A3G mRNA的表达水平明显高于癌旁组织,但数据库未能提供胃癌肿瘤亚型之间是否存在表达差异。本实验采用免疫组化法检测胃腺癌组织中A3G蛋白的水平。本文中仅列出了Lauren分型为肠型胃癌的病例,因为A3G在弥漫型胃腺癌中几乎不表达(未列出数据),可能这两型胃癌的发生机制不同[21]。本实验发现A3G蛋白在肠型腺癌中呈不同程度表达,A3G表达与肿瘤T、N分期及临床分期相关,即肿瘤组织中A3G蛋白表达越高,肿瘤浸润深度越深、淋巴结转移越多、临床分期越晚。这可能由于A3G表达使肿瘤基因组不稳定性增加,诱导了更多致癌基因、抑癌基因发生突变,其具体机制、信号通路有待于进一步研究。多数研究认为A3B表达与肿瘤预后差相关,但是已发表的研究认为肿瘤组织A3G高表达反而患者预后好[8-10]。然而,本实验发现肠型腺癌A3G高表达组患者的5年总生存期更短,是预后不良的指标。这可能由于不同癌种中A3G的作用机制存在一定差异。
肿瘤细胞A3B表达增加会影响肿瘤周围免疫微环境的变化[22]。A3G与A3B为同一家族成员,两者在肿瘤中具有类似的作用。肿瘤细胞A3G高表达与免疫微环境是否存在一定的关系?TIMER数据库提供了多个癌种肿瘤浸润免疫细胞的数据。国内学者Han等[10]使用TIMER数据库分析了恶性黑色素瘤中A3G表达与肿瘤浸润免疫细胞的关系,发现A3G表达与CD8+T淋巴细胞呈正相关。本实验采用相同的方法发现,胃癌组织中A3G表达与CD8+T淋巴细胞亦呈正相关。因此,胃癌细胞A3G表达可能影响了肿瘤免疫微环境,这提示A3G可能会影响患者的免疫治疗效果[23]。
APOBEC3家族成员在有些病毒相关的恶性肿瘤中表达升高,如子宫颈癌、鼻咽癌、肝癌等,APOBEC3升高可能与病毒感染诱导有关[8,19,24]。然而,有些肿瘤与病毒感染无关(如食管癌、卵巢癌),肿瘤中也存在APOBEC3家族成员的表达升高,其具体机制还未完全阐明[9,17-18]。
总之,肠型胃腺癌组织中A3G高表达,其表达可能影响了肿瘤免疫微环境,是肠型胃腺癌患者预后差的指标。在这一过程中A3G具体引起的哪些基因的改变还有待于更多的研究。

