尤因肉瘤转移机制的研究进展
吴春华,周小婷,王 华,2
尤因肉瘤(Ewing sarcoma)是好发于儿童和青少年骨及软组织的小圆细胞恶性肿瘤,部分病例在早期阶段具有一定转移潜能,有的病例在原发灶较小时即可出现微转移。尽管手术、化疗及放疗能有效治疗原发灶肿瘤,但对转移和复发患者的疗效较差。为改善患者预后,对尤因肉瘤转移的分子机制进行深入研究,寻找其靶向治疗相关的新线索势在必行。近年,对于尤因肉瘤转移的分子机制研究主要集中在EWS-FLI1融合蛋白、miRNA、细胞骨架分子、Wnt信号通路、血管生成信号通路等方面。
1 EWS-FLI1融合蛋白
尤因肉瘤的重要特征是频繁出现特异性染色体易位,其中85%的尤因肉瘤存在t(11;22)(q24:q12),产生EWS-FLI1融合基因,并编码相应融合蛋白。EWS-FLI1融合蛋白作为转录因子,通过调节下游信号转导分子影响尤因肉瘤的发生、发展及转移[1-2]。EWS-FLI1表达水平的变化使尤因肉瘤细胞表型具有高度可塑性。EWS-FLI1高表达时,细胞具有高增殖潜能;EWS-FLI1低表达时,细胞内肌动蛋白结合蛋白、细胞骨架结构相关蛋白和整合素明显上调,而细胞间黏附蛋白(如紧密连接蛋白、桥粒蛋白)表达下降,导致肿瘤细胞间黏附向细胞与细胞外基质黏附转化,细胞迁移、侵袭和转移潜能增加[1]。
研究发现,EWS-FLI1低表达状态下,Rho信号通路关键上游调控因子(如CYR61、CTGF)以及调控肌动蛋白纤维形成和稳定的因子(如TAGLN、CALD-1和TPM-1)表达上调,进而影响Rho和Hippo信号通路效应子MRTFB和TEAD。MRTFB通过与TEAD相互作用募集到染色质中,正向调控细胞骨架Rho-F肌动蛋白信号通路的基因转录。在EWS-FLI1负向调控基因的远端区域有MRTFB和TEAD结合域的富集。EWS-FLI1可结合到MRTFB远端区域,强烈干扰MRTFB的活性。因此,EWS-FLI1可通过干扰MRTFB/TEAD/YAP-1信号通路抑制Rho-肌动蛋白通路,进而抑制细胞骨架的自我调节(图1)[3]。Hippo信号通路的效应子YAP-1/TAZ作为TEAD的辅助因子,在尤因肉瘤中可通过RASSF1C激活,并表现出与EWS-FLI1拮抗的转录活性。此外,EWS-FLI1可结合到编码TAZ的WWTR1基因座上,降低TAZ mRNA的表达[4]。EWS-FLI1低表达时,YAP/TAZ与TEAD的结合增加,用低浓度YAP抑制剂维替泊芬(VP)处理即可显著降低肿瘤细胞的迁移能力。RNA-seq全基因转录组分析显示,与EWS-FLI1抑制有关的基因,尤其与细胞骨架、迁移及细胞外基质信号传递等相关的基因(如PLAU、FBNI和COL5A1等)显著富集。同时,F-肌动蛋白和黏着斑的组装也受到明显阻断。在小鼠异种移植模型中,术前给予不同剂量VP可延迟肺部转移,提示VP对转移潜能的抑制作用[5]。因此,TEAD/YAP-1/TAZ抑制剂有望用于尤因肉瘤的靶向治疗和防止转移的发生。
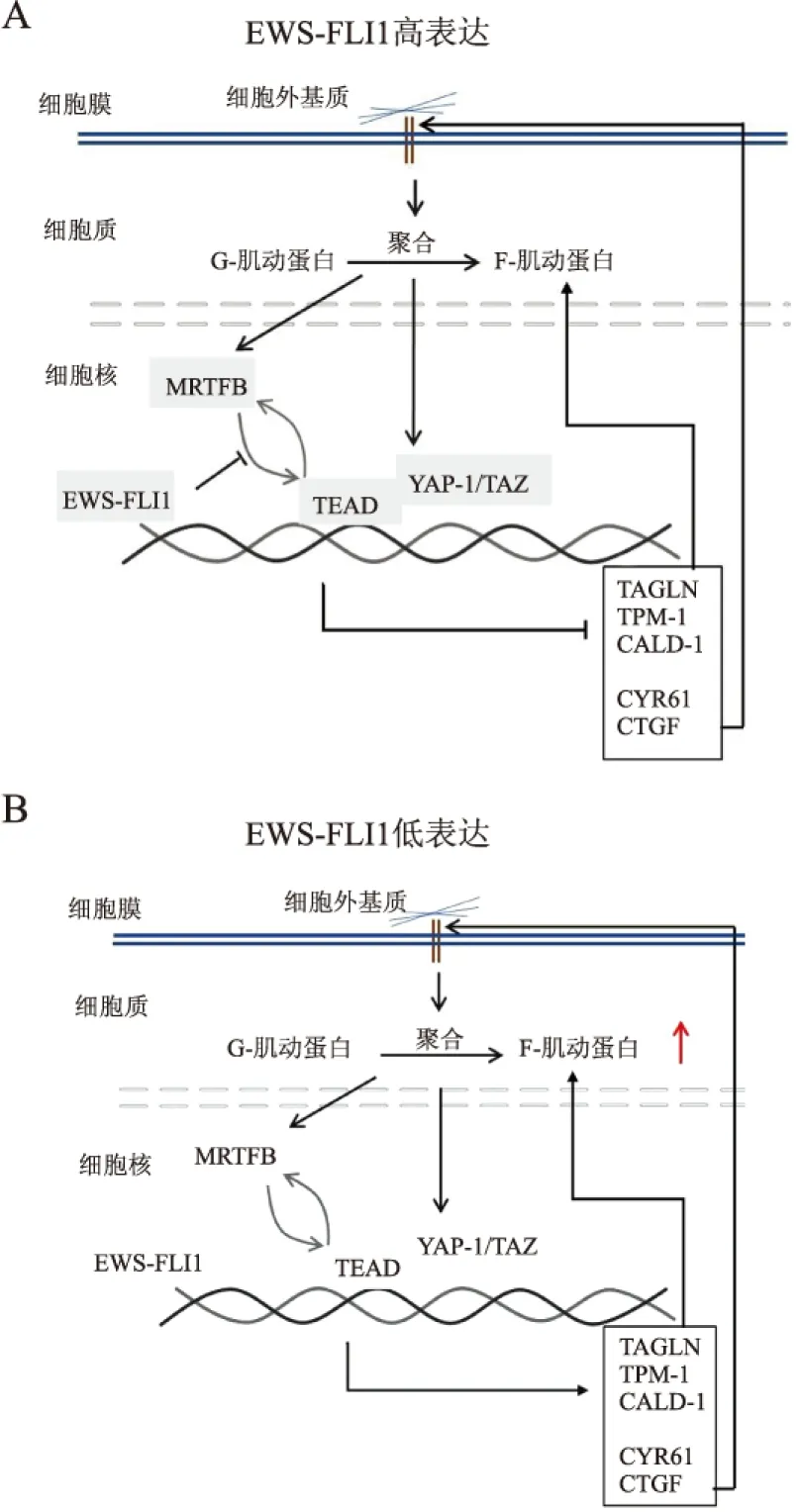
图1 EWS-FLI1对细胞骨架的影响:A. EWS-FLI1高表达时,可通过干扰MRTFB 与TEAD/YAP-1的相互作用,抑制肌动蛋白细胞骨架相关基因(TAGLN、TPM-1、CALD-1)和细胞外基质与受体作用相关基因(CYR61、CTGF)的表达,进而阻碍细胞骨架组装;B. EWS-FLI1低表达时,MRTFB/TEAD/YAP-1调控的细胞骨架相关因子表达增加,通过Rho通路促进肌动蛋白聚合,最终改变细胞形态,使其迁移能力增加
2 miRNA
2.1 miRNA-124多种miRNA参与了尤因肉瘤的发生、发展或转移等环节。研究发现,miRNA-124可负向调控锌指转录抑制因子SNAIL家族成员SLUG的表达,促进细胞间质-上皮转化,使其迁移和侵袭能力降低。将miRNA-124稳定表达的尤因肉瘤细胞A673注入裸鼠的侧尾静脉,6周后观察到裸鼠肺转移结节明显减少,肉瘤细胞中miRNA-124呈高表达,而SLUG和vimentin的表达被抑制[6]。尤因肉瘤中miRNA-124表达受表观遗传调控,用二甲基转移酶抑制剂5′-氮-2′-脱氧胞苷和组蛋白脱乙酰化酶抑制剂曲古抑菌素A处理miRNA-124低表达的A673细胞后,细胞的迁移和间充质特征明显受到抑制,提示高甲基化介导了miR-124的低表达状态,进而影响尤因肉瘤的间充质表型、促进转移[6]。
2.2 miRNA-34miRNA-34家族包括3个成员:miRNA-34a、miRNA-34b和miRNA-34c。尤因肉瘤中miRNA-34a通常呈低表达,且在转移瘤中的表达水平比原发灶明显降低。研究发现,miRNA-34a表达与Cyclin D1表达呈负相关。Cyclin D1是尤因肉瘤转化的关键驱动因子,其表达受EWS-FLI1正向调控,参与诱导肿瘤细胞迁移、侵袭、血管生成等与转移相关的过程。因此,推测miRNA-34a可能通过降低Cyclin D1表达来减弱部分EWS-FLI1的功能,从而发挥抑制肿瘤的作用[7]。相反,miRNA-34b在尤因肉瘤中呈高表达,且在EWS-FLI1阳性病例中有更高水平的表达。进一步研究表明,miRNA-34b表达受EWS-FLI1融合蛋白的正向调控,并可结合NOTCH1的3’-UTR区直接下调NOTCH1的表达,在体外实验中可显著促进肿瘤细胞的增长、迁移和侵袭能力[8]。
2.3 miRNA-30dmiRNA-30d是新近鉴定的miRNA-30家族成员。研究发现,miRNA-30d可以抑制肿瘤细胞的增殖、迁移和侵袭。Ye等[9]用miRNA-30d转染尤因肉瘤SKES1细胞后,细胞侵袭和迁移能力减弱,同时与肿瘤转移密切相关的蛋白酶MMP-2和MMP-9的表达均明显降低,表明miRNA-30d过表达可能通过抑制MMP-2和MMP-9表达抑制尤因肉瘤细胞的侵袭和迁移。此外,在miRNA-30d高表达的细胞模型中,p-MEK1/2、p-ERK1/2和p-Akt的表达水平明显降低,而这些分子的非磷酸化表达水平无明显改变。提示miRNA-30d作为MEK/ERK和PI3K/Akt途径上游信号的负向调节分子,通过调控上述分子的磷酸化水平,促进尤因肉瘤细胞S期阻滞和凋亡,从而抑制肿瘤细胞的增殖和迁移。
2.4 miRNA-130b尤因肉瘤中miRNA-130b可直接靶向抑制Arhgap1的表达[10];同时Arhgap1又是Cdc42负性调节剂,可将活性Cdc42水解为非活性的GDP状态。Cdc42作为Rho GTPase家族成员,是肿瘤转移的关键蛋白,在尤因肉瘤中处于活化状态。Arhgap1表达瞬时敲低出现了与miRNA-130b过表达相同的效果,即PAK1和下游分子c-JUN均被明显激活;而活化的c-JUN可导致转录因子AP-1活化,并转位到细胞核诱导靶基因如MMP-1、Cyclin D1等的表达,促进转移。进一步研究发现,AP-1可与miRNA-130b启动子结合,经激活剂TPA处理后的AP-1,仅4 h就可诱导miRNA-130b前体的转录,表明miRNA-130b与AP-1之间存在正反馈调节环路。因此,miRNA-130b通过负性调控尤因肉瘤细胞中Arhgap1的表达,减少Cdc42水解,激活与转移有关的Cdc42-PAK1-AP-1反馈环路,最终促进尤因肉瘤转移(图2)。此外在Cdc42-PAK1-AP-1反馈环路中,应用PAK1抑制剂可减弱miRNA-130b和AP-1诱导的效应,为抗肿瘤治疗靶点研究提供新线索。
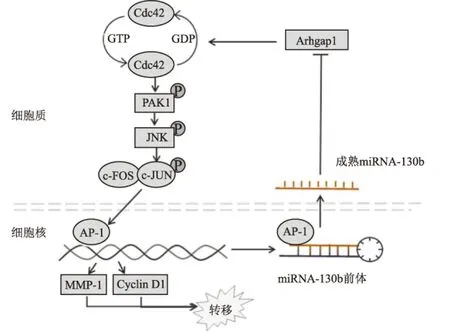
图2 尤因肉瘤中miR-130b/Cdc42/PAK1/AP-1促进转移的正反馈环路图
3 Wnt/β-catenin信号通路
在部分尤因肉瘤中,R-脊椎蛋白配体和(或)其细胞表面受体富亮氨酸G蛋白偶联受体LGR5呈高表达,两者可以协同作用并激活Wnt/β-catenin/TCF及LEF信号通路,促进尤因肉瘤转化成侵袭性表型[11]。Wnt/β-catenin活化细胞中,一些抑制基因与EWS-FLI1诱导基因明显重叠,而其上调基因则与EWS-FLI1抑制基因明显重叠,且EWS-FLI1转录物及蛋白表达水平均降低,提示Wnt/β-catenin信号与EWS-FLI1表达存在拮抗作用[11]。在EWS-FLI1抑制而Wnt/β-catenin激活的基因中,包括zyxin在内的许多细胞骨架基因和腱生蛋白C显著表达,细胞伪足小体形成增多,扩散、迁移能力增强,小鼠模型中肺部转移也显著增加[11]。Wnt/β-catenin信号通路可减弱EWS-ETS对Ⅱ型TGF-β受体表达的抑制[12],此外,还可诱导尤因肉瘤细胞中分泌蛋白发生改变,特别是促进细胞外基质相关蛋白的分泌,包括多种与血管基质蛋白高度重叠的细胞外基质蛋白(如TNC、LUM、MMP-2等)[13],从而诱导内皮细胞增殖,增加肿瘤血管形成[12]。
目前已有针对Wnt通路抑制剂的研发,如Wnt974,一种特异性酰基转移酶Porcupine抑制剂。Wnt配体分泌以及与受体的相互作用需要通过Porcupine的棕榈酰化修饰,Wnt974通过抑制Porcupine的作用来抑制Wnt通路的激活。用Wnt974处理尤因肉瘤细胞系后,与上皮-间质转化和转移相关的基因(如TWIST1、ZEB2和SNAIL1)显著下调。虽然Wnt974对小鼠原发肿瘤的生长无明显影响,但可延迟转移的发生,且原发肿瘤切除后生存期也明显延长。将Wnt974处理后的尤因肉瘤细胞直接通过尾静脉注射到血液循环中,绕过转移级联的早期步骤,发现对小鼠转移瘤形成和生存期无明显影响,提示Wnt974主要在转移早期发挥抑制作用,从而导致转移延迟[14]。因此,该药物在尤因肉瘤中具有早期靶向抑制转移形成的特性。
4 CAV1/MEK/ERK/MMP-9信号通路
CAV1(Caveolin-1)是一种多功能支架蛋白,与RNA聚合酶Ⅰ和转录释放因子(polymerase Ⅰ and transcription released factor, PTRF)一起形成细胞膜穴样内陷所必需的复合蛋白[15]。研究证实CAV1可通过IQGAP1激活MEK/ERK通路,促进MMP-9表达并调节其活性,促进尤因肉瘤细胞的迁移侵袭。CAV1沉默的尤因肉瘤细胞中,核糖体蛋白S6(RPS6)和RSK1磷酸化水平减少,其中RPS6是ERK的下游分子,可以被RSK蛋白磷酸化。在RSK1沉默的细胞模型中,虽然RPS6磷酸化水平和MMP-9的表达和活性未受影响,但细胞迁移和侵袭能力却明显降低。敲低RSK1的小鼠模型中,尤因肉瘤肺部转移从83%减少到33.33%[16],提示RSK1是促进转移的关键因子,为针对CAV1诱导的尤因肉瘤转移及其治疗提供新的思路,MEK/ERK和RSK1抑制剂有望成为抑制转移的靶向治疗药物。
尽管CAV1在尤因肉瘤细胞中高表达,但肿瘤细胞的细胞膜上却只有很少的细胞膜穴样内陷形成,这可能与形成细胞膜穴样内陷所必需的另一个分子PTRF低表达有关。在一项86例尤因肉瘤中的PTRF表达分析显示,只有38.37%病例PTRF阳性,且PTRF阳性患者的总生存率更高,表明PTRF可能是尤因肉瘤的肿瘤抑制因子和预后标志物。PTRF低表达与CpGs高度甲基化有关。PTRF和CAV1在尤因肉瘤中呈共定位并相互作用,导致细胞膜穴样内陷形成,细胞凋亡显著增加,呈p53依赖性。在p53野生型细胞中导入PTRF可引起显著的细胞凋亡,并可中和CAV1的致癌活性。对于p53野生型尤因肉瘤细胞,使用表观遗传学药物恢复PTRF表达可能成为潜在的治疗方法,也可设想将针对PTRF治疗与恢复p53活性的药物结合起来,治疗TP53缺失突变的尤因肉瘤[17]。
5 血管生成
异常血管生成与恶性肿瘤的进展和转移密切相关[18]。尤因肉瘤主要以两种方式形成血管网络,一种是血管内皮细胞增生迁移形成新生血管,另一种是通过肿瘤细胞诱导血管生成拟态(vasculogenic mimicry, VM)。多种因素参与了血管形成的调节,如Wnt通路激活可明显增加血管基质蛋白分泌[12]。在血管生成初始阶段易发生缺氧,血管生成通过激活低氧诱导因子诱导VEGF、FGFs和一些趋化因子的表达[19]。此外,抑制元素1-沉默转录因子(REST)在尤因肉瘤中过表达,并受EWS-FLI1正向调控,通过CRISPR/Cas9敲除REST基因后,肿瘤在体内的生长和向肺部的转移减少,肿瘤血管呈点状,血管周细胞明显减少,血管灌注减少,通透性增加,加速缺氧和细胞凋亡[20]。
Eph受体酪氨酸激酶及其膜锚定配体(Ephrins)构成最大的受体酪氨酸激酶(RTK)亚家族,是促血管生成的主要RTK家族成员。Ephrins存在时,EphA2与CAV1相互作用,激活AKT信号传导并促进bFGF表达,诱导内皮细胞迁移[21]。多种尤因肉瘤细胞系存在EphA2丝氨酸897位点的磷酸化,通过MEK/ERK途径,参与尤因肉瘤细胞的迁移。EphA2沉默可引起ERK的磷酸化改变,而更多实验表明,在EphA2和ERK之间存在相互调节反馈环,EphA2可能作为ERK激酶的下游底物和效应物在尤因肉瘤转移中起重要作用[22]。
与其它侵袭性肿瘤(如黑色素瘤)相似,尤因肉瘤细胞可分化为具有内皮特征的细胞,进而形成丰富的VM。在VM阳性的尤因肉瘤组织中,CD44呈高表达,尤其在血湖(血管生成结构)周围的肿瘤细胞表达更加显著。CD44作为一种跨膜糖蛋白,通过与透明质酸结合促进细胞与细胞外基质的黏附,敲除CD44后,肿瘤细胞的迁移和VM均受到明显抑制[23]。此外,肿瘤细胞可通过分泌血小板衍生生长因子PDGF-B,募集周细胞并诱导基膜蛋白表达,以维持血管样网状结构的稳定、促进血管出芽[24]。Thijssen等[25]在黑色素瘤小鼠模型中研究显示,PDGF受体阻断剂伊马替尼可有效减少微血管密度和周细胞的数量。TGF-β家族受体之一的内皮糖蛋白是另一种可在肿瘤细胞表面表达的血管生成相关蛋白。近期Puerto-Camacho等[26]在小鼠模型中研究发现,针对内皮糖蛋白的靶向药OMTX703能有效延缓尤因肉瘤细胞系和患者来源的异种移植瘤的生长。
6 外泌体
外泌体是细胞分泌的细胞外囊泡,直径30~150 nm,含有DNA、mRNA、miRNA和蛋白质,可以携带并输送功能性小分子物质,介导细胞间通讯和调控肿瘤微环境,已成为肿瘤研究的热点。Miller等[27]首次鉴定出尤因肉瘤细胞系衍生的外泌体,发现其中含有尤因肉瘤特异性EWS-FLI1转录子及mRNA,并富集了与G蛋白偶联信号传导、神经递质信号传导和干细胞相关的转录物,提示外泌体可作为尤因肉瘤外周血中最小残留物的诊断标志物。CD99是尤因肉瘤细胞表面分子标志物,在尤因肉瘤中协同促进EWS-FLI1的致癌作用、调控细胞迁移,并能抑制肉瘤细胞的神经分化。CD99沉默细胞产生的外泌体可调节受体细胞的基因表达,如上调半乳糖凝集素3结合蛋白基因、下调转录因子EGR1基因等的表达,这些基因在调节尤因肉瘤细胞的侵袭、迁移中起重要作用。最近有研究发现CD99沉默的细胞通过释放外泌体,递送能够抑制肿瘤细胞恶性生物学行为的miRNA,促进尤因肉瘤受体细胞明显降低其增殖和迁移能力[28-29]。其中miRNA-34a可抑制NOTCH-NF-κB信号通路,诱导尤因肉瘤细胞的神经分化[28]。富集最多的miRNA-199a-3p是抑制尤因肉瘤细胞生长和迁移的关键驱动因子,在出现肺部或骨转移的患者中明显少于未转移患者[29]。将尤因肉瘤细胞置于miRNA-199a-3p或富含miRNA-199a-3p的外泌体中,均可以复制CD99沉默细胞来源外泌体的调节效应、抑制AP-1活性及其靶基因如MMP-9、MMP-1和CCND1的表达,细胞生长和迁移能力降低,并向神经细胞分化。上述研究提示外泌体在肿瘤细胞的生命活动中起非常重要的作用,深入研究其在修饰尤因肉瘤相关微环境及发展中的作用,将为肿瘤治疗提供更多新途径。
7 结语
综上,近年对尤因肉瘤转移机制的研究,包括miRNA、Wnt信号通路、血管形成以及外泌体等方面取得了一些进展,对阐明尤因肉瘤转移的分子机制、寻找新的靶向治疗药物奠定了基础。由于尤因肉瘤转移患者的治疗效果和预后尚不理想,与转移相关的一些具体机制仍不十分清楚。因此深入分析尤因肉瘤转移中涉及的信号转导通路、微环境调控、联合靶向药物等问题,将为尤因肉瘤的治疗带来新希望。
——一对性格习性迥异的兄弟

