结肠癌中TMCO1、CALR的表达及对转移的影响
齐顺利,赵团结,于晓倩,孙 平,刘红刚
2020年全球癌症统计报告指出,结直肠癌的发病率仅次于乳腺癌和肺癌,位居第3位,其病死率仅次于肺癌,位居第2位,且结肠癌的发病率和病死率呈年轻化趋势[1-2]。虽然近年来临床获得大量防治结肠癌转移的研究成果,但寻找特异性治疗靶点仍是防治转移的关键。
跨膜和卷曲螺旋结构域1(transmembrane and coiled-coil domains 1, TMCO1)是一种新型内质网钙离子通道蛋白,其基因的缺失或蛋白表达异常将会引起内质网Ca2+稳态失衡和信号异常,引发内质网应激和Ca2+信号传导紊乱,从而导致肿瘤的发生[3-4]。钙网蛋白(calreticulin, CALR)是一种存在于内质网中高度进化保守的钙结合蛋白,参与细胞的各种生理和病理过程。越来越多的研究发现,CALR表达与不同类型肿瘤细胞的增殖和转移有关[5-6]。目前,TMCO1、CALR在结肠癌中的作用机制仍不清楚。本实验拟通过人结肠癌组织标本和细胞模型,阐述TMCO1和CALR在结肠癌组织中的表达水平,以及明确TMCO1对结肠癌细胞侵袭和迁移的影响,为寻找新靶点提供依据。
1 材料与方法
1.1 材料收集2019年1月~2021年1月北京市肛肠医院存档的59例低~中分化结肠癌根治术标本及对应的癌旁组织样本。患者术前均未接受中医治疗、新辅助化疗以及生物靶向等治疗。本实验通过北京市肛肠医院科研伦理委员会批准,所有患者均签署知情同意书。
1.2 细胞与试剂结直肠癌HCT116细胞株购自上海中乔新舟公司,TMCO1抗体购自武汉华美公司,CALR抗体购自武汉三鹰公司,N-cadherin、E-cadherin、β-actin抗体均购自北京博奥森公司,Lipofectamine 3000购自赛默飞世尔公司,DMEM高糖培养基、胎牛血清(FBS)、青霉素、链霉素溶液均购自GIBCO公司,Transwell小室购自Corning公司,vimentin、荧光二抗、免疫组化二抗均购自北京中杉金桥公司,1%结晶紫染液购自北京索莱宝公司。
1.3 方法
1.3.1免疫组化 结肠癌和癌旁组织常规组织脱水、石蜡包埋,连续切片,脱蜡至水,EDTA(pH 8.0)抗原修复,滴加一抗TMCO1(1 ∶100)、CALR(1 ∶100),4 ℃孵育过夜,PBS清洗3次,滴加二抗工作液,37 ℃孵育1 h,PBS震荡清洗3次,DAB显色,苏木精复染,脱水、封片,400倍光镜下观察蛋白表达情况。应用Image-Pro Plus 6.0图像分析软件,测量TMCO1、CALR阳性细胞的平均吸光度(A)值,以间接反映TMCO1、CALR蛋白表达量,重复3次取平均值。
1.3.2细胞培养和转染 配置细胞完全培养基(含10%FBS、1%双抗、DMEM高糖),在37 ℃、5%CO2饱和湿度条件下培养,每2~3天传代1次。取对数生长期细胞,1×105个/孔接种于6孔板,将细胞分为对照组、Lip 3000组和TMCO1 siRNA组。当细胞融合度达70%~80%时,参照Lip 3000试剂盒说明书步骤根据实验分组进行转染。其中,TMCO1 siRNA序列(上游5′-GAGAUCUAUCAAUGGUUCG AATT-3′,下游5′-UUCGAACCAUUGAUAGAUCUCT T-3′)由上海生工公司合成。转染48 h后收集所有分组细胞,Western blot法检测TMCO1 siRNA转染效果。
1.3.3免疫荧光 各组细胞爬片,4%多聚甲醛室温固定10 min,0.5%Triton X-100室温通透20 min,PBS漂洗3次,5%BSA封闭30 min,加一抗TMCO1(1 ∶100)、CALR(1 ∶100),4 ℃孵育过夜,PBS漂洗3次,避光荧光二抗孵育1 h,PBS漂洗3次,DAPI核染5 min,封固后在荧光显微镜下观察并拍照。
1.3.4Western blot法 取各组细胞,PBS冲洗2次,加入500 μL细胞裂解液,吸至离心管中,12 000 r/min离心20 min后取上清液,BCA法测定总蛋白浓度。100 ℃沸水浴5 min使蛋白变性、电泳、转膜,10%脱脂奶粉封闭2 h,加一抗TMCO1(1 ∶500)、CALR(1 ∶1 000)、vimentin(1 ∶1 000)、E-cadherin(1 ∶1 000)、N-cadherin(1 ∶2 000)、β-actin(1 ∶3 000),4 ℃过夜,次日复温1 h,加二抗37 ℃孵育1 h,TBST洗膜3次,ECL暗室曝光显影。以β-actin为内参,采用Image J图像分析软件进行灰度值分析,灰度值=目的条带/β-actin。
1.3.5细胞划痕实验 取对数生长期细胞,按每毫升2×105个细胞,每孔500 μL细胞悬液接种于6孔板中,培养过夜,用200 μL枪头在培养板内划线,PBS清洗3次,加入无血清培养基,每组设3个复孔,培养48 h后在显微镜下观察并拍照,利用Image J图像分析软件进行分析。
1.3.6Transwell检测 细胞无血清培养24 h,胰蛋白酶消化,培养基重悬至细胞浓度为每毫升1×105个,将Transwell上室加入200 μL细胞悬液,下室加入600 μL含10%血清的完全培养基,37 ℃ 5%CO2培养48 h,4%多聚甲醛固定10 min,结晶紫染色20 min,用棉签擦去上层细胞,随机取中央及四周5个视野,倒置显微镜下观察、拍照并计数,实验重复3次。
1.3.7内质网红色荧光探针检测 去除细胞培养液,HBSS溶液洗涤,加入配置好的ER-Tracker Red工作液,37 ℃孵育15 min,细胞培养液洗涤2次,10%中性福尔马林37 ℃固定2 min,PBS清洗3次,每次5 min,滴加抗荧光淬灭封片液,荧光显微镜下封固并观察,实验重复3次。
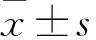
2 结果
2.1 结肠癌和癌旁组织中TMCO1、CALR蛋白的表达结肠癌组织中TMCO1和CALR蛋白表达较癌旁组织增高,差异有统计学意义(t=-8.519、-7.256,P均<0.01,图1)。
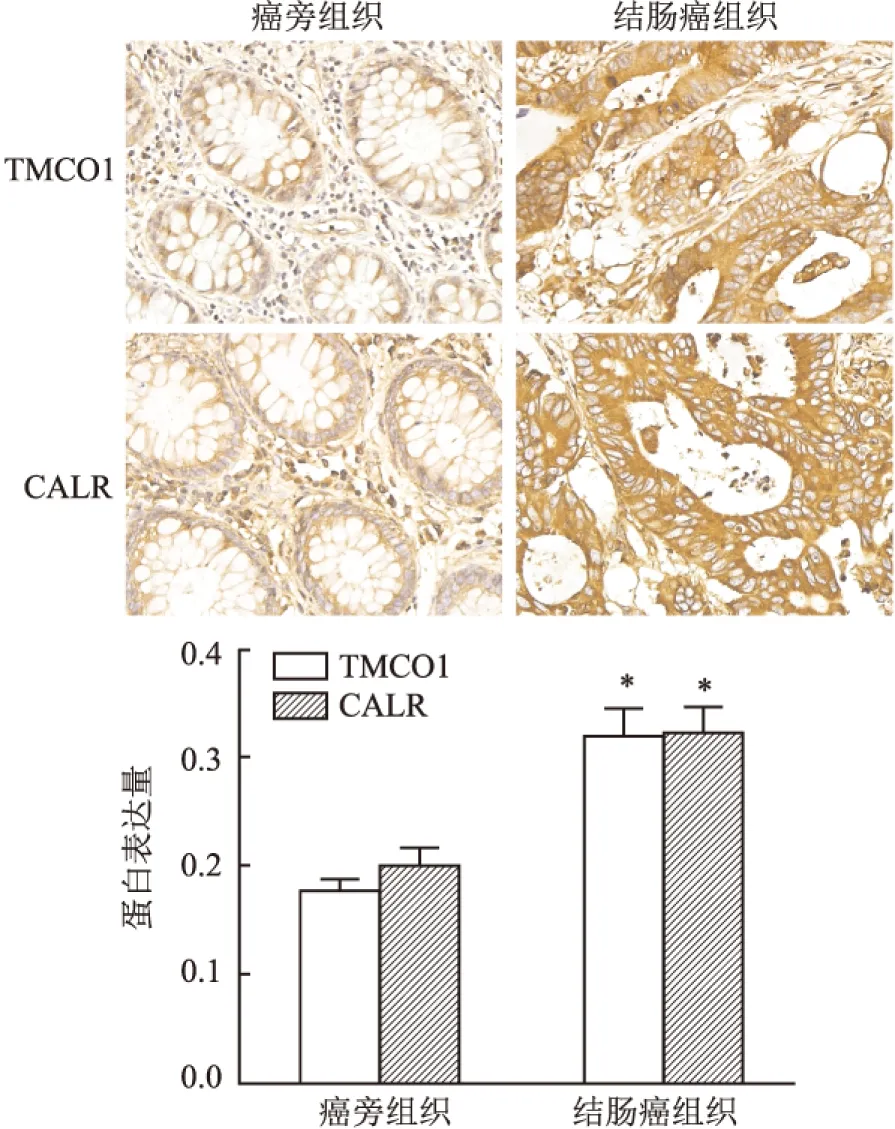
图1 结肠癌和癌旁组织中TMCO1、CALR蛋白表达水平:与癌旁组织相比,*P<0.05
2.2 Western blot法检测TMCO1 siRNA干扰效果应用Western blot法检测结肠癌HCT116细胞经TMCO1 siRNA干扰后TMCO1蛋白表达情况,与对照组相比,TMCO1 siRNA干扰组TMCO1蛋白表达水平显著降低(F=232.118,P<0.001,图2)。
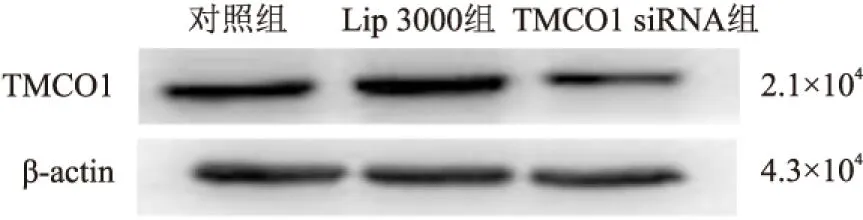
图2 Western blot法检测TMCO1 siRNA干扰效果
2.3 细胞划痕实验检测TMCO1对HCT116细胞迁移能力的影响对照组、Lip 3000组和TMCO1 siRNA组0 h划痕距离差异无统计学意义(F=0.176,P>0.05)。TMCO1 siRNA组48 h划痕距离显著长于对照组和Lip 3000组,差异具有统计学意义(F=23.307,P<0.01,图3)。
图3 细胞划痕实验检测TMCO1对结肠癌HCT116细胞迁移能力的影响:与对照组比较,*P<0.05;与Lip 3000组比较,#P<0.05
2.4 Transwell实验检测TMCO1对HCT116细胞侵袭能力的影响TMCO1 siRNA组(44.67±6.51)穿过Transwell小室的细胞数量明显低于对照组(190.33±16.56)和Lip 3000组(184.67±14.98),差异具有统计学意义(F=113.265,P<0.001,图4)。
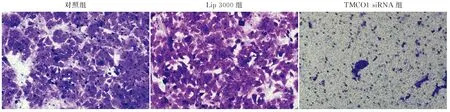
图4 Transwell实验检测TMCO1对结肠癌HCT116细胞侵袭能力的影响
2.5 免疫荧光检测HCT116细胞TMCO1、CALR蛋白表达水平与对照组和Lip 3000组相比,TMCO1 siRNA组HCT116细胞TMCO1、CALR蛋白荧光强度显著减少,差异有统计学意义(F=153.078、153.039,P均<0.001,图5)。
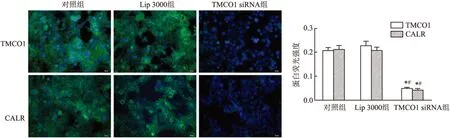
图5 免疫荧光检测结肠癌HCT116细胞中TMCO1、CALR蛋白表达水平:与对照组比较,*P<0.05;与Lip 3000组比较,#P<0.05
2.6 Western blot法检测TMCO1对HCT116细胞CALR、vimentin、E-cadherin、N-cadherin蛋白表达水平的影响Western blot检测结果显示,TMCO1 siRNA组CALR、TMCO1、vimentin、N-cadherin蛋白表达水平较对照组和Lip 3000组显著降低,而E-cadherin蛋白表达水平显著升高,差异均有统计学意义(F=66.4396、69.806、170.146、58.713、283.747,P均<0.001,图6)。
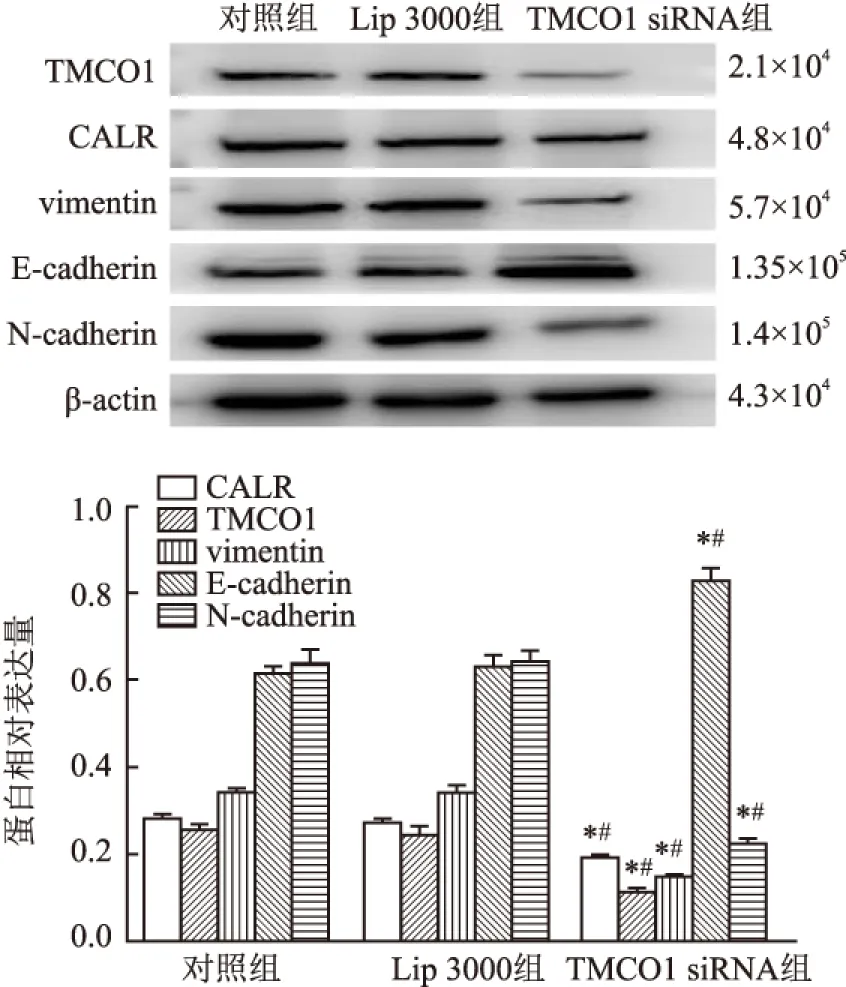
图6 Western blot检测结肠癌HCT116细胞TMCO1、CALR、vimentin、E-cadherin、N-cadherin蛋白表达水平:与对照组比较,*P<0.05;与Lip 3000组比较,#P<0.05
2.7 内质网探针检测TMCO1对HCT116细胞内质网氧化应激水平的影响TMCO1siRNA组内质网探针荧光强度较对照组和Lip 3000组显著降低,差异有统计学意义(F=42.003,P<0.001,图7)。
3 讨论
结肠癌是我国常见的消化道肿瘤之一,结肠癌细胞的转移和侵袭是导致我国结肠癌患者生存率低、病死率高的主要因素。所以,探索敏感性、特异性靶点成为防治结肠癌转移的关键。
Ca2+作为细胞的第二信使,参与机体细胞代谢、细胞增殖和死亡、蛋白质磷酸化、神经递质和激素释放、基因转录等多种生理活动[7-8]。Ca2+浓度的异常升高可以激活癌细胞的活性,促进癌细胞的增殖和迁移[9]。TMCO1作为一种新型的内质网Ca2+通道蛋白,其基因缺失或蛋白表达异常将会引起内质网Ca2+稳态失衡和信号异常,导致肿瘤的发生。Li等[10]研究发现,TMCO1能够通过抑制AKT信号通路抑制膀胱尿路上皮癌的增殖和迁移,表明TMCO1是新型的抑癌因子,抑制其蛋白表达可影响患者预后。Chen等[11]研究发现,TMCO1可以促进肺腺癌的侵袭和迁移,抑制TMCO1表达水平肺腺癌细胞的侵袭和迁移能力明显受到抑制。TMCO1表达可能在不同的肿瘤和癌细胞中具有不同的功能,这可能与肿瘤细胞类型特异性差异有关。本实验通过干扰TMCO1表达,可显著抑制结肠癌HCT116细胞的侵袭和迁移能力,并且我们推测其可能与CALR蛋白相关。
CALR蛋白在肿瘤进展中发挥重要作用。诸多研究表明,CALR在结直肠癌、胃癌、乳腺癌中表达显著升高,其表达水平与临床分期和淋巴结转移呈正相关[12-14]。Harada等[15]报道CALR高表达与口腔鳞状细胞癌患者TNM分期、总生存率以及预后不良有关,CALR可作为衡量口腔鳞状细胞癌预后的重要标志物。本实验结果表明,人结肠癌组织中TMCO1、CALR蛋白表达水平显著高于癌旁正常组织,提示TMCO1、CALR高表达可能与结肠癌的发生、发展密切相关。
为进一步验证,本实验检测TMCO1对CALR表达的影响,发现TMCO1 siRNA组中CALR表达显著降低,提示TMCO1 siRNA抑制结肠癌侵袭和迁移过程与调控CALR表达水平相关。本实验通过内质网荧光探针发现,转染TMCO1 siRNA可显著降低探针强度,作者推测TMCO1可能通过调控内质网氧化应激促进结肠癌的发生。本实验现阶段并未验证,后续将进一步深入研究。此外,本实验亦发现干扰TMCO1表达后EMT相关标志物蛋白vimentin、N-cadherin蛋白表达水平明显降低,而E-cadherin蛋白表达水平明显升高。这提示,TMCO1的促癌作用可能与调控vimentin、N-cadherin、E-cadherin蛋白表达有关。Chen等[11]的研究亦发现,在肺腺癌中抑制TMCO1表达,vimentin、N-cadherin表达水平明显降低,E-cadherin表达水平明显升高,从而导致迁移能力显著降低,与本实验结果一致。
综上所述,结肠癌组织中TMCO1、CALR蛋白表达水平显著升高。干扰TMCO1表达后,HCT116细胞侵袭和迁移能力显著降低,其作用机制可能与CALR及内质网氧化应激水平以及EMT相关标志物蛋白显著相关。

