磷酸化的mTOR、p70S6K及4EBP1在食管鳞状上皮癌变中的表达及其意义
刘小红,李丽,李雪婷,张振华
(1山西医科大学研究生学院,太原 030000;2山西医科大学第三临床医院,山西白求恩医院病理科,太原 030032)
食管鳞状细胞癌是我国常见的食管癌病理类型,起病隐匿,受内外多种因素共同作用,往往经历低级别上皮内瘤变、高级别上皮内瘤变,从而进展为浸润性鳞状细胞癌。mTOR(哺乳动物雷帕霉素靶蛋白)是一种丝/苏氨酸激酶,是生理和病理过程中重要的信号转导分子, 在细胞增殖、分化、自噬、凋亡中发挥关键作用[1]。磷酸化的mTOR(p-mTOR)可作用于下游效应因子4EBP1(真核翻译起始因子4E结合蛋白1)和p70S6K(核糖体40S小亚基S6蛋白激酶),参与多种肿瘤的发生发展。研究表明,mTOR/p70S6K通路在卵巢癌中被激活,卡铂可快速抑制mTOR、p70S6K和4EBP1的表达,使肿瘤细胞停滞在G0/G1期[2]。大部分乳腺癌患者都可观察到PI3K/Akt/mTOR 通路的信号异常现象,mTOR抑制剂依维莫司已经被FDA批准可以治疗晚期乳腺癌患者[3]。在体外和体内对肾细胞癌的研究中发现,mTOR信号通路中底物(p70S6K、4EBP1和AKT)的磷酸化可以促进肿瘤的生长增殖[4]。mTOR信号通路通常在肿瘤中被激活,通过调节基因转录和蛋白质合成以调节细胞增殖和免疫细胞分化,是目前肿瘤研究的热点[5]。食管鳞癌中PI3K-AKT-mTOR信号通路被激活[6],但mTOR及其下游靶点p70S6K和4EBP1在食管癌变过程中的表达变化尚未见报道。本研究选取p-mTOR、p-p70S6K及p-4EBP1为研究对象,探讨各因子在食管癌变过程中(正常-低/高级别上皮内瘤变-鳞癌)的蛋白表达,并分析与临床病理参数的关系。
材料与方法
1 临床标本与资料收集
收集山西白求恩医院病理科2015-2019年明确病理诊断且术前未进行放化疗的食管鳞状细胞癌样本(剔除小活检和会诊病例)89例,癌旁高级别上皮内瘤变组织34例,低级别上皮内瘤变组织17例,正常食管黏膜上皮组织59例。所有标本均具有完整的临床病理资料及实验所需蜡块。
2 主要试剂与设备
兔抗人p-mTOR单克隆抗体(Ser2448,2976S)及兔抗人p-4EBP1单克隆抗体(2855S)均购自德国Cell Signaling Technology(CST)公司、兔抗人p-p70S6K单克隆抗体(AP0502)购自武汉爱博泰克生物科技有限公司(ABclonal),生物素标记抗兔IgG和HRP标记抗兔IgG购自武汉博士德生物工程有限公司,DAB显色试剂盒购自北京中杉金桥生物技术有限公司。免疫组织化学染色仪(Bench Mark XT)购自上海罗氏诊断产品有限公司,石蜡切片机(S17040828)、烤片机(Thermo)购自英国赛默飞世尔公司,显微镜(BX51)购自OLYMPUS公司。
3 组织芯片制备
收集实验所需食管鳞状细胞癌、上皮内瘤变及正常食管上皮组织蜡块和相应的HE切片,显微镜观察HE染色切片,圈标代表性病变区域,对应标注石蜡组织块上相应目标区域。制作空白组织芯片石蜡模具,使用空心针从石蜡组织块目标区域中穿取出直径为2mm的组织芯,然后将这些组织芯以预定的排列模式小心地填充入空白组织芯片石蜡模具,组织芯与蜡模融合后备用。
4 免疫组织化学染色
将组织芯片蜡块4μm厚连续切片,分置于防脱载玻片上,70℃烤箱中烤片60min。p-mTOR、pp70S6K免疫组织化学实验采用EnVision两步法:切片置于罗氏Bench Mark XT免疫组织化学染色仪中,经抗原修复后,先后滴加一抗 (p-mTOR 1:50稀释,p-p70S6K 1:50稀释)和HRP标记抗兔IgG孵育,DAB呈色后手工苏木素复染、分化、酒精脱水、二甲苯透明、中性树脂封片。p-4EBP1免疫组化实验采用SABC法:切片经二甲苯脱蜡、酒精水化、抗原修复、滴加一抗 (p-4EBP1 1:800稀释)置于4℃冰箱中过夜,隔日依次滴加生物素标记抗兔IgG、链霉亲和素-生物素-酶复合物孵育,DAB显色、苏木素复染、分化、酒精脱水、二甲苯透明、中性树脂封片。用已明确阳性的乳腺癌组织分别作为p-mTOR、p-p70S6K的阳性对照,用已明确阳性的结肠癌组织作为p-4EBP1的阳性对照,以0.01mol/L PBS (pH7.4)代替一抗作为各指标的阴性对照。
5 结果判读
全部标本均由两位高年资病理医师经显微镜诊断证实。采用双盲法显微镜下观察结果,如出现判定结果不一致时,由第三名研究者做最终结果认定。 pmTOR表达定位于细胞质或细胞核, p-p70S6K表达定位在细胞核,p-4EBP1表达定位于核膜及胞浆,阳性信号为可见定位准确的黄色着色。采用H-score评分[7],高倍镜下随机选取5个视野(每个视野观察细胞数不少于200个), 按染色强度及各染色强度细胞所占百分数进行结果判定:染色强度(I)评分: 未着色0分,浅黄色1分,黄色2分,黄褐色3分;各染色强度细胞所占百分数(PC)= (各染色强度细胞数/观察的细胞总数)×100。最后计算的H-score分值 = ∑(I×PC),I代表染色强度(0、1、2、3),PC代表该染色强度细胞所占百分数(0-100),分值范围0-300,以分值≥30分为阳性标准[8],分值<30认定为阴性。
6 统计学分析
应用SPSS 25.0软件进行分析,组间蛋白表达差异比较采用Kruskal-Wallis H 秩和检验,与临床病理参数之间的关系分析采用非参数秩和检验,相关性分析采用Spearman分析,P<0.05表示结果具有统计学意义。
结 果
1 食管鳞状细胞癌中p-mTOR和p-4EBP1水平升高,p-p70S6K水平降低
免疫组织化学染色显示:p-mTOR在食管鳞状细胞癌、高级别上皮内瘤变组中高表达,明显高于低级别上皮内瘤变组及正常组;p-p70S6K在正常组、低级别上皮内瘤变组、高级别上皮内瘤变组中蛋白表达依次增加,在高级别上皮内瘤变组达到最高,且强度达到最强,然而在鳞状细胞癌中低表达;p-4EBP1在鳞状细胞癌中高表达,在正常组织中低表达(图1,表1)。
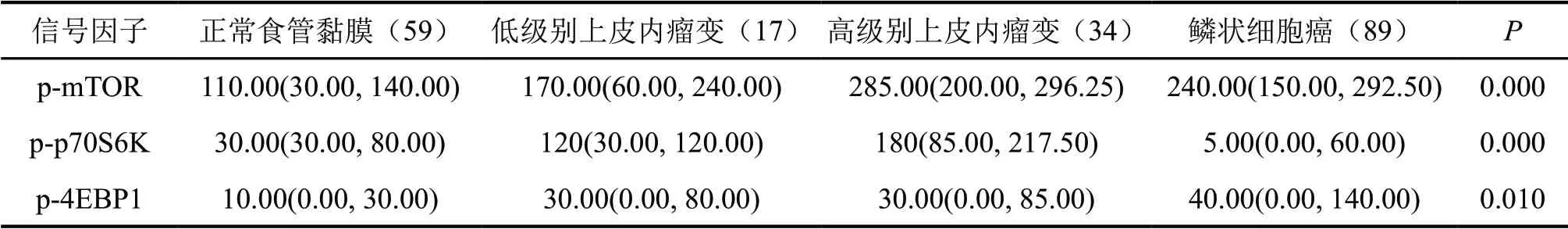
表1 p-mTOR、p-p70S6K和p-4EBP1在不同组织类型中表达水平比较(H-score)Tab. 1 Comparison of the expression level of p-mTOR, p-p70S6K and p-4EBP1 in the selected tissues(H-score)
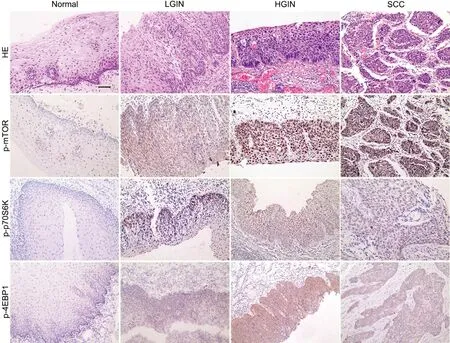
图1 不同组织类型的组织学与免疫组织化学检测。HE,HE染色;p-mTOR、p-p70S6K和p-4EBP1,p-mTOR、p-p70S6K和p-4EBP1免疫反应性的免疫组织化学Envision或SABC法染色; Normal:正常食管粘膜;LGIN:低级别上皮内瘤变;HGIN:高级别上皮内瘤变;SCC:鳞状细胞癌;比例尺,100μmFig. 1 Histological and immunohistochemical examination of the selected tissues. HE, HE staining; p-mTOR, p-p70S6K and p-4EBP1, immunohistochemical EnVision or SABC staining for the immunoreactivity of p-mTOR, p-p70S6K and p-4EBP1; Normal, normal tissue away from cancerous tissue; LGIN, low grade intraepithelial neoplasia; HGIN, high grade intraepithelial neoplasia; SCC: squamous cell carcinoma; scale bar, 100μm
2 食管鳞状细胞癌中p-mTOR、p-p70S6K、p-4EBP1蛋白表达与临床病理参数之间的关系
非参数秩和检验分析表明(表2),食管鳞状细胞癌中,p-mTOR水平与肿瘤病理分级呈正相关(在I—III级表达递增),在粘膜层及纤维膜层显著高于肌层; p-p70S6K蛋白表达与肿瘤临床分期和浸润深度呈负相关,与其余临床病理参数无关;p-4EBP1表达与肿瘤临床病理参数无关。
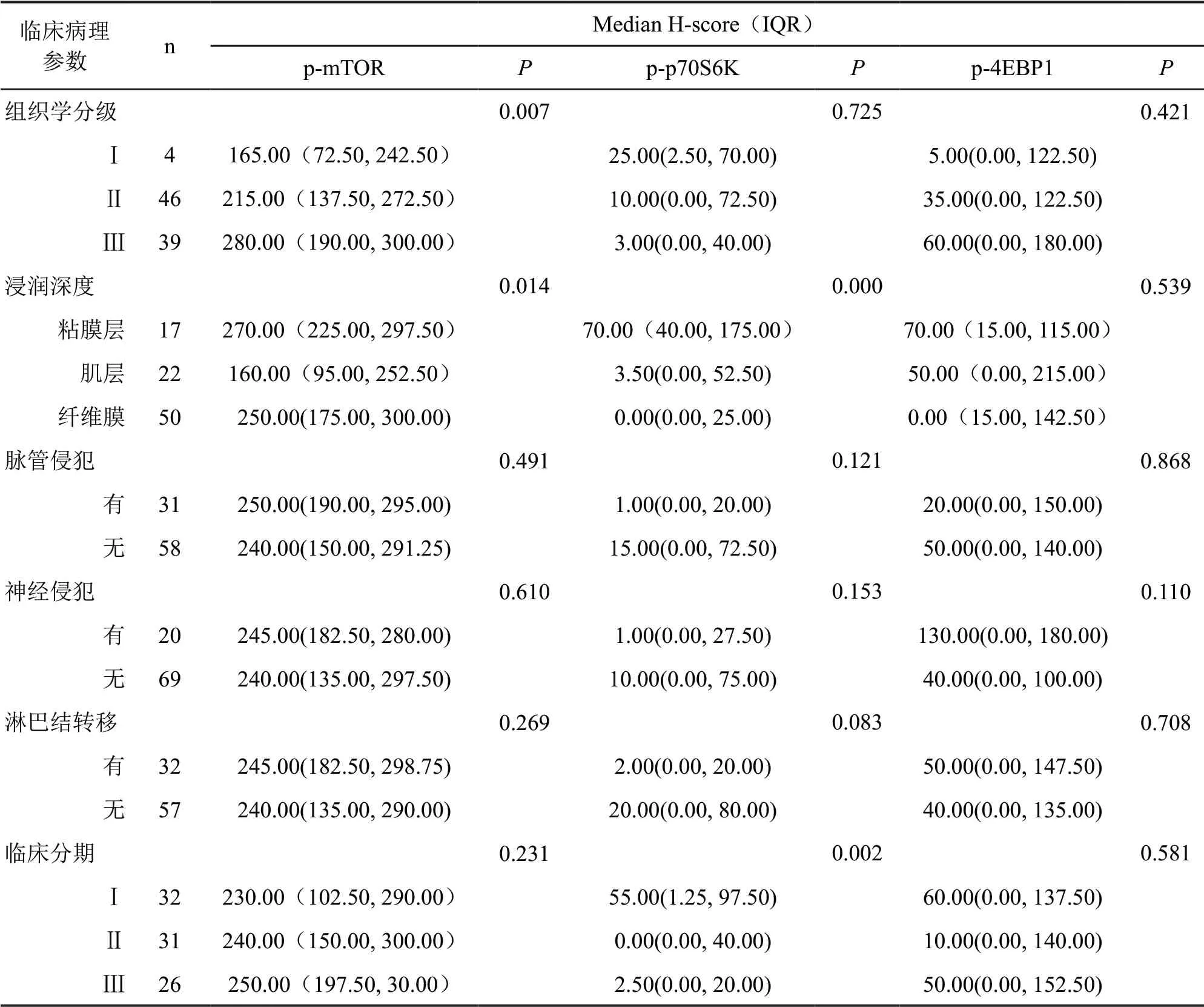
表2 食管鳞状细胞癌组织中p-mTOR、p-p70S6K和p-4EBP1 水平与临床病理参数之间关系分析Tab.2 Analysis of the correlation between p-mTOR, p-p70S6K and p-4EBP1 level and clinicopathological parameters of esophagus squamous cell carcinoma
3 鳞状细胞癌组织中p-mTOR、p-p70S6K和p-4EBP1水平间相关性
以国际公认的H-score≥30认定为阳性,Hscore<30认定为阴性。Spearman分析表明,在鳞状细胞癌组织中,p-p70S6K与p-4EBP1水平之间具有弱相关性(P<0.01,r=0.285),其余因子之间蛋白表达均无相关性(表3)。

表3 鳞状细胞癌组织中p-mTOR、p-p70S6K和p-4EBP1水平间的相关性分析Tab. 3 Relevance analysis of p-mTOR, p-p70S6K and p-4EBP1 level in esophagus squamous cell carcinoma
讨 论
mTOR上调与多种肿瘤的发生、发展有关[9-11],mTOR及其下游效应因子与乳腺癌、胃癌等多种肿瘤的预后相关[12,13]。本次研究显示,p-mTOR在食管鳞癌组、高级别上皮内瘤变组中均高表达,明显高于低级别上皮内瘤变组及正常组,且食管鳞状细胞癌中p-mTOR水平与肿瘤病理分级及浸润深度相关,这与之前的一项荟萃分析结果相同[14]。p-mTOR作为基因转录及蛋白质合成的正性调控因子,随肿瘤细胞恶性程度升高其表达水平升高,对于判断预后有一定的意义,临床工作中可根据表达水平的波动对治疗方案进行个体化的调整。
本次研究还发现,p-p70S6K在食管正常组、低级别上皮内瘤变组及高级别上皮内瘤变组中水平递增,在鳞癌组中表达反而下降。然而,基于肺癌等的研究发现,p70S6K及p-p70S6K在肿瘤组织中表达升高[15,16],由此表明p70S6K参与致瘤性和癌症进展,这与本次实验结论不同。在一项胃癌及腺瘤组织的对比研究中同样存在类似困惑,Li等人研究发现p-p706SK在腺瘤细胞质及细胞核中均呈高表达,但在胃癌组织中,胞质表达水平较高,但胞核表达却显著降低,呈现较为复杂的表达状况。进一步分析表明,p-p70S6K核表达可能对胃癌起一定的抑制作用[17]。p70S6K作为mTOR的下游效应因子,通过mTOR磷酸化为p-p70S6K,从而使其翻译活性大幅度增加(约为p70S6K的100倍),但p70S6K的激活过程非常复杂,需要至少7个丝氨酸/苏氨酸磷酸化位点。因此,在肿瘤癌变过程中,p-p70S6K蛋白表达受多种因素影响。基于本研究分析,我们考虑p-p70S6K可能是食管鳞癌发生过程中的早期事件,虽然在癌组织中表达低于上皮内瘤变组,但其表达显示与浸润深度及临床分期相关,依然可以提示与肿瘤存在较差的生物学行为相关。p-p70S6K复杂的致瘤机制需要进一步研究加以阐明。因我们目前研究病例数量少,已有研究仍然存在一些局限性,因此,准确结果有待进一步深入研究加以确认。
4EBP1是翻译阻遏蛋白家族的成员,是mTOR的下游效应因子,其磷酸化可以促进翻译。目前,已经在多种癌中发现了4EBP1的过度磷酸化和过表达同时发生[18,19]。本实验显示p-4EBP1在食管正常组、低级别、高级别上皮内瘤变组、鳞癌组中表达呈递增趋势,差异具有统计学意义,这与之前食管癌已有研究结果一致[20],表明p-4EBP1过表达是食管癌发生及发展的原因。在前列腺癌的研究中同样发现,高水平的p-4EBP1与前列腺癌患者的死亡率升高显著相关,这意味着mTOR通路的下游效应可能是前列腺癌进展的潜在预后指标[21]。但p-4EBP1与食管癌的预后及恶性生物学行为的关系,尚不明确。
mTOR激活与肿瘤发生、进展、侵袭和迁移有关,且在转移性癌中p-mTOR表达高于原发灶,pmTOR表达在腺癌中高于其他类型的癌症[22]。当前,正在开发多种mTOR抑制剂(雷帕霉素及雷帕霉素类似物)[23],已有一些mTOR抑制剂用于肺癌[24]、胰腺神经内分泌肿瘤[25]等的靶向治疗,且取得了一定的疗效。此外,在肺癌中研究发现,p70S6K抑制剂PF-4708671以浓度依赖性方式显著抑制肺癌细胞的生长[16]。在黑色素细胞瘤的研究中表明,mTOR抑制剂依维莫司降低黑素瘤细胞的侵袭性[26]。总之,相关抑制剂已经在多种肿瘤中展现出其治疗潜力,但在食管癌中的研究较少,尚未发现有效靶向治疗药物,因此亟待研究。
本研究发现p-mTOR及p-4EBP1水平在食管癌变过程中升高,提示其可能发挥促癌作用。p-p70S6K在食管癌前病变中促进恶性转变,p-p70S6K可能是食管癌变过程中的早期事件。三者在食管癌发生过程中发挥协同促癌作用,联合检测可对早期食管癌的发生具有一定预警作用。p-mTOR蛋白表达与肿瘤病理分级呈正相关,p-mTOR在粘膜层及纤维膜层显著高于肌层,p-p70S6K蛋白表达与肿瘤临床分期、浸润深度呈负相关。因此,检测相关因子可以用于临床评估预后,指导靶向药物的开发、研究和应用。
p-mTOR表达在腺癌中高于其他类型的癌症,mTOR通路相关蛋白的研究大部分着眼于腺癌。食管鳞癌发病主要集中于我国,且具有地域特征,整体研究较少且局限,本研究应用免疫组织化学技术初步检测了食管鳞状上皮癌变过程中p-mTOR、pp70S6K及p-4EBP1水平变化,分析了其与临床病理参数的关系,得出的相关结论仍需进行细胞及分子水平的研究验证,与临床病理参数的相关性也需要更多的实验数据支持与修正。

