4-PBA通过Nrf2/NQO1通路减轻急性汞中毒小鼠肝氧化应激和功能损伤
张雨淼 ,胡珊, ,陈龙, ,张倩,徐春明,王金玲,张红霞, *
(潍坊医学院1附属医院肾内科, 2神经疾病与再生修复实验室,3基础医学院临床病理系,潍坊 261053)
汞是一种常见的毒物,一般以金属汞、无机汞和甲基汞3种化学形式广泛存在于自然环境中,其中氯化汞(HgCl2)是自然过程中最容易形成的一种无机形式。无机汞被机体吸收后会引起多组织器官损伤,如大鼠口服HgCl2会诱导氧化应激造成心脏损伤[1]。Li等[2]研究发现HgCl2通过抑制氧化应激相关蛋白核因子E2相关因子2 (nuclear factor E2 related factor 2, Nrf2)信号通路,对肾脏造成损伤。氧化应激与内质网应激(endoplasmic reticulum stress,ERS)相关蛋白葡萄糖调节蛋白(GRP78)、C/EBP同源蛋白(CHOP)之间存在一定联系:一方面,Nrf2可通过抑制GRP78、CHOP和半胱氨酸蛋白酶-12(caspase-12)凋亡通路来影响ERS,从而减轻细胞凋亡[3];另一方面,低水平的GRP78可能通过改变E-钙黏蛋白和波形蛋白的表达,激活Nrf2/HO-1信号通路,增强结肠癌细胞转移和侵袭能力[4]。
4-苯基丁酸(4-Phenylbutyric acid,4-PBA)是ERS特异性阻断剂,可协助蛋白质的折叠,从而减轻ERS[5]。有趣的是,在心脏缺血-再灌注损伤大鼠模型中,4-PBA处理不仅能抑制ERS相关蛋白Grp78、CHOP、pPERK的表达,还能增加SOD、GSH-Px的活性,减少LDH、ROS、MDA的产生,保护心肌免受氧化应激引起的损伤,减少细胞凋亡[6]。因此,本研究通过建立汞暴露小鼠模型,研究4-PBA对小鼠肝脏保护作用以及对氧化应激Nrf2/NQO1通路的影响。以探讨ERS抑制剂4-PBA是否能作用于氧化应激,ERS与氧化应激是否有协同作用。
材料与方法
1 试剂
HgCl2、兔抗Nrf2(美国Sigma-Aldrich公司),鼠抗NQO-1(美国Santa cruz公司),鼠抗GAPDH(美国Cell Signaling Technology公司),DAB显色试剂盒、通用二步法试剂盒(小鼠/兔增强聚合物法检测系统)PV-9000(北京中杉金桥公司),微量丙二醛(MDA)、微量还原型谷胱甘肽(GSH)、谷胱甘肽过氧化物酶(GSH-Px)、总超氧化物歧化酶(T-SOD)检测试剂盒(南京建成生物有限公司)。
2 动物与造模
健康清洁级8周龄C57BL/6雄性小鼠购自济南朋悦实验动物繁育有限公司。18只小鼠随机分为3组:Control组、HgCl2组、HgCl2+4-PBA组,每组6只。小鼠SPF级饲养,自由饮水,光照白天12h,夜间12h,温度25℃,实验开始前适应性喂养3d。对照组(Control):不给予任何处理。HgCl2组:腹腔注射8mg/kg HgCl2盐溶液处理16h;HgCl2+4-PBA组:腹腔注射20mg/kg 4-PBA,48h后注射8mg/kg HgCl2盐溶液处理16h,建模成功后采集血液和肝脏组织。本动物实验严格遵守《山东省实验动物管理委员会标准》和《潍坊医学院实验动物使用及护理指南》规定。
3 血清生化指标检测
小鼠麻醉后经眼球取血,抗凝血在4℃条件下2500 rpm离心10 min,收集上清液。采用全自动生化分析仪检测谷丙转氨酶(ALT)与谷草转氨酶(AST)水平。
4 肝组织氧化应激指标检测
取肝组织和生理盐水按照重量(g):体积(ml)=1:9的比例制成10%组织匀浆,4℃条件下4500 rpm离心10 min,收集上清液。按照试剂盒说明书对微量丙二醛(MDA)、微量还原型谷胱甘肽(GSH)、谷胱甘肽过氧化物酶(GSH-Px)、总超氧化物歧化酶(T-SOD)及总蛋白含量进行测定。
5 免疫组织化学染色
采用通用二步法,肝组织切片常规脱蜡和水化,经抗原修复、阻断内源性过氧化物酶后用羊血清封闭,然后滴加第一抗体4℃过夜。第二天孵育第二抗体后DAB显色,苏木精复染。最后将切片脱水封片,在显微镜下进行观察。
6 Western blot
提取小鼠肝脏组织蛋白,SDS-PAGE电泳分离,后转至PVDF膜,用5%脱脂奶粉室温封闭2h,分别加入相应一抗,4℃孵育过夜;次日二抗室温孵育2h;ECL化学发光法显影。采用Image J图像分析系统对各条带进行分析,以目的蛋白条带与内参照GAPDH条带积分光密度值比值反映目的蛋白的表达水平。
7 统计学分析
采用 SPSS 22.0 统计分析软件,各观察数据以均数±标准差(±s)表示,组间比较采用单因素方差分析(one-way ANOVA),用GraphPad Prime 6作图,以双侧P<0.05 为差异具有统计学意义。
结 果
1 4-PBA处理抑制汞中毒导致的血清AST和ALT升高
AST和ALT是广泛应用于反应肝损伤的检测指标。与Control组相比,HgCl2处理组AST和ALT水平均显著升高,表明汞中毒引起了明显的小鼠肝损伤;与HgCl2组相比,HgCl2+4-PBA组这两种肝功酶的活性降低(表1)。

表1 汞中毒和4-PBA预处理小鼠血清AST和ALT水平检测Tab. 1 Analysis of the level of AST and ALT in the serum of the mercury poisoned mice with or without 4-PBA pretreatment
2 4-PBA抑制汞中毒诱导的肝组织氧化应激
应用检测氧化应激相关试剂盒分析显示:与Control组相比,HgCl2组肝组织MDA水平升高,GSH水平、SOD和GSH-Px活性降低,抗氧化能力明显降低而脂质过氧化水平升高;4-PBA预处理则使汞中毒引起的肝组织上述氧化应激效应基本被逆转(图1)。

图1 各组肝脏MDA和GSH水平,T-SOD和GSH-Px活性分析。与Control比较:*0.01<P<0.05, ** P<0.01;与HgCl2组比较:#0.01<P<0.05,##P<0.01Fig. 1 The level of MDA and GSH and the activity of T-SOD and GSH-Px in the liver tissues of each group. Compared with the control group:*0.01<P<0.05, ** P<0.01; compared with the HgCl2 group: #0.01<P<0.05,##P<0.01
3 4-PBA抑制汞中毒所致肝组织Nrf2和NQO1降低
免疫组织化学染色表明:Nrf2和NQO1在Control组均匀表达于肝组织细胞质;与Control组比较,HgCl2组肝组织中Nrf2和NQO1免疫反应性显著降低,4-PBA预处理使这种降低明显减少,且在细胞质与细胞核中均有不同程度的Nrf2和NQO1表达,即4-PBA能够促进Nrf2和NQO1核内易位(图2A)。Western blot分析显示,与Control组相比,HgCl2显著降低肝组织中Nrf2和NQO1水平,而使用4-PBA预处理显著逆转HgCl2诱导的肝组织中Nrf2和NQO1水平的降低(图2B)。
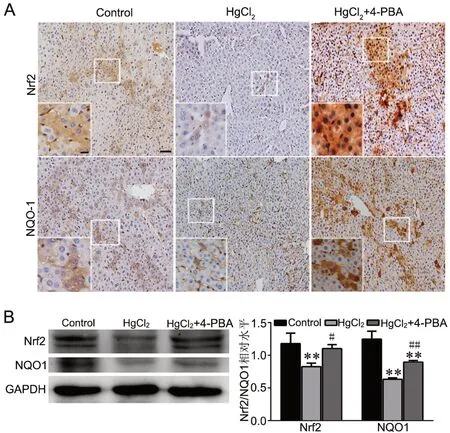
图2 汞中毒和4-PBA预处理肝组织中Nrf2/NQO1水平检测。A,Nrf2/NQO1水平与定位的免疫组织化学检测;比例尺,50μm(局部放大图,20μm)。B,Nrf2/NQO1水平的Western blot检测及其统计学分析;与Control比较:**P<0.01;与HgCl2组比较:#0.01<P<0.05,##P<0.01Fig.2 Evaluation of the level of Nrf2/NQO1 in the liver tissues of mercury poisoned mice with or without 4-PBA pretreatment. A, immunohistochemical examination of the level and localization of Nrf2/NQO1; scale bar, 50μm (the local enlarged view, 20μm). B, Western blot detection and statistical analysis of Nrf2/NQO1 level; compared with the control group: **P<0.01; compared with the HgCl2 group: #0.01<P<0.05; ##P<0.01
讨 论
研究表明汞对人体和动物的多种器官和组织造成毒性作用,尤其是对肝脏的损害极大,会导致肝衰竭[7]。Ahmad等[8]研究发现主要机制是汞暴露诱导ROS、RNS等自由基大量堆积,引起细胞内氧化还原状态的不平衡,即氧化应激。Nrf2是氧化应激中的关键转录因子之一,在抗炎症、抗细胞凋亡、抗肿瘤及调节细胞功能等方面具有重要作用。正常状态下,Nrf2处于稳定非活化状态表达于细胞质中,当细胞处于氧化应激状态时,Nrf2易位到细胞核中并增强下游靶基因的表达,包括醌氧化还原酶1(NQO1)和超氧化物歧化酶(SOD)等[9]。本实验结果显示,与对照组相比,HgCl2组小鼠MDA含量升高,而GSH含量和一些重要的抗氧化酶如GSHPx和T-SOD的活性降低,加快细胞膜脂质过氧化过程。这种变化促使逆转录因子Nrf2蛋白表达下调,从而抑制NQO1蛋白的表达。血清中ALT和AST水平是检测肝功能异常最重要的指标,HgCl2组小鼠血清ALT和AST均显著高于对照组。以上结果表明HgCl2导致小鼠肝脏氧化应激增强,抗氧化能力下降,最终引起肝功能受损。
内质网是细胞内一种重要的多功能细胞器,当内质网内的通路受到干扰,可导致未折叠和错折叠的蛋白质过度累积,即内质网应激。其中,GRP78是ERS的重要传感器,CHOP是ERS诱导细胞凋亡的关键蛋白。在ERS发生时,高水平的GRP78促使CHOP也表达升高,诱导细胞凋亡[10]。本课题组之前的研究发现,HgCl2所致的毒性损伤与ERS有密切的关系:HgCl2暴露引起ERS相关蛋白GRP78、CHOP表达增高并呈浓度依赖,而使用ERS的特异阻断剂4-PBA预先处理可明显降低GRP78、CHOP表达,同时降低Cleaved caspase-3的表达,减少细胞凋亡[11]。据报道,氧化应激可上调相关蛋白CHOP、GRP78的表达和Caspase-12的激活,促使ERS参与重金属中毒致的细胞凋亡[12]。在本研究中使用ERS特异性阻断剂4-PBA预处理组血清ALT和AST活性显著低于HgCl2组,肝脏MDA水平降低,GSH水平、SOD和GSH-Px活性升高,而且Nrf2/ NQO1蛋白表达增强并向核内易位。表明在HgCl2诱导的小鼠肝脏损伤模型中,ERs的特异阻断剂4-PBA可促使Nrf2/NQO1蛋白表达上调,发挥抗氧化的作用,保护肝脏损伤。4-PBA,作为内质网应激的特异性阻断剂,通过何种机制也影响到氧化应激,内质网应激和氧化应激之间存在何种关联,这是我们下一步研究的方向。
综上所述,汞暴露引起小鼠氧化应激,与Nrf2/NQO1通路密切相关,提前给予4-PBA可明显减轻HgCl2诱导的小鼠肝脏氧化应激,改善肝功能,表明4-PBA可能减轻汞暴露引起的氧化应激。

