乔松素对肠缺血/再灌注小鼠发挥肠黏膜保护作用
艾世鹏,胡选亚,王胜文
(南阳市第一人民医院肛肠科,南阳 473001)
肠缺血/再灌注(ischemia/reperfusion,I/R)损伤是与急性肠系膜缺血、烧伤、败血症和失血性休克等临床紧急情况密切相关的病理生理过程,具有高发病率和高死亡率特点[1,2]。肠I/R不仅会引起肠道局部损伤,还会导致远处器官的多器官功能障碍综合征(multiple organ dysfunction syndrome,MODS)甚至多器官功能衰竭(multiple organ failure,MOF),最终导致死亡[3,4]。
乔松素(pinocembrin, Pin)是蜂胶、蜂蜜和一些植物(如生姜根和牛至属植物)中含量较高的5,7- 二羟基黄烷酮类化合物。有研究报道[5]发现,Pin通过抑制NF-κB抑制蛋白α(inhibitor of NF-κB-α,IкBα)、p38-促丝裂原活化蛋白激酶(p38-mitogen-activated protein kinase,p38 MAPK)和c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)的磷酸化水平来减轻肺损伤模型的炎症反应。此外,Pin对脑I/R大鼠模型具有抗海马炎症、抗氧化和抗凋亡的作用[6]。然而,Pin在肠I/R中发挥的作用及其机制尚不清楚。因此,本研究旨在观察Pin在小鼠肠I/R损伤中的作用与机制。
材 料 与 方 法
1 主要试剂
Pin(纯度> 99%)购自武汉科斯坦生物科技有限公司;小鼠IL-1β ELISA试剂盒、小鼠TNF-α ELISA试剂盒、TUNEL凋亡检测试剂盒、RIPA试剂、BCA蛋白定量试剂盒、ECL化学发光试剂盒、β-actin一抗和辣根过氧化物酶(HRP)标记的山羊抗兔IgG二抗均购自上海碧云天生物科技有限公司;二胺氧化酶(diamine oxidase,DAO)、髓过氧化物酶(myeloperoxidase,MPO)、丙二醛(malondialdehyde,MDA)、 谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)和超氧化物歧化酶(superoxide dismutase,SOD)检测试剂盒均购自南京生物建成研究所;兔抗Cleaved caspase-3、兔抗occludin、兔抗ZO-1、兔抗p38 MAPK和兔抗MAPK均购自英国Abcam公司。
2 实验动物和方案
40只6~8周雄性 C57BL/6 小鼠(体重22-25 g)购自华中科技大学动物实验中心【SCXK(鄂)2016—0009】。实验前让小鼠适应环境一周。将小鼠随机分为假手术(Sham)组、肠缺血再灌注模型(I/R)组、低剂量乔松素(15mg/kg)治疗(I/R+Pin15)组和高剂量乔松素(45mg/kg)治疗(I/R+Pin45)组,每组10只小鼠。在建立肠I/R模型前,小鼠禁食8h。按照文献[7]方法构建肠I/R模型:麻醉小鼠,并分离出肠系膜上动脉(superior mesenteric artery,SMA),用无创伤性微血管钳将SMA钳夹30min,然后松开血管钳以恢复SMA血流灌注。取下钳再灌注6h。Sham组除不进行I/R外,其余同I/R组。在乔松素治疗组中,在构建肠I/R模型前2h,按照15mg/kg或45mg/kg的剂量通过尾静脉将将乔松素注射小鼠体内,然后按上述方法进行肠I/R手术。
3 标本收集
在再灌注后6h麻醉小鼠,收集心尖血,并分离血清备用;处死小鼠,并从每只小鼠的相同位置——距回肠末端5cm处截取约10cm的肠段,将其中2cm的肠段用4%多聚甲醛固定24h,常规包埋于石蜡,用于形态学检测;其余的8cm肠段保存在-80℃下备用。
4 组织病理学
将石蜡包埋的回肠组织切成4μm厚的切片,行常规HE染色,光学显微镜下观察小肠组织形态并随机选取视野拍摄图像。20×物镜下,每个切片任选3个非重合随机视野下的图像,按照文献[8]方法,采用Chiu分级评分系统对每个视野下图像进行肠粘膜损伤程度评分。评分标准: 0,粘膜层完整;1,轻度粘膜萎缩,坏死和出血,轻度中性粒细胞浸润,粘膜层完整;2,中度黏膜萎缩,坏死和出血,中性粒细胞浸润中等,黏膜层完整;3,严重的黏膜萎缩,坏死和出血,中度大量中性粒细胞浸润和黏膜层受损;4,广泛的粘膜坏死和出血,中性粒细胞浸润完成,粘膜层消失。每只小鼠统计4~5张切片,取平均值,代表每只小鼠肠粘膜组织的Chiu积分。Chiu积分越高代表肠粘膜损伤程度越严重。
5 血清DAO、MPO、GSH-Px、SOD活性和肠组织炎症因子、MDA含量检测
取各组小鼠的血清,按照DAO活性检测试剂盒说明书步骤,用紫外比色法检测血清中DAO活性。
取各组小鼠冻存的肠组织(0.1g),在冰上用0.9mL生理盐水匀浆15min,1000r/min离心5min收集上清液。用BCA法测定蛋白含量后,分别根据对应的试剂盒说明书步骤,用ELISA法检测TNF-α和IL-1β水平,用硫代巴比妥酸(thiobarbituric acid,TBA)法检测匀浆液中MDA水平,比色法检测MPO和GSH-Px活性,用WST-1法检测SOD活性。然后,根据标本蛋白含量将TNF-α、IL-1β和MDA水平以及MPO、GSH-Px和SOD活性换算为单位mg蛋白中TNF-α、IL-1β和MDA水平以及MPO、GSHPx和SOD活性。
6 TUNEL分析
根据说明书步骤,将5μm厚的肠段在二甲苯中脱蜡并通过梯度降酒精进行水合;用20mg/ml蛋白酶K孵育20min,并在含20mg/mL蛋白酶K的TBS(10mmol/L Tris-HCl,150mmol/L NaCl;pH7.4)中冲洗;将切片与平衡缓冲液孵育30min,用TBS冲洗;在37°C的湿润环境中将切片与TdT酶孵育90min;随后用封闭缓冲液孵育30min。使用DAB显示标记,用苏木素进行复染。将切片脱水、透明封固后,光学显微镜下观察并随机选取视野拍摄图像。20×物镜下,每张切片选4个非重合随机视野下的图像,用Image J软件量化每个视野下图像的TUNEL阳性细胞比例。每只小鼠统计4个切片,取平均值,代表每只小鼠肠粘膜组织中TUNEL阳性细胞比例。
7 蛋白质免疫印迹
取各组小鼠冻存的肠组织(0.1g),在冰上用RIPA匀浆30min,1.0×105r/min离心12min收集上清液。用BCA法检测各样品的蛋白浓度。每样品取35μg蛋白行SDS-PAGE电泳。电转膜后,室温下用5%脱脂乳封闭PVDF膜上蛋白30min,然后分别孵育兔源一抗[occludin(1:2000)、ZO-1(1:3000)、Cleaved caspase-3(1:800)、p38 MAPK(1:4000)、p-p38 MAPK(1:1000)和β-actin(1:10000稀释)]1.5h,TBS-T(10mmol/L Tris-HCl,150mmol/L NaCl,0.05% Tween-20;pH7.4)洗膜3次后,室温孵育HRP缀合的山羊抗兔IgG(1:2000)二抗45min,TBS-T洗膜3次后,用ECL化学发光试剂盒对目的条带显影,用AlphaView软件测量蛋白条带的光密度(OD)值。计算目的蛋白OD值与内参蛋白β-actin OD值的比值,以假手术组OD值比值为100%,归一化各实验组OD比值。
8 统计学分析
实验中所得的数据用均数±标准差表示,采用SPSS 19.0统计软件进行分析,多组之间比较采用单因素方差分析;P<0.05被认为差异具有统计学意义。
结 果
1 乔松素抑制肠缺血/再灌注肠组织的病理损伤和血清DAO活性上升
HE染色显示,Sham组小肠组织绒毛和肠壁正常;I/R组表现为肠道绒毛缩短、绒毛上皮缺失、多处糜烂、炎性细胞浸润、坏死和肠壁出血;I/R+15mg/kg Pin 和I/R+45mg/kg Pin组肠粘膜损伤均明显改善(图1A)。对肠组织进行Chiu评分显示,与Sham组相比,I/R组肠粘膜组织学评分明显增加;与I/R组比较,I/R+15mg/kg Pin 和I/R+45mg/kg Pin组肠粘膜组织学评分明显降低(图1B)。除此之外,与Sham组比较,I/R组血清DAO活性显着升高;与I/R组比较,I/R+15mg/kg Pin 和I/R+45mg/kg Pin组血清DAO活性明显降低(图1C)。
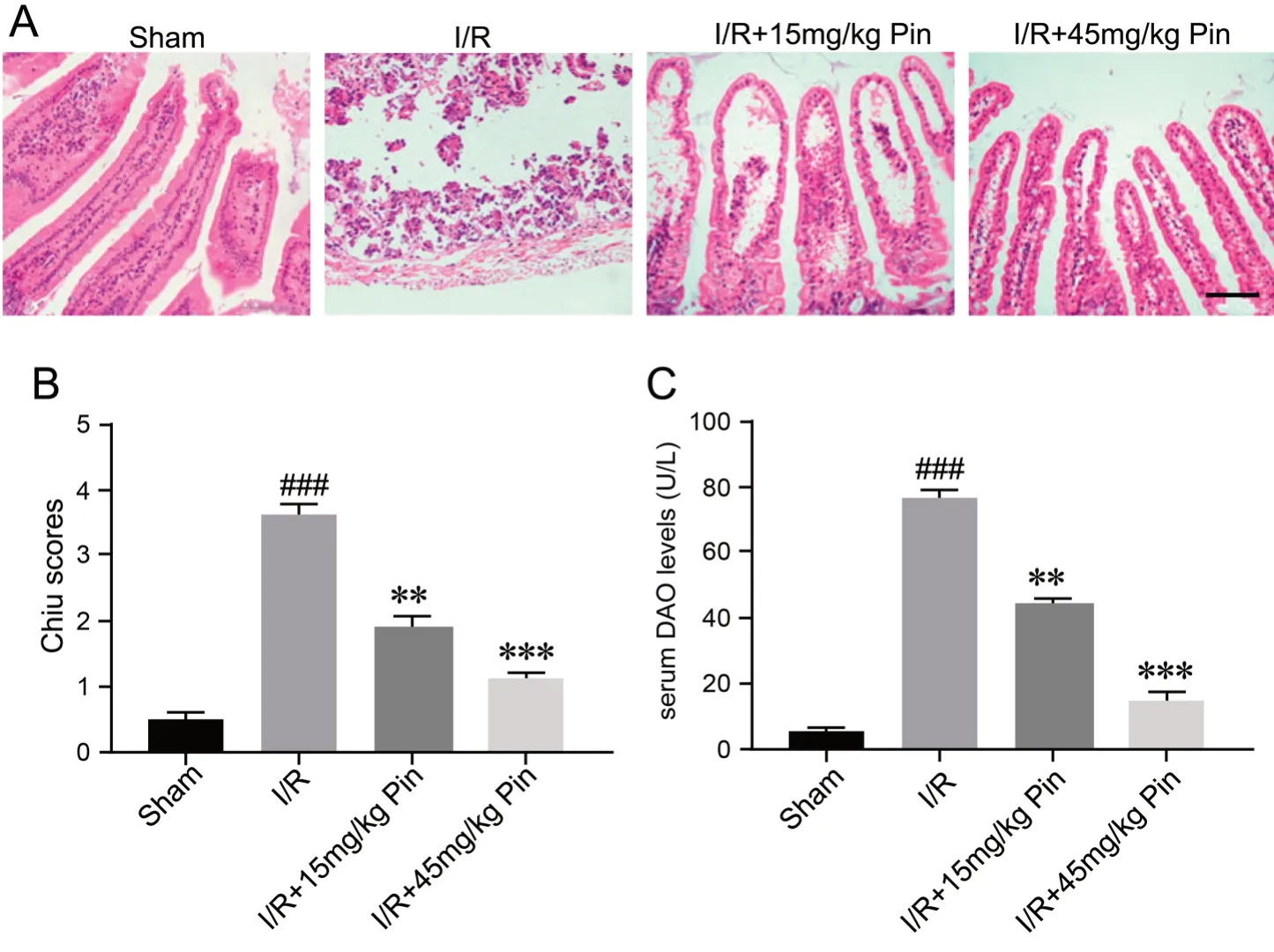
图1 各组肠组织的病理变化以及血清DAO活性分析。A,小肠HE染色的代表图像;比例尺,50μm。B,肠粘膜的组织学评分统计学分析。C,血清DAO活性统计学分析。###,与Sham组相比, P<0.001;与I/R组相比: **,0.001<P<0.01;***P<0.001;n =10Fig.1 Analysis of the pathological changes of intestinal tissues and serum DAO activity in each group. A,representative HE staining images of the intestinal tissues; scale bar, 50μm;B, statistical analysis of Chiu scores of the intestinal mucosa; C, statistical analysis of serum DAO activity.###, P<0.001 vs Sham group; **,0.001<P<0.01; ***, P<0.001 vs I/R group; n=10
2 乔松素抑制肠缺血/再灌注肠组织中细胞凋亡和TNF-α和IL-1β的升高
TUNEL染色显示,I/R组肠组织中凋亡细胞数较Sham组明显增加, 15mg/kg和45mg/kg 乔松素处理可显著减少I/R所致的肠组织凋亡细胞的增加(图2A、B)。ELISA分析表明,与Sham组比较,I/R使小鼠肠组织中TNF-α和IL-1β水平显著升高,两种剂量的乔松素处理可显著抑制I/R所致的TNF-α和IL-1β水平升高(图2C、D)。
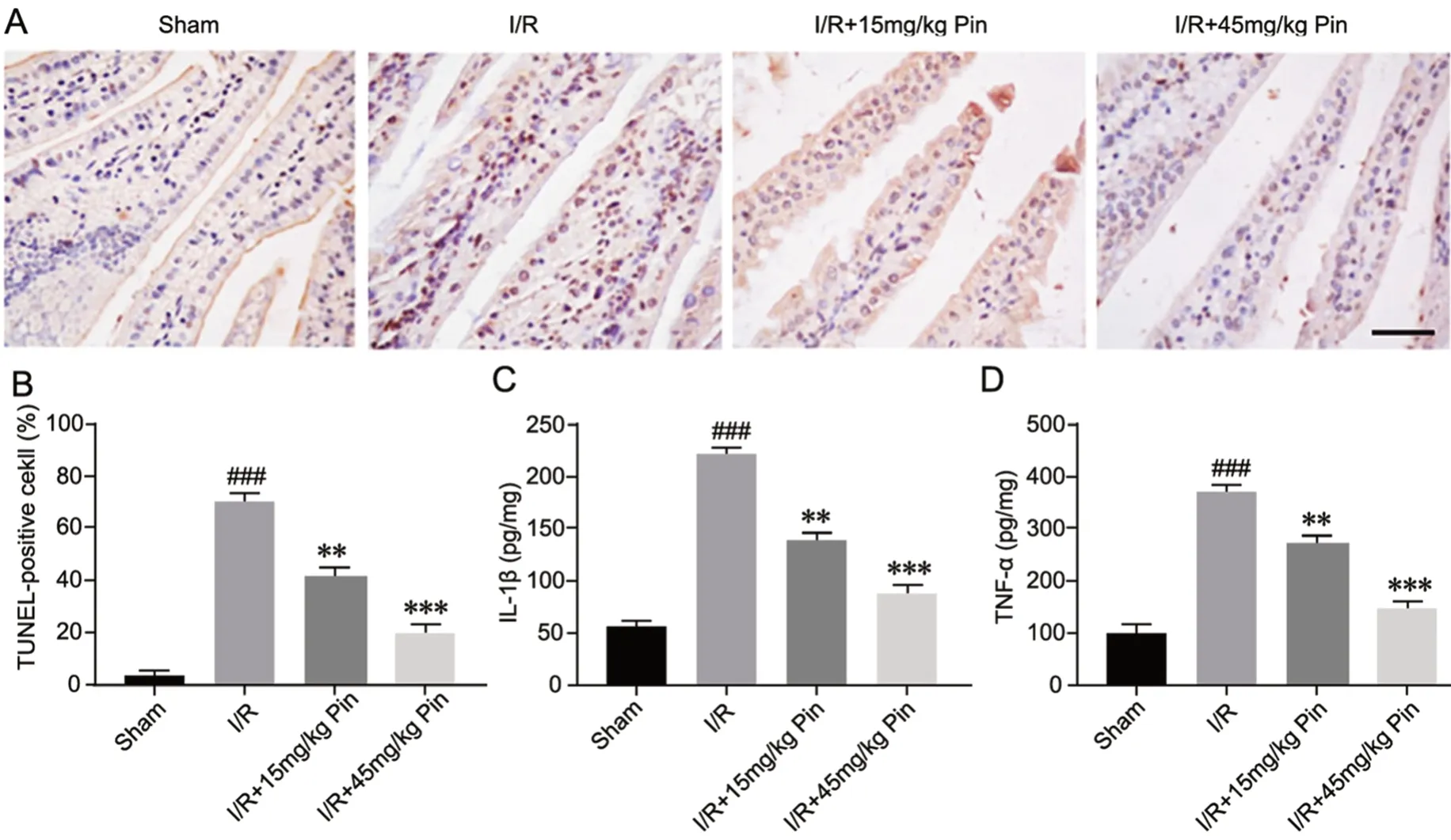
图2 各组肠组织中细胞凋亡以及TNF-α和IL-1β水平检测。A,小肠TUNEL染色的代表性图像; 比例尺,50μm。 B,TUNEL阳性细胞数统计学分析。C,IL-1β水平统计学分析。D,TNF-α水平统计学分析。###,P<0.001 vs假手术组;与I/R组相比: **,0.001<P<0.01; ***,P<0.001;n=10Fig. 2 Assay of the level of apoptosis, TNF-α and IL-1β in intestinal tissues in each group. A, representative TUNEL staining images of intestinal tissues; scale bar, 50μm; B, quantitative analysis of TUNEL-positive cells; C, IL-1β level; D, TNF-α level. ###P<0.001 vs Sham group; **P<0.01,***P<0.001 vs I/R group; n=10.
3 乔松素抑制肠缺血/再灌注肠组织中MDA和MPO的升高与SOD和GSH-Px的降低
如图3所示,与Sham组比较,I/R组肠组织中MDA水平和MPO活性均明显升高,而SOD和GSHPx活性均明显降低;与I/R组比较,I/R+15mg/kg Pin和I/R+45mg/kg Pin组肠组织中MDA水平和MPO活性均明显降低,而SOD和GSH-Px活性均明显升高。

图3 各组肠组织中SOD(A)、MDA(B)、MPO(C)和GSH-Px(D)水平或活性检测。###,与Sham组相比,P<0.001;与I/R组相比:**,0.001<P<0.01;***,P < 0.001;n=10Fig. 3 Detection of the level or activity of SOD (A), MDA (B), MPO (C) and GSH-Px (D) in intestinal tissues in each group. ###, P<0.001 vs Sham group; compared with I/R group: **, 0.001<P<0.01; ***, P<0.001; n=10
4 乔松素抑制肠缺血/再灌注肠组织中occludin和ZO-1水平降低与Cleaved caspase-3和p38 MAPK水平升高
Western blot检测显示: 在I/R组肠组织中,occludin和ZO-1水平较Sham组显著降低,p38 MAPK和Cleaved caspase-3水平较Sham组显著升高;与I/R组比较,I/R+15mg/kg Pin 和I/R+45mg/kg Pin组肠组织中occludin和ZO-1显著升高,p38 MAPK和Cleaved caspase-3水平显著降低(图4)。

图4 各组肠组织中occludin、ZO-1、Cleaved caspase-3、p-p38 MAPK水平Western blot检测。A,代表性的Western blot检测;B—E,occludin(B)、ZO-1(C)、 p-p38 MAPK/p38 MAPK(D)和Cleaved caspase-3(E)水平定量分析。###,与Sham组相比,P<0.001;与I/R组相比:**,P<0.01;***,P<0.001;n=10Fig. 4 Western blot examination of the level of occludin, ZO-1, Cleaved caspase-3 and p-p38 MAPK in intestinal tissues in each group. A, representative Western blot detection; B to E, quantification of the level of occluding (B), ZO-1 (C), p-p38 MAPK/p38 MAPK (D) and Cleaved caspase-3 (E). ###,P<0.001 vs Sham group; compared with I/R group: **, P<0.01; ***, P<0.001; n=10
讨 论
虽然,防治肠I/R损伤的药物颇多,但总体效果并不理想。因此,目前急需寻找新的有效的治疗肠I/R损伤的药物。Pin具有抗炎、抗氧化和镇痛作用[5,6],提示其可能具有潜在的抗肠I/R损伤的作用。肠I/R损伤可破坏肠黏膜完整性并诱发肠黏膜屏障功能障碍[3,8]。因此,本研究进一步评估Pin是否对肠I/R损伤具有保护作用。DAO是存在于肠上皮绒毛细胞中的一种高活性的细胞内酶,当肠损伤后会释放入血液中,因此血中DAO活性可在一定程度反映肠黏膜损伤[9]。HE染色的Chiu评分、TUNEL阳性和Cleaved caspase-3的阳性表达直接反映肠黏膜损伤的程度。本研究通过检测上述指标显示,Pin能维持肠I/R后的肠黏膜完整性并能降低血中DAO活性和肠组织中细胞的凋亡。肠黏膜紧密连接蛋白的表达情况反映了肠黏膜屏障功能的完整性,而肠黏膜屏障功能缺陷的最主要特征正是紧密连接蛋白的降解[8,10]。本研究显示,Pin能提高肠I/R后紧密连接蛋白(occludin和ZO-1)的表达,提示Pin能维持肠I/R后的肠黏膜屏障功能。以上结果充分显示了,Pin能改善肠I/R造成的肠黏膜病理形态改变,保护肠黏膜结构和屏障功能的完整性,提示Pin是具有潜力的抗肠I/R损伤的防护剂。
氧化应激在I/R损伤的发生和发展中起关键作用。自由基的水平在再灌注过程中急剧增加,同时伴随着抗氧化酶活性的降低,而过量的活性氧的聚集反过会加剧肠组织损伤和炎性反应[9,11]。MDA是脂质过氧化作用的产物,其含量可反映体内过氧化作用的严重程度[12]。MPO是反映中性粒细胞浸润程度的指标[9,12],而GSH-Px和SOD是重要的抗氧化因子[9,11,12]。本研究结果表明,肠I/R损伤时发生氧化应激的代偿失调,其中MDA和MPO含量均明显增加,而GSH-Px和SOD含量则明显下降;Pin预处理可逆转肠I/R损伤导致的上述氧化应激标记物的变化和白细胞浸润以及IL-1β和TNF-α促炎因子的表达,这些发现证明Pin在肠I/R中具有抗炎和抗氧化的作用。
肠I/R损伤的发生和进展机制非常复杂,其中p38 MAPK信号通路的激活可导致肠上皮细胞的凋亡和坏死,激活中性粒细胞并增加细胞因子和粘附分子的表达水平,从而加剧肠I/R损伤;而减弱p38 MAPK信号活性能减轻肠I/R损伤[13]。本研究结果表明,Pin能抑制肠I/R损伤小鼠肠组织中p38 MAPK的蛋白表达。因此,Pin对肠I/R后的肠黏膜的保护作用可能在一定程度上与其降低p38 MAPK信号活性相关。
总之,本研究结果显示,Pin预处理在治疗肠道I/R损伤方面具有一定的有益作用,包含维持肠黏膜结构和形态以及屏障功能的完整性,且这一作用可能与其抗炎、抗氧化和减弱p38 MAPK信号活性相关。

