放大胃镜对胃黏膜隆起病变定性诊断的临床研究
李佳
胃黏膜突出在临床检查工作中非常常见,主要类型有息肉、息肉样突出、丘疹状突出、黄(白)斑样微突出和不规则突出。其中有良性病变例如慢性炎症,癌前病变例如肠化生、上皮内瘤变、腺瘤等和恶性病变例如早期胃癌或淋巴瘤,普通胃镜很难做出鉴别诊断,有时甚至组织病理学检查也很难做出定性诊断[1]。放大胃镜可以直接或借助电子染色和化学染色技术来放大局部病变80~400 倍以观察胃黏膜的微观结构。通过寻找不同类型突出损伤表面的微结构的变化特性、活组织检查(靶向活组织检查)在表面结构的最可疑部分,可以准确获得突出病变的定性诊断。此次研究通过对比放大胃镜和普通胃镜的观察结果,评价其诊断效果及价值,现报告如下。
1 资料与方法
1.1 一般资料 此次试验样本取自2019 年6 月~2020 年6 月在大连港医院行胃镜检查的患者50 例,根据检查方法不同分为放大胃镜组和普通胃镜组,各25 例。放大胃镜组男14 例,女11 例;年龄32~71 岁,平均年龄(52.6±6.9)岁。普通胃镜组男15 例,女10 例;年龄33~72 岁,平均年龄(54.3±7.1)岁。两组患者的一般资料比较,差异无统计学意义(P>0.05),具有可比性。
1.2 纳入标准 ①均自愿接受胃镜检查;②年龄>25 岁;③均有不同程度的上消化道症状。
1.3 排除标准 ①患有精神疾病史;②已经明确胃恶性肿瘤的患者;③患有其他恶性肿瘤的患者;④因自身原因无法进行胃镜检查的患者;⑤有呕血或黑便者;⑥明显消瘦且有消化性溃疡病史者;⑦胃镜发现胃恶性病灶者,如火山口样隆起、皮革袋胃征象;⑧隆起病灶伴有明显溃疡者;⑨病理诊断单纯腺瘤者。
1.4 方法 设备与器材:普通胃镜采用Fujinon EC-4400 型电子胃镜、放大胃镜采用Fujinon EG-590ZW型高清胃镜以及配套设备;病理科相关实验室采用德国产RM 2235-LEICA 切片机、奥林巴斯BX 显微镜及病理图文系统等。普通胃镜组:行常规普通胃镜下操作及常规黏膜活检。放大胃镜组:术前5 min 受检者口服祛泡剂,左侧卧位,放大胃镜头端安装透明帽,常规进镜,依次观察食管-贲门-胃底-胃体-胃窦-幽门-十二指肠,再退镜至胃窦,倒镜观察胃角-胃体小弯-胃底-贲门,发现黏膜隆起病变后局部冲洗黏膜面,对准病灶黏膜,调焦放大胃镜至300~400 倍,仔细观察胃小凹和黏膜微血管情况,并进行电子染色,采集彩色照片。观察结束后调焦放大胃镜到60 倍(该镜的最小倍数),对以上观察到的可疑病灶处(胃小凹不规则或破损或微血管紊乱)活检2~3 块,送病理。病理诊断方法:所选病例标本均以4%中性甲醛缓冲溶液固定,常规脱水,石蜡包埋切片,苏木精伊红(HE)染色。按照2010 年版消化系统肿瘤世界卫生组织(WHO)分类诊断[1],常规诊断中少数低分化癌患者,均行CKpan 和LCA 免疫组织化学标记确诊。
1.5 观察指标 比较两组检出结果,包括胃黏膜慢性炎症、癌前病变、早期胃癌;并观察放大胃镜组的各病理诊断与胃小凹分型、微血管形态的关系,胃小凹分型包括Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ型,微血管形态包括A、B、C、D 型。
1.6 统计学方法 采用SPSS20.0 统计学软件进行统计分析。计量资料以均数±标准差()表示,采用t检验;计数资料以率(%)表示,采用χ2检验。P<0.05 表示差异具有统计学意义。
2 结果
2.1 两组检出结果比较 放大胃镜组癌前病变及早期胃癌总检出率44.00%高于普通胃镜组的16.00%,差异具有统计学意义(P<0.05)。见表1。
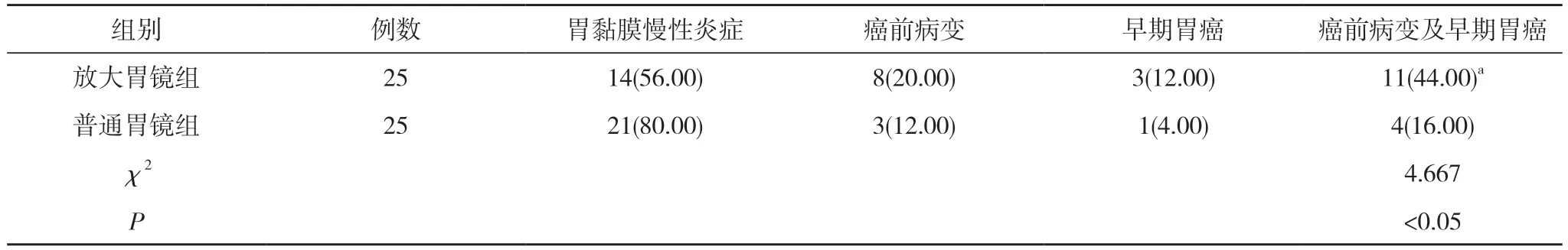
表1 两组检出结果比较[n(%)]
2.2 放大胃镜组的各病理诊断与胃小凹分型、微血管形态的关系 胃黏膜慢性炎症胃小凹分型主要为Ⅰ型、Ⅱ型,微血管形态主要为A 型、B 型;其他病变胃小凹分型主要为Ⅲ型、Ⅳ型、Ⅴ型,微血管形态主要为C 型、D 型。见表2。

表2 放大胃镜组的各病理诊断与胃小凹分型、微血管形态的关系[n(%)]
3 讨论
胃黏膜分子生物学与形态学改变是胃部疾病发生、发展与诊断的基础,黏膜的良性病变有可能转化为恶性病变[2]。胃黏膜的上皮内瘤变被视作胃癌的癌前病变。胃癌的诊断方法中内镜是最直接和准确的方式。目前普通胃镜是诊断早期胃癌最常用的方法,但仍有1.0%~9.0%的假阴性率,由此可导致胃癌的误诊[3]。有研究发现,当胃黏膜发生病变时首先发生胃小凹形态结构的改变,而普通胃镜下却难以观察到胃小凹的形态改变[4]。只有通过对分辨率进行数十倍及数百倍放大的新型内镜才能实现对胃小凹形态的观察。本研究通过放大胃镜观察隆起病变的胃小凹形态,并指导镜下活检,明显提高了早期胃癌和癌前病变的检出率。本研究结果发现癌前病变及早期胃癌总检出率较高;虽低于发达国家水平[5],但远高于普通胃镜组。放大胃镜用于诊断早期胃癌,其主要是判断病变的良恶性、区分其组织学类型以及判断恶性病变的浸润深度和广度。由于黏膜的癌变一般是在有炎症浸润的基础上发生的,而炎症本身对胃黏膜的微细形态有一定的影响,所以有时要想判断出癌变的部位及界限是比较困难的[6]。樊锦河等[7]认为在胃小凹形态未被破坏的情况下,乳头状早期胃癌常为红色病灶及不规则的C 型小凹;而高分化腺癌的特征为细条纹状萎缩的胃黏膜,其表面粗糙;中分化管状腺癌的胃小凹与周围相似,不易鉴别;而高分化小细胞癌和低分化腺癌不形成明显的腺管状外观,其主要部位一般为糜烂性改变,胃小凹消失[8]。胃黏膜表层有毛细静脉丛,其环绕胃小凹的颈部并彼此汇合形成下行性集合小静脉,在黏膜固有层内垂直或略斜下行至黏膜肌层,注入黏膜下层的静脉丛,每根集合小静脉引流收集来自环绕60 个胃小凹的毛细血管环的血流[9]。胃体部黏膜的集合小静脉分布均匀规则,用普通胃镜观察时表现为无数均匀一致的小红点,改换放大内镜观察时可见此类红点呈海星状。胃黏膜发生病变时,不论是水肿糜烂还是占位挤压,必然表现为微血管的走向改变、粗细紊乱甚至中断,肿瘤生长至进展期则表现除外[10]。本研究证实:胃黏膜慢性炎症胃小凹分型主要为Ⅰ型、Ⅱ型,微血管形态主要为A 型、B 型;其他病变胃小凹分型主要为Ⅲ型、Ⅳ型、Ⅴ型,微血管形态主要为C 型、D 型。幽门螺杆菌(Hp)感染因细菌附着于胃黏膜表面,继之分泌毒素,胃黏膜出现局部破损,胃小凹及周围微血管均会发生相应变化[11]。Hp 感染多发生在胃小凹,这也间接证明Hp 感染与胃癌及癌前病变存在某种关系。尽管胃小凹和微血管分别与胃镜诊断和病理诊断均有较密切的相关性,但具体到某一个患者总会表现为不同的微黏膜相,即既有胃小凹的表型又有微血管的表象,按照排列组合理论上存在如下20 种组合形式的微黏膜相:Ⅰ+A、Ⅰ+B、Ⅰ+C、Ⅰ+D、Ⅱ+A、Ⅱ+B、Ⅱ+C、Ⅱ+D、Ⅲ+A、Ⅲ+B、Ⅲ+C、Ⅲ+D、Ⅳ+A、Ⅳ+B、Ⅳ+C、Ⅳ+D、Ⅴ+A、Ⅴ+B、Ⅴ+C和Ⅴ+D。胃小凹规则完整的病灶不可能发生微血管的明显变化,反之亦然。这与王青釭等[12]指出的条纹状、网格状的胃小凹以及出现肿瘤血管是放大胃镜下早期胃癌的特征性改变。
综上所述,放大胃镜诊断胃黏膜隆起病变临床价值较高,在放大300 倍以上时可直接通过观察(结合染色)胃小凹及微血管的表象提出初步诊断,回缩到60倍进行靶向活检,诊断准确性更进一步提高,较普通胃镜能明显提升早期胃癌及癌前病变的检出率。

