牡蛎肽对CCl4诱导肝纤维化大鼠核因子-κB、诱导型一氧化氮合成酶的影响
邓凯翔 黄津
作者单位:1 福建医科大学附属南平第一医院中医康复科,福建 南平 353000
2 福建省第二人民医院感染科,福建 福州 350003
牡蛎肽(Oyster peptide,OP)属性微寒、味咸,具有多种生物功效,包括调节免疫、抗病毒、抗肿瘤等,在我国中医史籍《千金要方》、《本草纲目》中均有详细记载[1]。有研究发现,牡蛎提取物可以改善酒精性肝病患者的肝脏酶系统,稳定肝细胞膜结构,长期服用可以软化肝脏,具有平肝潜阳、软坚散结之效。现代医学研究也显示,其可以诱导成纤维细胞增殖、活化、凋亡,对不同组织器官均有一定的抗纤维化作用[2]。有研究发现核因子-κB(NF-κB)/iNOS 信号途径在肝星状细胞(Hepatic stellate cell,HSC)实验方面有重要作用,可以促进HSC 凋亡,减少细胞外基质(Extracellular matrix,ECM)成分的表达[3]。本研究通过大鼠肝纤维化模型了解牡蛎肽对肝组织NFκB、iNOS 表达的影响并探讨其作用机制。
1 材料与方法
1.1 实验动物清洁级SD 大鼠50 只,体重200~220g,由福建医科大学实验动物中心提供[SCXK(闽)2018-0004],雌雄各半,雌雄分开适应性饲养1 周后采用随机数字表法将大鼠分为5 组,每组10只。实验方案通过我院伦理委员会批准。
1.2 药物与试剂OP(中国食品工业发酵研究院);NF-κB p65 抗体、兔抗人iNOS 单克隆抗体(杰圣德生物有限公司,武汉);CCl440ml+花生油60ml(第四化学试剂厂,天津);RT-PCR 试剂盒(Sigma 公司,美国);NO 检测试剂盒(建成公司,南京)。
1.3 分组①正常组(A 组):腹腔内每周注射3 次等体积生理盐水;②模型组(B 组):腹腔内每周注射2 次40% CCl4花生油溶液0.2ml/100g;③OP 低、中、高剂量组(C 组、D 组、E 组):造模同时分别予OP 0.5g/kg、1.0g/kg、2.0g/kg。采用离体消化分离大鼠HSC,并对细胞活性及纯度进行鉴定[3]。
1.4 方法
1.4.1 免疫组织化学检测肝组织Ⅰ、Ⅲ型胶原 每张切片观察10 个高倍视野,记录显色程度和范围。显色程度用弱、中、强表示;显色范围占高倍视野<1/4 时记(+)、1/4~2/4(++),2/4~3/4(+++),>3/4(++++)。将显色程度和范围换算成显色指数,即显色指数=显色程度×显色范围(+、++、+++、++++分别按1、2、3、4 分计算),以10 个视野显色指数的平均数为蛋白表达的显色指数。
1.4.2 吖啶橙/溴化乙锭(AO/EB)双重染色检测HSC凋亡 细胞凋亡率计算公式:细胞凋亡率=(凋亡早期细胞数+凋亡晚期细胞数)/细胞总数×100%。
1.4.3 RT-PCR 检测肝组织NF-κB 和iNOS mRNA 提取肝组织总RNA,进行总RNA 纯度分析、cDNA合成,PCR 反应引物序列:iNOS(232bp)上游5'-CGAAAGGGGAATGGATGGC-3',下游5'-ATTGCAG CGAAGTATTTGAACG-3';NF-κB(164bp)上游5'-CGGGTTTGAGGCTGCTAT-3',下游5'-CTCCTTTAC TCCCAGTTCTG-3';β-actin(202bp)上游5'-GGT AAAACCTGCTATCCAACA-3',下游5'-GGACTCAT CTCGTACCTGCT-3'。扩增PCR 反应体系,反应条件:94℃预变性1min 30s;94℃变性30s,57℃退火30s,72℃延伸30s,循环30 次;72℃延伸5min。以NF-κB/β-actin、iNOS/β-actin 表示mRNA。
1.4.4 Western blot 法检测肝组织NF-κB、iNOS 蛋白肝组织总蛋白的提取:把肝组织剪切成细小的碎片,加入RIPA 裂解液,混匀。RIPA 裂解液在使用前数分钟内加入PMSF,使PMSF 的最终溶度为1mM。按常规方法进行蛋白检测,采用增强型化学发光系统显影,结果以NF-κB/GAPDH、iNOS/GAPDH 表示。
1.5 统计学方法采用SPSS 25.0 软件分析,计量资料以±s表示,多组间比较采用单因素方差分析,两两比较采用t检验,P<0.05 为差异有统计学意义。
2 结果
2.1 各组肝组织Ⅰ、Ⅲ型胶原表达比较A 组汇管区和中央静脉管壁可见少量Ⅰ、Ⅲ型胶原表达。B组汇管区中可见大量Ⅰ、Ⅲ型胶原增生,呈棕褐色。与B 组比较,A 组、C 组、D 组、E 组的Ⅰ、Ⅲ型胶原均减少,差异有统计学意义(Ⅰ型胶原:F=65.32,P<0.05;Ⅲ型胶原:F=57.49,P<0.05);与D 组比较,C 组的Ⅰ、Ⅲ型胶原均增多,差异有统计学意义(P<0.05);C 组、D 组与E 组比较,Ⅰ、Ⅲ型胶原表达差异有统计学意义(P<0.05),见表1。
表1 各组Ⅰ型和Ⅲ型胶原表达情况(μg/L,±s)
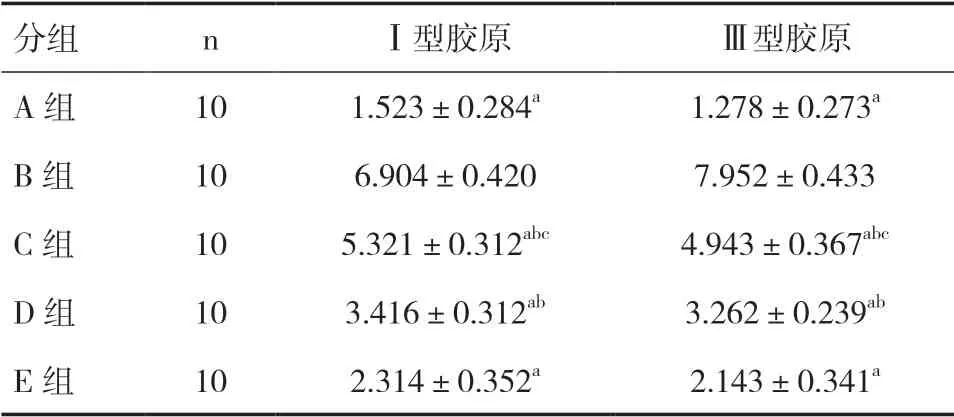
表1 各组Ⅰ型和Ⅲ型胶原表达情况(μg/L,±s)
注:与B 组比较,aP<0.05;与E 组比较,bP<0.05;与D 组比较,cP<0.05
分组nⅠ型胶原Ⅲ型胶原A 组101.523±0.284a1.278±0.273a B 组106.904±0.4207.952±0.433 C 组105.321±0.312abc4.943±0.367abc D 组103.416±0.312ab3.262±0.239ab E 组102.314±0.352a2.143±0.341a
2.2 各组HSC 凋亡率比较B 组HSC 凋亡率为(3.89±0.59)%,C 组为(5.97±1.46)%,D 组为(21.85±3.98)%,E 组为(32.64±5.06)%。B 组和C 组之间HSC 凋亡率差异无统计学意义(P>0.05);经中高剂量OP 干预后HSC 凋亡率与其他各组比较明显升高,差异有统计学意义(P<0.05),见图1。

图1 OP 处理前后HSC AO/EB 双重染色结果(×40)
2.3 各组NF-κB 和iNOS mRNA 表达比较A 组NF-κB、iNOS mRNA 仅有少量表达,B 组表达明显增多,差异有统计学意义(P<0.05)。OP 干预组NF-κB、iNOS 表达较B 组明显减少,差异均有统计学意义(P<0.05);随着OP 剂量的增加,NF-κB、iNOS mRNA 表达逐渐减少,各干预组间比较差异均有统计学意义(P<0.05),见图2、表3。
表3 各组NF-κB、iNOS mRNA 表达(±s)

表3 各组NF-κB、iNOS mRNA 表达(±s)
注:与B 组比较,aP<0.05;与E 组比较,bP<0.05;与D 组比较,cP<0.05
分组nNF-κBiNOS A 组100.213±0.062a0.328±0.062a B 组101.432±0.2571.731±0.316 C 组100.957±0.203abc 0.889±0.183abc D 组100.513±0.154ab0.613±0.114ab E 组100.291±0.048a0.273±0.053a
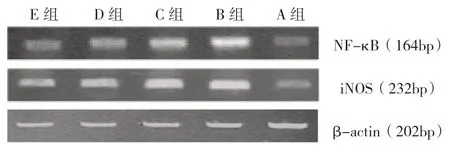
图2 各组NF-κB、iNOS mRNA 表达
2.4 各组NF-κB 和iNOS 蛋白表达比较A 组NF-κB、iNOS 蛋白表达较少,B 组表达明显增多,差异有统计学意义(P<0.05)。各OP 干预组NF-κB、iNOS 表达较B 组明显减少,差异均有统计学意义(P<0.05);随着OP 剂量的增加,NF-κB、iNOS 蛋白表达逐渐减少,各干预组之间比较差异均有统计学意义(P<0.05),见表4。
表4 各组NF-κB、iNOS 蛋白表达(±s)

表4 各组NF-κB、iNOS 蛋白表达(±s)
注:与B 组比较,aP<0.05;与E 组比较,bP<0.05;与D 组比较,cP<0.05
分组nNF-κBiNOS A 组100.194±0.081a0.102±0.053a B 组101.283±0.1281.101±0.253 C 组100.898±0.189abc 0.752±0.148abc D 组100.449±0.063ab0.497±0.081ab E 组100.212±0.051a0.189±0.065a
3 讨论
OP 是通过肽分子生物技术将牡蛎酶解制作而成,属于小分子低聚肽,完全保留牡蛎原有的营养成分,比氨基酸、蛋白质吸收效率高,在机体代谢方面具有更佳的生物活性,比普通牡蛎制品的生物效价更高[4]。本研究通过AO/EB 染色检测OP 对HSC生长情况的影响,发现OP 具有抑制HSC 凋亡的作用,提示牡蛎小分子肽可能参与肝纤维化的修复。
肝纤维化的主要病理特征是ECM 的过度增生和沉积,HSC 可通过肝细胞、巨噬细胞等旁分泌的NF-κB 刺激转化为肌成纤维细胞,活化、增殖并自分泌NF-κB,进而促进HSC 进一步活化,不断合成ECM,肝纤维化得以持续进展[5]。在HSC 活化早期,NF-κB 可刺激ECM 的合成与分泌,其中主要包括促进Ⅰ、Ⅲ型胶原等的合成[6]。早期临床研究发现肝硬化患者NF-κB 浓度较正常对照组明显增高,同时Ⅰ、Ⅲ型前胶原含量也明显增加,并与NF-κB 呈正相关[7,8],说明NF-κB 可刺激硬化肝组织合成ECM。
iNOS 在除神经元外的多种细胞中均有表达,催化NO 生成速度慢、量较多,造成细胞和组织损伤[9,10]。本研究免疫组化染色结果显示,模型组大鼠肝组织Ⅰ、Ⅲ型胶原的表达较对照组明显增高,而OP 干预组表达均较模型组减少,尤其以OP 高剂量组最显著。可推论OP 具有减少细胞外基质成分Ⅰ、Ⅲ型胶原合成,防治肝纤维化的作用。同时检测NF-κB、iNOS mRNA 在各组中的表达,结果显示NF-κB、iNOS mRNA 在模型组中高表达,在OP干预组表达明显减少,模型组与OP 干预组之间比较差异有统计学意义(P<0.05);同时NF-κB、iNOS蛋白的表达在各OP 干预组之间比较差异也有统计学意义(P<0.05),说明可能存在剂量依赖性。由以上可知,OP 在减少Ⅰ、Ⅲ型胶原表达的同时可抑制纤维化肝组织NF-κB、iNOS 的表达。因此,推论OP 可能通过下调NF-κB 和iNOS 的表达,从而减少ECM 的合成,发挥防治肝纤维化的作用。
综上所述,本研究通过细胞组织学、分子生物学等方面研究发现OP 可防治大鼠肝纤维化,具有一定剂量依赖性,经过干预后肝组织Ⅰ、Ⅲ型胶原的增生受抑制,其抗肝纤维化机制可能与下调NFκB、iNOS 的表达有关,OP 可介导NF-κB/iNOS 信号通路的发生发展过程。

