Acsl4、Topo Ⅱα在浸润性乳腺癌组织中表达与HER2、PR及ER的关系
李伟 尚宏清 王冰涛
乳腺癌是一种分子异质性肿瘤,发病机制复杂,由多种基因导致[1]。乳腺癌的发病率在我国青年女性群体中逐年上升,给防治带来一定程度的影响,研究乳腺癌的发病机制对于早期防治具有积极的意义[2]。长链脂酰辅酶A 合成酶4(acyl-coa synthetase long-chain family member 4,Acsl4)是脂肪酸代谢的关键酶,能够引发细胞凋亡[3]。拓扑异构酶α(TopioisomeraseⅡα,TopoⅡα)是由TOPⅡ基因进行编码的DNA 拓扑异构酶,参与DNA 复制和转录的重要进程,其蛋白的过量表达能够反应细胞的增殖[4]。研究[5]表明,在乳腺癌患者体内存在TopoⅡα 异常表达的情况,本研究检测乳腺癌患者体内Acsl4、TopoⅡα 的表达情况,并分析其与与乳腺癌发生和发展的关系,现将报道如下。
1 一般资料与方法
1.1 一般资料
收集本院2019年4月至2021年5月期间行乳腺癌改良根治术患者的病理标本126 例作为观察组。纳入标准:①病理标本、免疫组化结果、临床资料均完整无缺失;②均符合《中国临床肿瘤学会乳腺癌诊疗指南》诊断标准[6],确诊为浸润性小叶癌及浸润性导管癌;③患者术前未接受过相关放化疗或新辅助放化疗;④治疗前无乳腺癌发病史。排除标准:①合并其他恶性肿瘤患者;②合并癌细胞远处转移及炎性乳腺癌患者;③具有明确的遗传性乳腺癌家族史,为高危乳腺癌并发者;④术前行过放化疗及内分泌、分子靶向治疗。观察组平均年龄(46.23±10.79)岁,其中未绝经56 例,绝经70 例;TNM 分期[7]为Ⅰ~Ⅱ期69 例,Ⅲ~Ⅳ期57 例;淋巴结转移52 例,未转移74 例;肿瘤直径<2 cm 36 例,肿瘤直径2~5 cm 50 例,肿瘤直径≥5 cm 40 例;病理分级高分化42 例,中分化54 例,低分化30 例;HER2 阴性37 例,HER2 阳性89 例;PR 阴性86 例,PR 阳性40 例;ER 阴性87 例,ER 阳性41 例。另取同期因良性病变手术切除的乳腺组织标本42 例作为对照组,对照组平均年龄(47.11±10.75)岁。两组患者均为女性,年龄比较,差异无统计学意义(P>0.05)。本研究所有患者均签订了知情同意书,且本研究经过本院医学伦理委员会批准。
1.2 试剂与方法
兔抗人Acsl4 单克隆抗体、鼠抗人TopoⅡα 单克隆抗体均购于上海梦泽生物科技有限公司,稀释比例均为1∶100。所有病理标本经10%福尔马林溶液固定,石蜡包埋,5 μm 连续切片后,采用免疫组织化学法检测Acsl4 和TopoⅡα 表达情况,具体操作按照免疫组化试剂盒说明书进行,分别加入一抗、二抗,DAB 显色、苏木精复染后,由已知Acsl4、TopoⅡα 阳性切片作为阳性对照,PBS 代替一抗作为阴性对照,进行光镜下观察。所有切片均由本院2 位资深病理医师双盲阅片得出结果。
1.3 观察指标
Acsl4、TopoⅡα 的染色结果判定[8-9]:Acsl4 以胞质、胞膜含有棕黄色颗粒的肿瘤细胞计为阳性细胞,根据染色程度不着色、淡黄色、棕黄色、棕褐色分别为0 分、1 分、2 分、3 分。根据阳性细胞范围无阳性细胞、阳性细胞1%~10%、10%~50%、50%~80%、80%~100%分别为0 分、1 分、2 分、3 分、4 分。两项的乘积即为Acsl4 的染色积分,按其评分,0~4分为阴性,5~12 分为阳性。TopoⅡα 以细胞核含有棕黄色颗粒的肿瘤细胞计为阳性细胞,根据染色程度不着色、淡黄色、棕黄色、棕褐色分别为0 分、1 分、2 分、3 分。根据阳性细胞范围阳性细胞≤10%、10%~29%、30%~49%、≥50%分别为0 分、1 分、2 分、3 分。两项的乘积即为TopoⅡα 的染色积分,按其评分0~3 分为阴性,4~9 分为阳性。
1.4 统计学方法
使用SPSS 22.0 软件行数据分析。计数资料用n(%)表示,行χ2检验;正态分布的计量资料用()表示,行独立样本t检验;以P<0.05 为差异有统计学意义。
2 结果
2.1 两组Acsl4、TopoⅡα 的表达比较
观察组的Acsl4、TopoⅡα两者阳性表达率显著高于对照组,差异有统计学意义(P<0.05)。见图1、表1。
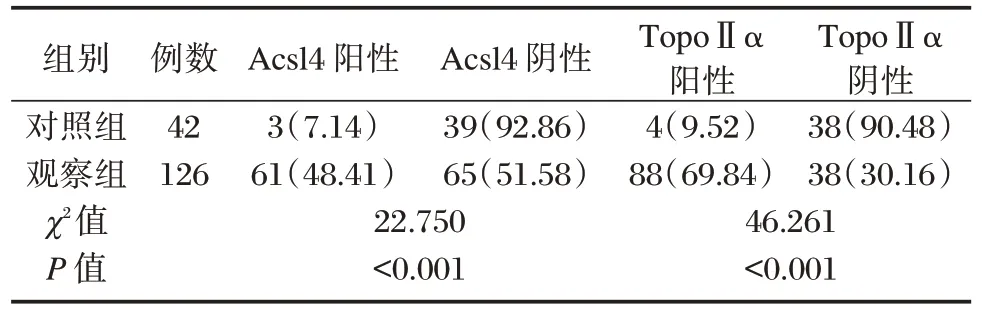
表1 两组Acsl4、TopoⅡα 的表达[n(%)]Table 1 Expression of Acsl4,TopoⅡα in both groups[n(%)]

图1 染色结果(苏木精染色,×200)Figure 1 staining results(Hematoxyli compound staining,×200)
2.2 HER2、PR、ER 中Acsl4、TopoⅡα 的表达
HER2 阳性的Acsl4、TopoⅡα 阳性表达均高于HER2 阴性,而PR、ER 阴性的Acsl4、TopoⅡα 阳性表达均高于PR、ER 阳性,差异有统计学意义(P<0.05)。见表2。

表2 HER2、PR、ER 中Acsl4、TopoⅡα 的表达[n(%)]Table 2 Expression of Acsl4,TopoⅡα in HER2,PR,ER[n(%)]
2.3 Acsl4、TopoⅡα 表达与临床病理的关系
高分化肿瘤的Acsl4、TopoⅡα 阳性表达高于中分化、低分化;TNM 分期为Ⅲ~Ⅳ期的Acsl4、TopoⅡα 阳性表达高于Ⅰ~Ⅱ期;肿瘤直径>5 cm的Acsl4、TopoⅡα 阳性表达高于肿瘤直径<2cm、肿瘤直径2~5 cm;淋巴结转移的Acsl4、TopoⅡα阳性表达高于未转移,差异有统计学意义(P<0.05)。Acsl4、TopoⅡα 表达与年龄、是否绝经无关,差异无统计学意义(P>0.05)。见表3。

表3 Acsl4、TopoⅡα 表达与临床病理的关系[n(%)]Table 3 Relationship between Acsl4,TopoⅡα expression and clinicopathology[n(%)]
3 讨论
相关研究[10]表明,脂肪酸代谢是参与肿瘤的发生、发展的重要过程,而Acsl4 是脂肪酸代谢过程的关键蛋白,可以活化不饱和长链脂肪酸,参与合成膜磷脂并且引发细胞铁死亡,而诱导铁死亡又可有效杀死癌细胞[11],同时,Acsl4 还能促进细胞不受控制地无限生长增殖,导致肿瘤浸润转移[12],因此,可知Acsl4 在细胞死亡方面有双重作用,既能引发细胞铁死亡,又能促进细胞逃离程序性死亡、发展为癌细胞。TopoⅡ又称旋转酶,有两种α、β 同工酶之分[13]。TopoⅡα 能够DNA 的复制和转录进程,具有细胞周期特异性,在细胞周期前期TopoII α 含量快速上升,而在有丝分裂后下降,TopoⅡα 蛋白阳性提示肿瘤细胞处于增殖状态,可反映肿瘤细胞的增殖活性[14]。研究[15]指出,Acsl4 与TopoⅡα 都能够作为肿瘤的生物标志物,提示肿瘤的发生和发展过程。
本研究结果提示Acsl4、TopoⅡα 的异常表达能够在一定程度上反应乳腺癌的病情发展。Acsl4、TopoⅡα 在癌症组织学分级较高的组织中的表达阳性率高于分级较低的,提示Acsl4、TopoⅡα 可能在参与乳腺癌细胞的分化进程中具有重要作用,并且其阳性表达与乳腺癌的恶性程度相关。在淋巴结转移患者体内,Acsl4、Topo 阳性表达率高于未发生淋巴结转移患者,提示作为反映肿瘤细胞增殖活性重要指标的Acsl4、TopoⅡα 与乳腺癌转移情况有关。且相关研究[16]指出,淋巴结转移数目是常规用于评价浸润性乳腺癌预后的重要的因素,淋巴结转移组数越多,乳腺癌分期越晚,其预后越差。同时,相关研究还指出,肿瘤细胞增殖、分裂活动较正常细胞活跃,核分裂相增多,因此肿瘤大小与TNM 分期相关,肿瘤分化程度越差,肿瘤体积越大[17]。研究结果提示TopoⅡα 是调控细胞增殖的重要靶基因,而Acsl4 能够促进细胞无限生长。
HER2 又叫人体表皮生长因子-2,是一种能够激活酶活性,实现跨膜转移的糖蛋白,也是乳腺癌重要的原癌基因之一。癌基因HER2 的表达能够反弹肿瘤的激活状态,在乳腺癌的发生和转移中起重要的作用,其阳性表达的患者预后较差,肿瘤增殖和侵袭活性较强。有研究[18]指出,TopoⅡα 基因与HER2 能够共表达,其位于HER2 基因的下游片段,当HER2 基因过度表达时,可通过多种途径参与跨膜信号的转导,从而实现TopoⅡα 基因的增强表达,因此,HER2 阳性表达患者体内的TopoⅡα 表达水平较高,与本研究结果具有一致性。
近来有研究[19]表明,雌激素受体ER 是参与乳腺癌细胞Acsl4 启动子高活性的转录因子,ER 的表达状态是能够调节Acsl4 表达,同时PR 是ER 活化的产物之一,两者的表达呈正相关[20],ACSL4 的状态能预测乳腺癌细胞的激素受体状态,而下调ACSL4 的表达可以诱导ACSL4 阳性细胞系中ER的表达,与本研究结果中PR 阴性、ER 阴性患者体内ACSL4 阳性表达率高于PR 阳性、ER 阳性患者具有一致性。
综上所述,Acsl4、TopoⅡα 在乳腺癌组织中存在异常表达,两者的阳性表达与乳腺癌患者组织学分级、淋巴结转移、肿瘤直径、及ER 阴性、PR 阴性、HER2 阳性的表达密切相关。由于乳腺癌是一个多基因疾病,故Acsl4、TopoⅡα 在乳腺癌中的作用机制还需进一步阐明。

