β2-肾上腺素能受体对心肌炎大鼠炎症因子的调节机制
孙艳艳 田洪森★ 程浩洋 李亚 宋志远 沈玉珏
心肌炎是心脏病理免疫过程中的临床和组织学表现。心脏中的免疫反应会导致心肌细胞的结构和功能异常,进而导致区域或整体收缩障碍等系统疾病[1]。心肌炎可由多种感染性病原体引起,包括病毒、细菌、衣原体、立克次体、真菌和原生动物的毒性作用和超敏反应[2]。急性心肌炎患者常表现出胸痛、呼吸困难或心脏非特异性症状,慢性心肌炎患者中也可能发生免疫性心脏损伤和心功能障碍。目前,心肌炎的治疗虽然随着科学技术的提高有所改善,但是其发展机理和其对炎症反应的调节机制尚不清楚。心脏中肾上腺素受体主要包括α-肾上腺素受体(Adrenergic Receptors,α-AR)和β-肾上腺素受体(Adrenergic Receptors,β-AR),其中β-AR 所占比例较多且介导着心脏的主要功能[3]。心脏中的β-AR 会引起心率增加,β-AR 也可通过偶联Gs 蛋白激活腺苷酸环化酶(Adenylate cyclase,AC)促进c AMP 生成,进而通过造成钙超载等机制,从而降低心肌细胞的存活、引起心脏毒性[4]。研究表明,自身免疫性心肌炎(autoimmune myocardioptis,EAM)大鼠模型是研究心肌细胞损伤及免疫应答机制的重要模型,因此,本研究旨在探索β2-肾上腺素能受体对心肌炎大鼠炎症因子的影响和调节机制,以期望为心肌炎的发展机制和治疗提供参考。
1 材料和方法
1.1 实验试剂
Freund's adjuvant(CFA,Sigma Aldrich,F5881),猪心肌肌球蛋白(PCM,Sigma Aldrich,M0531),propranolol(PRO,Sigma Aldrich,222984),TRIzol(Thermo Fisher Scientific,15596026),Takara 试剂盒(Takara Biochemicals,DRR096A),抗 NLRP3(SantaCruz Biotechnology,sc-134306),Caspase-1(Abcam,ab74279),IL-18(SantaCruz Biotechnology,sc-517545),GAPDH(SantaCruz Biotechnology,sc - 293335),IgG(Santa CruzBiotechnology,sc -2004),ECL 蛋白质印迹检测试剂(Thermo Fisher Scientific,35050)。
1.2 动物模型建立和分组
本实验通过Freund's adjuvant(CFA)及猪心肌肌球蛋白(porcine cardiac myosin,PCM)感染易致敏 的Lewis 大 鼠,构 建EAM 大 鼠 模 型[5]。从Weitonglihua 实验动物技术公司购买6 周龄的SPF Lewis(SCXK 2012-0001)大鼠;在自然光照条件下饲养大鼠,温度20~30℃,空气流通,期间大鼠可自由进食、进水;然后将大鼠随机分为3 组:对照组、自身免疫性心肌炎组(EAM 组)和β-肾上腺素能受体拮抗剂处理的自身免疫性心肌炎组(EAM+PRO 组)。将纯化的猪心肌肌球蛋白(PCM)以2 g/L 的浓度溶于0.15 mol/L 的PBS 溶液中,将溶液在无菌条件下与1∶1 的Freund's adjuvant(CFA)充分混合并完全乳化,再将EAM 大鼠在第1 天和第8 天按200 μL/只的剂量从大鼠皮下注射至双侧腹股沟和腋窝以造模。对照组大鼠注射不含肌球蛋白的PBS 与CFA 乳浊液,EAM+PRO 组的EAM 大鼠于造模后腹膜内注射100 μL/只/天的propranolol(PRO,普萘洛尔溶于生理盐水中,终浓度为0.6%);21 天后对各组大鼠行超声心动图检测,并断头处死后取样进行后续实验研究。
1.3 RNA 提取和RT-PCR 检测
通过Trizol 法提取大鼠心肌组织细胞中总RNA,然后将纯化的RNA 反转录为cDNA。通过RT-PCR 鉴定β2-AR 的表达量,Takara 实时PCR 试剂盒定量β2-AR 的mRNA 表达。PCR 程序为:95℃下进行10 min 的预热程序,通过Icycler(Bio-Rad)在95℃进行15 秒,在退火温度下延伸1 min并采用40 个循环反应。用于本实验的因为序列如下:β2-AR,F-5′-CAGCAAAGGGACGAGGTG-3′,R-5′-AAGTAATGGCAAAGTAGCG-3′;GAPDH,F-5′-CGTGCGTGACATTAAGGAG-3′,R-5′-GG AAGGAAGGCTGGAAGAG-3′。
1.4 ELISA 法检测蛋白表达水平
将各组大鼠的血浆匀浆后取上清液(10,000 rpm/min 离心3 min),用ELISA 试剂盒对上清液中的白细胞介素-1(Interleukin-1,IL-1)、白细胞介素-6(Interleukin-6,IL-6)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、人巨噬细胞趋化蛋白-1(Human macrophage chemoattractant protein-1,MCP-1)和细胞间黏附分子-1(intercellular cell adhesion molecule-1,ICAM-1)进行检测和分析;所有ELISA 操作均采用试剂盒提供的说明方法,然后使用SAFIRE 平板读数器(450 nm)读板,并计算IL-1β、IL-6、TNF-α、MCP-1 和ICAM-1的含量。
1.5 蛋白质免疫印迹分析
用RIPA 法提取大鼠心肌组织细胞中总蛋白,于4℃10,000 g 离心5 min。BCA 测定法测量蛋白质含量,用8~12%SDS-PAGE 分离蛋白质样品(50 μg),并转移到硝酸纤维素膜上。然后将膜在5%BSA 的TBST 中封闭,并与以下第一抗体在4℃下孵育过夜:NLRP3(1∶1 000)、IL-18((1∶1 000)、Caspase-1(1∶1 000)和GAPDH(1∶2 000);然后将膜用TBST 洗涤,并与HRP 偶联的山羊抗兔IgG(1∶5 000)或HRP 偶联的山羊抗小鼠在37℃孵育1 小时。使用ECL 蛋白质印迹检测试剂观察蛋白质条带,并计算灰度值。
1.6 数据处理与统计分析
使用SPSS 软件21.0 进行数据统计分析,数据均进行正态分布检验,以()表示,行t检验,多组间行单因素方差分析及LSD 事后检验比较组间差异,P<0.05 表示差异具有统计学意义。
2 结果
2.1 心肌炎大鼠建模及超声心动图检测
与对照组相比,EAM 组大鼠的心率、LVIDd 和LVIDs 指标均显著升高(P<0.05),EF 和FS 指标均显著降低(P<0.05)。见表1。
表1 各组大鼠超声心动图检测(±s)Table 1 Echocardiographic detection of rats in each group(±s)

表1 各组大鼠超声心动图检测(±s)Table 1 Echocardiographic detection of rats in each group(±s)
指标心率(次/分钟)EF(%)FS(%)LVIDd(mm)LVIDs(mm)对照组463.20±12.72 88.02±1.11 57.92±2.57 5.20±0.22 2.50±0.16 EAM 组696.40±12.34 61.82±1.21 34.40±1.51 6.56±0.28 4.58±0.19 t 值29.43 35.69 17.64 8.5 18.68 P 值0.000 0.000 0.000 0.000 0.000
2.2 大鼠中β2-AR 的mRNA 表达和炎性浸润情况
与对照组相比,EAM 组大鼠中β2-AR 的mRNA 表达水平显著上调(P<0.05)。HE 染色结果显示,EAM 组的大鼠心肌组织的炎症浸润程度明显高于对照组大鼠。见图1。
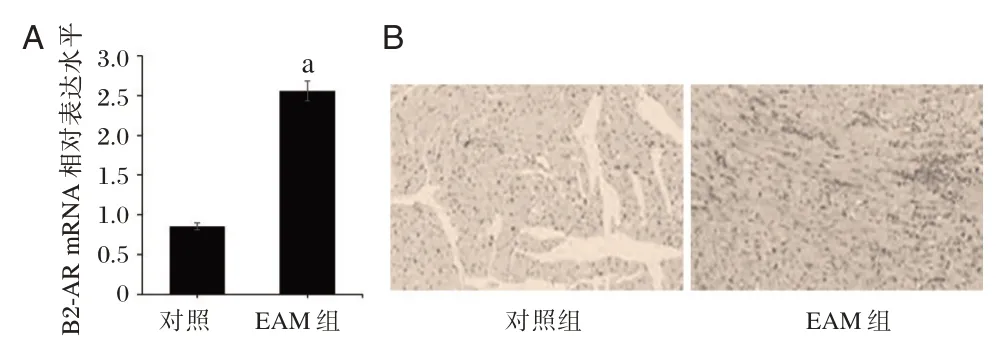
图1 各组大鼠中β2-AR 的mRNA 表达和炎性浸润情况Figure 1 β2-AR mRNA expression and inflammatory infiltration in each group of rats
2.3 大鼠心肌组织中NLRP3、Caspase-1 和IL-18蛋白的表达
与对照组相比,EAM 组大鼠心肌组织中NLRP3、Caspase-1 和IL-18 蛋白的表达水平均发生显著上调(P<0.05)。见图2。
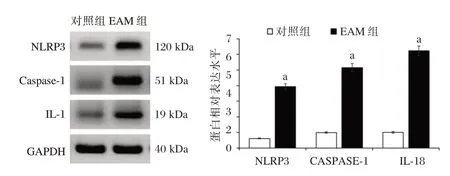
图2 大鼠中炎性小体NLRP3、Caspase-1 和IL-18 蛋白的相对表达水平Figure 2 The relative protein expression levels of NLRP3,Caspase-1 and IL-18 in rat
2.4 大鼠血浆中IL-1β、IL-6、TNF-α、MCP-1 和ICAM-1 含量变化
ELISA 法检测了大鼠中IL-1β、IL-6、TNF-α、MCP-1 和ICAM-1 的含量,结果发现,与对照组相比,EAM组大鼠血浆中的IL-1β、IL-6、TNF-α、MCP-1和ICAM-1 含量均显著升高(P<0.05)。见表2。
表2 各组大鼠血浆中IL-1β、IL-6、TNF-α、MCP-1 和ICAM-1 的含量变化(±s)Figure 2 Changes of IL-1β,IL-6,TNF-α,MCP-1 and ICAM-1 in plasma of rats in each group(±s)

表2 各组大鼠血浆中IL-1β、IL-6、TNF-α、MCP-1 和ICAM-1 的含量变化(±s)Figure 2 Changes of IL-1β,IL-6,TNF-α,MCP-1 and ICAM-1 in plasma of rats in each group(±s)
指标IL-1β(pg/mL)IL-6(pg/mL)TNF-α(pg/mL)MCP-1(pg/mL)ICAM-1(pg/mL)对照组80.20±13.33 82.61±6.43 185.00±7.21 142.43±21.79 100.21±9.04 EAM 组588.80±25.76 442.00±56.30 634.20±29.99 394.47±18.92 525.88±74.38 t 值39.21 14.18 32.57 19.53 12.70 P 值0.000 0.000 0.000 0.000 0.000
2.5 拮抗剂使用后大鼠中β2-AR 的表达和炎症情况
与对照组相比,EAM 组大鼠心肌组织中β2-AR 的mRNA 表达水平显著上调差异有统计学意义(P<0.05);与EAM 组相比,EAM+PRO 组大鼠心肌组织中β2-AR 的mRNA 表达水平显著下调差异有统计学意义(P<0.05)。大鼠心肌组织的炎症浸润HE 染色结果显示,EAM 组的大鼠心肌组织的炎症浸润程度明显高于对照组,EAM+PRO 组大鼠心肌组织的炎症浸润程度显著低于EAM 组。与EAM 组 相 比,EAM+PRO 组 大 鼠NLRP3、Caspase-1 和IL-18 蛋白的表达量均显著下调(P<0.05)。见图3。

图3 拮抗剂使用后各组大鼠的β2-AR 表达和炎症程度变化Figure 3 Changes of β2-AR expression and inflammation degree in rats of each group after antagonist use
3 讨 论
心脏中的肾上腺素受体(α-AR 和β-AR)介导和调节心脏的主要功能,其中β-AR(分为β1-AR和β2-AR)所占比例较多,主要位于心脏、骨骼肌、肝脏的血管平滑肌[6]。目前对于β2-AR 的研究报道较少。因此,本研究旨在探究β2-AR 对心肌炎大鼠炎症因子的影响,以期望为心肌炎的发展机制和治疗提供参考。
炎症在心脏的病理性重构中发挥重要作用,其中炎性小体在介导天然免疫和炎症反应中具有关键的调控作用。目前已发现的炎性小体主要有4种,分别为NLRP1[7]、NLRP3[8]、IPAF 和AIM2[9],其中NLRP3 在机体免疫和炎症反应过程中发挥作用[10]。NLRP3 由凋亡相关斑点蛋白(apoptosis-associated speck-like protein,ASC)和丝氨酸蛋白酶Caspase-1 组成的复合物组成[11]。魏傲等[12]的研究显示,病毒性心肌炎患者外周血中NLRP3 和Caspase-1 的表达水平显著升高,并随着患者心肌炎的严重程度加重而升高。张飞等[13]的研究也显示,病毒性心肌炎小鼠血清中年NLRP3、IL-1β 和IL-18 的表达水平均显著高于健康小鼠。因此,本研究检测了NLRP3 和Caspase-1 在心肌炎大鼠中的表达变化情况,以期探究这些因子在炎症反应中的作用。结果表明,本研究中心肌炎大鼠心肌组织中NLRP3、Caspase-1 和IL-18 蛋白的表达水平均发生显著上调,而β-AR 拮抗剂PRO 会抑制这种上调现象,使其恢复于正常水平的状态。本研究结果与其他文献结果一致,NLRP3 炎性小体作为炎症反应发起及进一步放大的重要环节,NLRP3 的激活会进一步促进炎症反应中下游因子的表达升高;β-AR 拮抗剂PRO 抑制了β-AR 的表达,进而抑制NLRP3 炎性小体的活性,对炎症级联反应的发生产生抑制作用,最终实现对心肌炎大鼠体内炎症的控制。
研究表明,Caspase-1 可以激活IL-1β 和IL-18的表达,而IL-18 作为IL-1 家族中的重要成员能够激活巨噬细胞趋化因子MCP-1 和粘附分子ICAM-1表达的上调[14],趋化因子和粘附分子又是介导机体的炎性细胞向局部组织浸润而产生炎症反应的关键分子。还有研究发现,在给予大鼠β-AR 选择性激动剂后,其心脏出现了炎性细胞浸润和促炎细胞因子的上调表达,如IL-6、TNF-α 和IL-1β 等[15]。本实验的研究结果与前人报道的结果相一致,心肌炎大鼠体内炎症相关因子IL-1β、IL-6 和TNF-α,以及其下游的巨噬细胞趋化因子MCP-1 和粘附分子ICAM-1 的表达水平显著升高,但是使用拮抗剂PRO 后可逆转这些因子表达升高的趋势,使其含量降低至正常大鼠的水平。因此推测,β-AR 对心肌炎大鼠炎症因子具有重要的调控作用,促炎细胞因子可能在β-AR 介导的心脏重塑和心力衰竭中发挥了重要作用,从而影响心肌的损伤程度。
总之,本研究的结果发现,EAM 可能促进大鼠心肌细胞中β2-AR 的表达,进而引起NLRP3 的激活,从而上调Caspase-1 的表达,Caspase-1 又会导致IL-18 的激活并释放到细胞外,引起细胞趋化因子MCP-1 和粘附分子ICAM-1 等的分泌的增加,这可能会促进巨噬细胞募集至心脏病触发心脏炎症及心脏结构和功能改变。

