骨肉瘤中微小 RNA 相关的非编码长链 RNA 研究进展
刘昊阳 徐宁 田记超 邵帅铭 刘维宇 杨卫良
骨肉瘤,一种骨组织恶性肿瘤,其结缔组织能直接诱导产生肿瘤骨或骨样组织,常发生于管状骨,例如股骨下端及胫骨上端,且预后不良;主要发生于青少年,在儿童恶性肿瘤中发生率为 5%[1]。近 40 年来,从手术、治疗和放射治疗方面的最新进展来看,骨肉瘤患者的 5 年存活率,已从不足 20% 上升到 70%[2]。张清等[3]统计的 10 年数据证明,患者一旦出现远处组织转移,平均生存时间一般 < 1 年。所以有必要进一步进行骨肉瘤基因水平的研究。近 30 年来,一些 LncRNA 逐渐被发现在骨肉瘤组织中有不同的表达和影响,LncRNA 是没有编码蛋白质功能的一组长度 > 200 个核苷酸的基因编码产物,其在多种肿瘤病情的发展中发挥重要功能;现发现其在不同物种中的自我保守性不稳定,但某些表达重要功能的 LncRNA 中,含有部分高保守元件,这些高保守元件可维持其功能的稳定表达,降低异变性,这可能是一个治疗骨肉瘤的靶点方向[4]。而近年来发现 LncRNA 与 miRNA 存在海绵效应,即 LncRNA 作为 miRNA 的内源竞争性 RNA ( ceRNA ),可像海绵吸水一样将 miRNA 吸附到 LncRNA 的长链上进行调控作用,进而发挥促进或抑制骨肉瘤发展的功能。现就骨肉瘤中 miRNA 关联的长链非编码 RNA 的研究进展综述如下。
一、促进骨肉瘤增殖发展的 LncRNA
最新的许多研究表明,较多 LncRNA 对骨肉瘤的病情发展有促进作用,将其沉默后可达到缓解病情的目的,而其中大部分都与 miRNA 有关。
1. ADPGK-AS1:Luo 等[5]研究发现 ADPGK-AS1 在骨肉瘤组织与细胞中被大量诱导表达,而 miR-542-3p 在同等环境下表达降低;功能实验表明,抑制 ADPGK-AS1 可以促进细胞凋亡。同时 miR-542-3p 被证实是 ADPGK-AS1 的靶向 miRNA,miR-542-3p 表达上调可以逆转 ADPGK-AS1对骨肉瘤细胞增殖、迁移和侵袭的正向作用。但其中详细分子机制尚待进一步研究。
2. LINC00963:Zhou 等[6]经研究发现 LINC00963 在骨肉瘤细胞中高表达。荧光素酶报告基因实验显示,LINC00963 可以通过靶向结合 miR-204-3p 来抑制其表达;此外,研究初步证明了 FN1 ( 纤维连接蛋白 1,Fibronectin-1 ) 是 LINC00963 / miR-204-3p 轴在骨肉瘤中的靶点,FN1 是纤维连接蛋白家族的一个成员,近年来的研究已证明其与多种癌症的侵袭迁移有关[7-8],但其在骨肉瘤中详细作用机制尚不明朗,综上所述,LINC00963 可通过负向调控 miR-204-3p,并促进 FN1 的表达来增强骨肉瘤细胞的增殖和迁移。
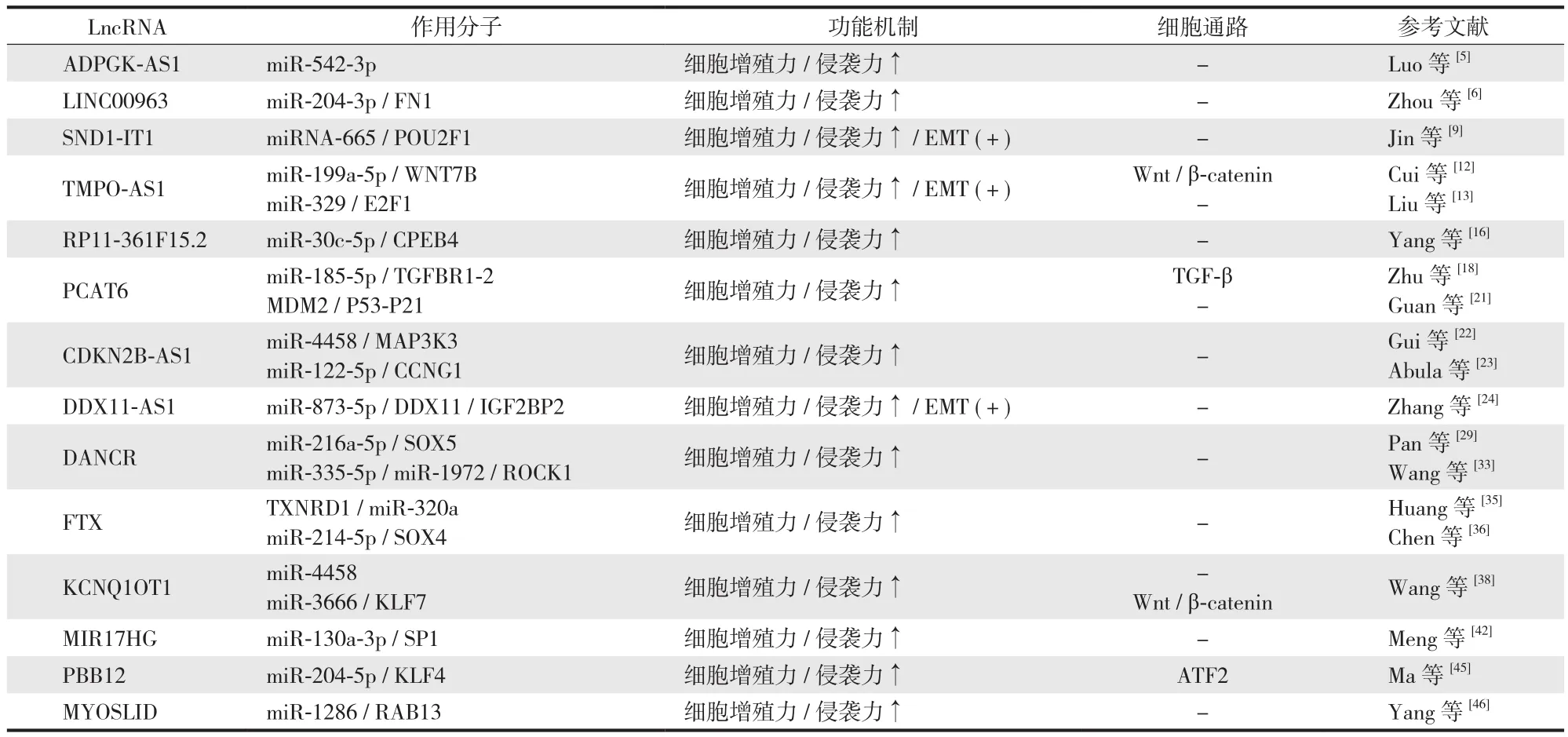
表1 14 种 Lnc RNATab.1 14 kinds of Lnc RNA
3. SND1-IT1:SND1-IT1 在近期研究中被发现在骨肉瘤中过表达[9]。实验发现 miRNA-665 是 SND1-IT1 的靶基因,两者呈负相关,而 POU2F1 ( 第 2 类 POU 结构域转录因子 1 ) 是 miRNA-665 的靶基因,其过表达可导致 DNA异常表达,并且可以促细胞上皮转化 EMT[10-11],实验发现,miRNA-665 可使 POU2F1 表达水平降低,而 SND1-IT1可促进其表达。由此可初步推测,SND1-IT1 可通过抑制miRNA-665 表达从而上调 POU2F1,加强骨肉瘤的增殖和迁移能力,最终促进骨肉瘤的进展。
4. TMPO-AS1:TMPO-AS1 在近期研究中被发现在骨肉瘤组织和细胞中显著过表达[12]。研究表明,TMPO-AS1可以靶向结合于 miR-199a-5p,且 miR-199a-5p 的过表达可抑制骨肉瘤发展。此外,WNT7B ( Wnt 蛋白家族 7B 抗体 ) 是 Wnt / β-catenin 通路的关键成分之一[13],其被证实是 miR-199a-5p 的下游基因,过表达可促进组织上皮化,提高细胞异型性。挽救实验表明,在抑制 miR-199-5p 表达的骨肉瘤组织中再度抑制 WNT7B,细胞增殖程度下降,这证明了 WNT7B 的表达被 miR-199a-5p 反向调控。由此可推测 TMPO-AS1 通过负向作用于 miR-199a-5p,增强了 WNT7B 表达,从而促进骨肉瘤的发展,这为临床治疗提供了全新的治疗方向。Liu 等[14]发现 TMPO-AS1 与miR-329 呈负相关,miR-329 与 E2F1 呈负相关;E2F1 是一个关键的细胞内转录因子,是 E2F 家族中第一个克隆的蛋白,其与 EMT 高度相关,因此 TMPO-AS1 可通过负调控 miR-329 来促进 E2F1 表达,进而促进 EMT 的发展,最终导致骨肉瘤发生发展。
5. RP11-361F15.2:RP11-361F15.2 经最新研究发现在骨肉瘤组织中显著升高[15]。研究发现 miR-30c-5p 可负向作用于 CPEB4 ( 胞质聚腺苷酸结合蛋白 4 ),而 RP11-361F15.2 可通过竞争性地结合 miR-30c-5p 来上调 CPEB4的表达,而 CPEB4 在多种人类肿瘤中均有异常表达[16],且在癌症患者中的异常表达与预后有显著相关性。而在骨肉瘤中,RP11-361F15.2 可通过抑制 miR-30c-5p 使 CPEB4的表达上调,从而促使骨肉瘤细胞迁移侵袭,另外 RP11-361F15.2 还可以诱导 TAMs 极化,研究已证实肿瘤相关巨噬细胞 ( TAMs ) 的极化被认为在肿瘤迁移和侵袭中起关键作用[17];但关于 RP11-361F15.2 相关的 TAMs 极化方面的详细分子机制尚不明确,应进一步深入研究。
6. PCAT6:Zhu 等[18]研究发现骨肉瘤组织中 PCAT6表达升高,并且 PCAT6 的表达上调与骨肉瘤细胞的转移状态和晚期预后呈正相关。此外 PCAT6 可作为 ceRNA负向调控 miR-185-5p,从而增强 miR-185-5p 的靶向标志物 TGFBR1 和 TGFBR2 的表达,进而激活 TGF-β 通路,而 TGF-β[19-20]在较多肿瘤中都被证明可促进癌细胞增殖侵袭。总之,PCAT6 通过抑制 miR-185-5p 促进 TGF-β 通路表达,从而促进骨肉瘤的发展。有学者发现将 PCAT6过表达后,MDM2E3 ( 泛素蛋白连接酶 ) 表达增加,P53和 P21 水平降低,骨肉瘤的细胞学功能得到促进,下调MDM2 后,骨肉瘤细胞的增殖、迁移和侵袭能力受到抑制[21]。此外,当 MDM2 下调后,P53 和 P21 的表达得到了部分恢复。这些结果表明,PCAT6 通过促进 MDM2 的表达,抑制 P53 和 P21 的表达,从而促进骨肉瘤细胞的增殖、迁移和侵袭。
7. CDKN2B-AS1:CDKN2B-AS1 经近期研究表明在骨肉瘤组织中过表达[22],研究发现 CDKN2B-AS1 可靶向作用于 miR-4458,而 MAP3K3 经分子机制实验被证实是骨肉瘤中 miR-4458 的下游靶点,并被 miR-4458 负调控;在 CDKN2B-AS1 抑制后的骨肉瘤组织中,MAP3K3 的强制过表达可以部分挽救被抑制的细胞增殖状态。因此,CDKN2B-AS1 通过负调控 miR-4458 增强 MAP3K3 的表达,从而促进了骨肉瘤的进展,但关于 MAP3K3 的详细功能,应进一步研究。Abula 等[23]发现 CDKN2B-AS1 可抑制 microRNA-122-5p ( miR-122-5p ),使细胞周期蛋白 G1( CCNG1 ) 表达升高,进而促进骨肉瘤细胞的增殖。
8. DDX11-AS1:DDX11-AS1 在 Zhang 等[24]的研究下发现其在骨肉瘤细胞中显著过表达。功能缺失实验发现 DDX11-AS1 表达水平降低后,骨肉瘤细胞增殖、转移及上皮 - 间质转化 ( EMT ) 过程遭受抑制;实验证明DDX11-AS1 可以通过抑制 miR-873-5p 来上调骨肉瘤组织中 DDX11 的表达,而 DDX11 已证明与多种肿瘤组织的病情进展有关[25-26],同时功能试验证明了 miR-873-5p 表达上调可以在骨肉瘤中的细胞增殖、转移和 EMT 过程发挥抑制性作用。此外,DDX11-AS1 在骨肉瘤中通过与 IGF2BP2( 人胰岛素样生长因子 2 mRNA 结合蛋白 2 ) 结合来提高 DDX11 稳定性,而 IGF2BP2 已被证明参与维持多种LncRNA 的稳定,可间接促进肿瘤细胞的生长[27-28]。综上所述,DDX11-AS1 通过抑制 miR-873-5p 上调骨肉瘤组织中 DDX11,并可通过与 IGF2BP2 结合稳定并促使 DDX11发挥功能,从而促进骨肉瘤进展。
9. DANCR:Pan 等[29]研究发现 DANCR 在骨肉瘤组织和细胞系中过表达。功能实验表明 DANCR 的表达下调可诱导细胞凋亡。DANCR 是 miR-216a-5p 的 ceRNA,而SOX5 是 miR-216a-5p 的直接靶点,过表达的 miR-216a-5p通过下调 SOX5 的表达起到抑制细胞增殖的作用。SOX 基因家族是一类 Y 染色体性别决定区 ( SRY ) 相关基因构成的基因家族,SOX5是其家族中一员,与多种肿瘤发展呈正相关[30-32]。总之 DANCR 可通过抑制 miR-216a-5p 上调SOX5 的表达,从而促进骨肉瘤组织增殖侵袭。Wang 等[33]发现下调 DANCR 可抑制 ROCK1 介导的骨肉瘤细胞增殖和转移,并通过负作用于 miR-335-5p 和 miR-1972,促进ROCK1 介导的侵袭转移;ROCK1 ( Rho 相关卷曲螺旋形成蛋白激酶 ) 高表达可提升肌球蛋白轻链磷酸化水平,增加肌动蛋白和肌球蛋白的收缩力,提升细胞的侵袭能力[34]。
10. FTX:Huang 等[35]发现 FTX 通过调控 TXNRD1 /miR-320a 轴发挥其对骨肉瘤的调控作用,Huang 等经QRT-PCR 实验发现,骨肉瘤中 FTX 和 TXNRD1 表达水平异常上调,而 miR-320a 表达明显下降;荧光素酶报告基因分析显示,FTX 和 TXNRD1 均可与 miR-320a 结合,并可同时抑制其表达,但内在详细的分子机制尚不明确,待进一步深入研究发现。Chen 等[36]发现 FTX 在骨肉瘤组织和细胞系中的表达水平升高,与 miR-214-5p 的表达水平呈负相关。沉默 FTX 后骨肉瘤的生长和转移受到抑制,此过程中 miR-214-5p 表达上升。此外,FTX 还可以通过作用调控 miR-214-5p 进而调节 SOX4 的表达;SOX4 是SRY-BOX 转录因子家族中的一员,已发现其在多种癌症中过表达[37]。综上,FTX 可负调控 miR-214-5p,进而上调SOX4 表达,从而导致骨肉瘤发生发展。
11. KCNQ1OT1:Wang 等[38]经实验发现 KCNQ1OT1在骨肉瘤中的表达上调,分子机制实验表明,KCNQ1OT1可作为 miR-4458 的 ceRNA 抑制 miR-4458 的功能,并增强了 KCNQ1OT1 靶基因 CCND2 ( cyclinD-2 ) 的表达,而 CCND2 与多种肿瘤细胞增殖有关[39-40]。总而言之,KCNQ1OT1 抑制其 ceRNA-miR-4458 的表达,从而使得自我表达增强,同时上调其靶基因 CCND2 的表达,最终使骨肉瘤细胞及组织增殖侵袭能力增强。Huang 等[41]发现下调 KCNQ1OT1 可抑制骨肉瘤中的 Wnt / β-catenin 信号通路。KCNQ1OT1 可以负调控 miR-3666,Kruppel 样因子 7( KLF7 ) 是 miR-3666 的靶基因,当 miR-3666 被下调后,KLF7 表达上升,Huang 等发现,KLF7 过表达后,已抑制的 KCNQ1OT1-Wnt / β-catenin 信号传导得到恢复。总的来说,KCNQ1OT1 通过靶向作用 miR-3666 / KLF7 轴促进骨肉瘤进展并激活 Wnt / β-catenin 信号传导。
12. MIR17HG:MIR17HG 经最新研究发现其在骨肉瘤中过表达,并能提升细胞的顺铂耐药性[42]。分子机制实验发现 MIR17HG 可靶向作用于 miR-130a-3p 和转录因子SP1,并且可以抑制 miR-130a-3p 表达,促进 SP1 表达;SP1 已被证明与多种癌症病情发展相关[43-44]。此外,SP1还可以与 MIR17HG 启动子区再次结合,进一步促进其表达,形成反馈环。这种自有反馈环的分子系统是一个全新的发现,是很有价值的研究方向,有必要继续深入研究。
13. PBB12:PBB12 经近期研究发现在骨肉瘤中表达增加[45]。分子机制研究发现,PBB12 可与 hsa-miR-204-5p竞争性结合,同时 PBB12 可干预 kruppel 样因子 4 ( KLF4 )来激活转录因子 2 ( ATF2 ) 通路,进而增强骨肉瘤细胞的增殖和侵袭。PBB12 高表达可导致抑癌基因 KLF4 和hsa-miR-204-5p 功能丧失。此外,功能实验数据显示,PBB12 沉默后,KLF4 对肿瘤细胞增殖和侵袭的抑制作用被显著增强。总之,PBB12 通过抑制 hsa-miR-204-5p 表达,促进自我表达上升并激活 ATF2 通路,抑制 KLF4 的表达,从而促进骨肉瘤发展。
14. MYOSLID:MYOSLID 在最新研究中发现在骨肉瘤组织中高度表达[46],MYOSLID 被敲除后可抑制骨肉瘤细胞的增殖、迁移和侵袭;通过荧光素酶报告基因实验和 RNA 下拉实验,证实了 MYOSLID 与 miR-1286 可直接相互作用,由此推测 miR-1286 是 MYOSLID 的靶标基因。MYOSLID 被抑制后,可促进 miR-1286 在骨肉瘤细胞中的表达,这说明 MYOSLID 的表达与 miR-1286 的表达呈负相关。另外用生物信息学方法以及荧光素酶报告基因实验,证实了 miR-1286 的靶向基因是 RAB13。而 RAB13 是多种癌症的典型致癌基因。因此可认为,MYOSLID 可通过抑制miR-1286 的表达上调 RAB13,从而加快骨肉瘤的进程。
综上所述,LncRNA 作为 miRNA 的 ceRNA ( 内源竞争性 RNA ),可充分发挥其海绵功能,可吸附相关 miRNA进行单向正表达水平的调控,进而通过相关信号通路或因子促进骨肉瘤的发展变化,现已确定 LncRNA 单向调控miRNA,但 miRNA 是否能反作用于 LncRNA,是否可以通过相关通路或细胞因子进行负反馈作用,现在尚不得知,若 miRNA 可靶向负反馈调节 LncRNA,对于临床治疗将有很大意义,这些问题仍须继续深入研究。
二、抑制骨肉瘤增殖发展的 LncRNA
在骨肉瘤中,除了大多数起到促进作用的 LncRNA,另有一些 LncRNA 的表达可抑制骨肉瘤的发展,起到负向作用,现将与 miRNA 相关的该类基因的作用机制列举如下:
1. LINC-PINT:该基因近期研究被发现在多种癌性组织中均有抑制性表达;Liu[47]经研究发现 LINC-PINT 在骨肉瘤组织中表达减低,而在其表达增强的组织中发现miRNA-21 表达下降,由此可见 LINC-PINT 过表达可抑制miRNA-21 表达,实验已证明 miRNA-21 过表达会提高细胞的增殖侵袭性,但 miRNA-21 过表达却对 LINC-PINT 表达无明显影响,这说明 LINC-PINT 对其发挥单向作用的功能。总之,LINC-PINT 可能通过下调 miRNA-21 抑制骨肉瘤发展,而详细的分子机制应进一步深入研究。
2. MEG3:近年研究证明 MEG3 在骨肉瘤组织中异常表达[48],有明显的抑癌功能,而既往研究表明 MEG3可与 p53 结合,发挥协同正向作用抑制肿瘤发展[49]。而最新研究发现 MEG3 和 miR-361-5p 在骨肉瘤组织和细胞系中同比显著下调,实验发现 MEG3 可直接靶向结合miR-361-5p,显著上调其表达,上调的 MEG3 和 miR-361-5p明显抑制骨肉瘤细胞生长转移,但其中具体的分子机制尚不明朗,尚需进一步查明[50]。
3. SERTAD:SERTAD 基因,被认为是关键的核转录参与者,在细胞增殖及异变性上发挥着重要的调控作用。近期研究发现其与骨肉瘤的发展有关[51];实验中发现SERTAD2-3 在骨肉瘤细胞中过表达,并可通过诱导细胞G1 期周期阻滞和细胞凋亡来抑制细胞生长;而 miR-29c经研究发现其是 SERTAD2-3 的 ceRNA,且两者的表达呈负相关。实验发现 miR-29c 在骨肉瘤组织中表达上调,并可靶向抑制于抑癌基因 PTEN,提高骨肉瘤细胞的增殖侵袭性,因此初步推测,SERTAD 通过抑制 miR-29c 的表达,促进 PTEN 表达,进而抑制骨肉瘤的发展。
综上所述,LncRNA 作为 miRNA 的 ceRNA,可充分发挥其海绵功能,可吸附相关 miRNA 进行单向负表达水平的调控,从而抑制骨肉瘤的发生发展,但有两个问题:( 1 ) 抑制性 miRNA 相关 LncRNA 较促进性 LncRNA数量要少,这是否和 miRNA 的某些作用有关;( 2 ) 抑制性 miRNA 相关的信号通路和因子未得到深入研究,这是否说明在抑制骨肉瘤的过程中,某些信号通路和细胞因子的功能发挥的较为隐匿或者是消极作用,这些都须进一步研究。
三、LncRNA 及 miRNA 共同作用下的骨肉瘤预后情况
骨肉瘤作为一种预后极差的骨科疾病相关肿瘤,远期的生存率尤为重要,现对于骨肉瘤基因层面的研究仍不完善,探索到抑制骨肉瘤相关 LncRNA 较少,而抑制性 LncRNA 的意义对于骨肉瘤的治疗有着极其重要的作用,但对于强化抑制性 LncRNA 表达后会不会减弱增强性LncRNA 的作用,还须进一步研究证明。而 miRNA 大多数可作为内源性竞争性 RNA 调控 LncRNA 的表达进程,这也是能够改善预后的治疗方向。总之现今骨肉瘤的预后年限虽然上升,但总体不容乐观,仍须继续研究延长患者预后时间。
四、展望
目前,对于参与骨肉瘤病情发展的 LncRNA 的研究日渐广泛及深入,少部分被发现存在抑制性表达,如 SERTAD、LINC-PINT 和 MEG3 等可起到抑癌作用,而大多数 LncRNA 都倾向过表达,如 ADPGK-AS1、LINC00963、CDKN2B-AS1 和 MIR17HG 等都增强了骨肉瘤细胞的增殖、侵袭和迁移性,现是否可将某些高度表达的 LncRNA 作为生物标志物来预测骨肉瘤患者的预后,认为是一个较新的研究领域,这可为治疗方案的制订提供更好的方向,应充分进行发掘研究。此外,还有很多与骨肉瘤相关的 LncRNA 未被发现,即使发现了的 LncRNA 依然尚有很多分子机制不明确,尤其是关于作为内源性竞争性RNA 的 miRNA 的具体调控机制,还须继续研究,所以还需要继续不断的发展分子生物学技术,以求未来对骨肉瘤的治疗提供更多的指导方向,但可以明确的是,LncRNA及 miRNA 在骨肉瘤方面的角色十分重要。

