NAC/RvD1抑制H2O2诱导的COPD患者气道上皮细胞炎症性黏液高分泌的作用及机制研究
吴 旭, 季 爽 , 郭 燕 , 费广鹤,2
慢性阻塞性肺疾病(chronic obstructive pulmonary disease, COPD)是一种慢性气道炎症性疾病,目前研究表明炎症、氧化应激系统失衡都是COPD发生的可能机制。原代气道上皮细胞(primary airway epithelial cells,DHBE)是COPD患者细胞和组织学改变的主要部位,各种入侵呼吸道的应激源构成复杂的胞外信号,可以通过对IκB激酶(inhibitor of nuclear factor kappa-B kinase,IKK)的直接激活作用,使核因子κB的抑制蛋白(inhibitor of NF-κB,IκB)泛素化,进而核因子κB(nuclear factor kappa-B,NF-κB)活化,导致DHBE释放大量炎症细胞因子,同时促进气道黏液高分泌,而抑制NF-κB的活化可能会缓解各种氧化应激造成的损伤。N-乙酰半胱氨酸(N-acetyl-L-cysteine, NAC)可使COPD患者的痰黏液症状缓解、肺功能改善。消退素D1(resolvin-D1, RvD1)是具有强效抗炎作用的分子,它可以抑制NF-κB的活性,强效抗炎的同时,不损害机体的防御反应。该文旨在探讨HO作为氧化应激源对COPD患者的炎症性黏液高分泌的影响以及NAC和RvD1的保护作用,为COPD患者的临床防治提供新思路。
1 材料与方法
1.1 主要材料
人气管组织标本来源于安徽医科大学第一附属医院胸外科行肺叶切除的COPD合并肺癌(原位癌)患者,组织取样的样本距离肿瘤边缘>3 cm,且病理学检测肿瘤细胞学均为阴性。分离提取COPD患者的DHBE。BEGM培养基(美国Lonza公司);胎牛血清 (fetal bovine serum, FBS) (美国赛默飞公司);兔源性抗体IKKβ和MUC5AC(美国Abcam公司);兔源性抗体p-IKKβ、NF-κB、p-NF-κB、β-actin(美国CST公司);HRP-IgG 山羊抗兔的二抗(美国Santa Cruz公司);30% HO(合肥英博生物科技有限公司);NAC(美国Sigma公司);RvD1(美国Cayman Chemical公司);NF-κB抑制剂(ammonium pyrrolidinedithio-carbamat, PDTC)、MTT、活性氧检测试剂盒(上海碧云天生物技术有限公司);qRT-PCR试剂盒(日本Takara公司);TNF-α、IL-8的ELISA试剂盒(上海爱必信生物科技有限公司)。1.2 方法
1
.2
.1
细胞培养与传代 将DHBE细胞接种于培养皿中,添加BEGM培养基,并置于37 ℃、5% CO细胞培养箱中培养,每2~3 d换液1次。待细胞生长至培养皿的80%~90%时,弃去上层培养基,PBS清洗后,取2 ml的胰酶放入培养皿中消化,收集细胞后离心机离心,再加入BEGM培养基制成细胞悬液,按1 ∶2比例传代,取对数生长期的细胞进行实验。1
.2
.2
MTT实验 将DHBE细胞以5 000个/孔的密度接种到96孔板中,将细胞与不同浓度梯度(0~500 μmol/L)的HO共孵育24 h。弃去上层培养基,添加MTT (5 mg/ml) 孵育4 h,弃去培养孔内混合液体,向每个孔中加入100 μl的DMSO,然后在室温下振荡10 min,采用酶标仪测量490 nm处的吸光度,记录实验结果,进行统计分析。1
.2
.3
ROS水平的检测 将DHBE细胞均匀接种于6孔板中,根据各孔中添加HO(300 μmol/L)和(或)NAC(10 mmol/L)不同,分为对照组、HO组、NAC+HO组和NAC组,随后向各组细胞中添加活性氧检测的 DCFH-DA (10 μmol/L) 探针,置于细胞培养箱中孵育30 min,收集各组细胞,采用免疫荧光或流式细胞仪检测各组细胞中ROS的表达水平。1
.2
.4
Western blot实验 将DHBE细胞均匀接种于培养板中,根据各孔中添的 HO(300 μmol/L)和(或)NAC(10 mmol/L)不同,分为对照组、HO组、NAC+HO组和NAC组。根据添加的治疗药物消退素RvD1(100 nmol/L)和阳性对照PDTC(10 μmol/L)不同,分为对照组、HO组、RvD1+HO组、RvD1组、PDTC+HO组和PDTC组。PBS洗涤后,收集细胞提取总蛋白,将总蛋白经10%的SDS-PAGE凝胶电泳分离并转移到PVDF膜上。5%脱脂牛奶室温封闭2 h,TBST洗膜后,在4 ℃孵育一抗IKKβ(1 ∶1 000)、p-IKKβ(1 ∶1 000)、NF-κB(1 ∶1 000)、p-NF-κB(1 ∶1 000)、β-actin(1 ∶1 000)过夜。次日,一抗复温后,采用TBST洗膜,室温下孵育羊抗兔二抗(1 ∶5 000)2 h,再次TBST洗膜后,ECL显色曝光,记录并分析实验结果。1
.2
.5
实时荧光定量PCR 细胞分组及处理同1.2.4,以提取的RNA样品为模板反转录成cDNA后,采用SYBR Green法对cDNA样品进行实时荧光定量PCR。反应条件为:95 ℃预变性1 min后进入循环;95 ℃、5 s;60 ℃、30 s,扩增40个循环;采用2法分析相对表达量。见表1。
表1 基因引物列表
1
.2
.6
细胞免疫荧光染色 将细胞爬片培养,细胞生长至60%左右,细胞分组及处理同1.2.4,室温下用免疫荧光固定液固定15 min,PBS洗3次。免疫染色封闭液封闭60 min,在4 ℃孵育一抗MUC5AC(1 ∶200)过夜,PBS清洗细胞3次,室温下孵育羊抗兔二抗(1 ∶200)作用细胞90 min,DAPI细胞核染色4 min,荧光显微镜下拍照。1
.2
.7
酶联免疫吸附实验(ELISA) 收集上述HO、NAC、RvD1和PDTC处理后的细胞上清液,离心后采用双抗体夹心酶联免疫吸附法检测上清液中的TNF-α、IL-8含量水平。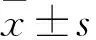
2 结果
2.1 H
O
合适的作用浓度及其对IKKβ/NF-κB炎症信号通路的影响
不同浓度梯度(0~500 μmol/L)的HO处理DHBE细胞24 h后,采用MTT实验进行细胞活力检测。结果表明HO的浓度在0~400 μmol/L范围内对细胞活力无毒性作用,而500 μmol/L组较对照组细胞活力下降27.05%,差异有统计学意义(P
<0.001)。见图1。采用Western blot检测炎症信号通路IKKβ/NF-κB相关蛋白表达,结果提示不同浓度HO刺激后, 从200 μmol/L开始,与对照组相比,IKKβ和NF-κB磷酸化水平升高(F
=37.23,P
<0.05;F
=22.47,P
<0.05),且呈剂量依赖关系。见图2。从相对灰度值的结果可以观察到自300 μmol/L开始实验组和对照组的差异最为明显,因此,选择300 μmol/L的HO进行后续实验。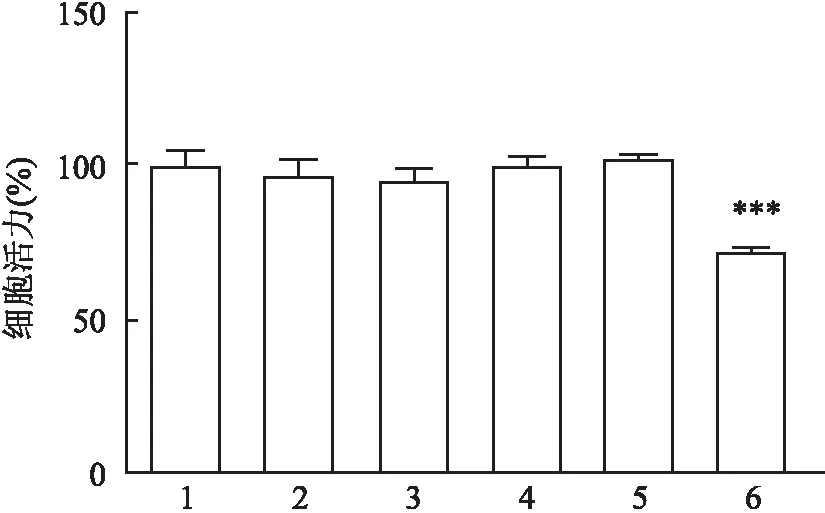
图1 MTT法检测0~500 μmol/L H2O2处理DHBE细胞后细胞活力变化
图2 Western blot法检测0~500 μmol/L H2O2处理DHBE细胞后p-IKKβ/IKKβ、p-NF-κB/NF-κB 蛋白相对表达变化
2.2 NAC降低DHBE细胞中H
O
刺激后产生的ROS含量
免疫荧光探针检测ROS含量的变化。免疫荧光检测结果表明:HO组细胞中ROS表达水平高于对照组,而NAC作用后则降低,ROS表达差异均有统计学意义(F
=10.63,P
<0.05)。见图3。采用流式细胞技术检测4组间ROS的表达水平,实验趋势与免疫荧光结果一致(F
=8.199,P
<0.05)。见表2、图4。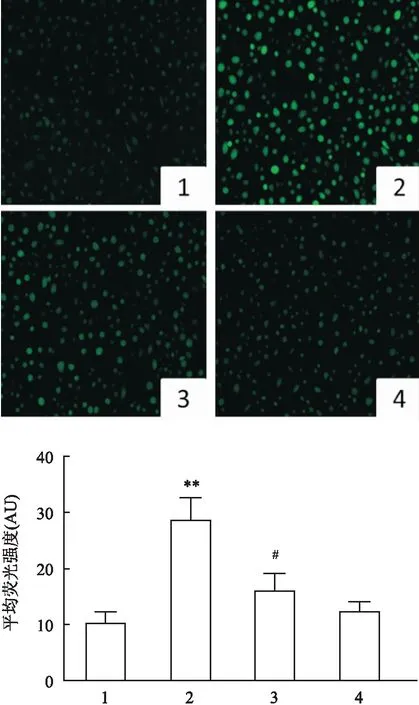
图3 免疫荧光法检测H2O2和(或)NAC作用后的DHBE细胞中的ROS含量 ×100
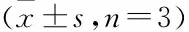
表2 各组细胞内ROS荧光强度的表达
图4 流式细胞技术检测H2O2和(或)NAC作用后的DHBE细胞中的ROS含量
2.3 NAC抑制DHBE细胞中H
O
激活的IKKβ/
NF-κB炎症信号通路表达水平
Western blot实验检测IKKβ和NF-κB的磷酸化蛋白表达水平。结果表明:与对照组相比,HO组的DHBE细胞中p-IKKβ和p-NF-κB的蛋白表达水平升高;与HO组相比,NAC+HO组DHBE细胞中的p-IKKβ和p-NF-κB的蛋白表达水平降低,IKKβ和NF-κB的磷酸化差异均有统计学意义(F
=24.74,P
<0.001;F
=14.69,P
<0.01)。见表3、图5。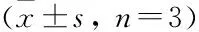
表3 各组细胞内p-IKKβ/IKKβ、p-NF-κB/NF-κB的蛋白相对表达
图5 Western blot 法检测H2O2刺激DHBE细胞后p-IKKβ/IKKβ、p-NF-κB/NF-κB 蛋白相对表达变化
2.4 NAC减少DHBE细胞中H
O
诱发的炎症因子和黏蛋白MUC5AC表达
采用qRT-PCR检测炎症细胞因子TNF-α、IL-8及MUC5AC的mRNA表达水平。与对照组相比,HO组DHBE细胞中的TNF-α、IL-8、MUC5AC的表达水平升高,而NAC处理后则降低。TNF-α、IL-8和MUC5AC蛋白相对表达差异均有统计学意义(F
=33.14,P
<0.001;F
=31.83,P
<0.01;F
=31.83,P
<0.01)。见表4,图6A~C。收集上述4组细胞培养的上清液,采用ELISA法检测炎症细胞因子TNF-α和IL-8的含量,结果与mRNA的表达趋势一致(F
=46.69,P
<0.001;F
=83.06,P
<0.001)。见图6D、E。与此同时,采用免疫荧光技术检测MUC5AC的表达水平,也提示NAC处理后可以降低MUC5AC的表达(F
=29.16,P
<0.001)。见图7。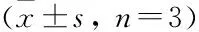
表4 qRT-PCR检测的各组细胞内TNF-α、IL-8、MUC5AC蛋白相对表达
2.5 RvD1抑制DHBE细胞中H
O
激活的NF-κB炎症信号通路表达水平
PDTC为NF-κB一种明确的抑制剂,作为该实验的阳性对照,Western blot实验检测NF-κB的磷酸化蛋白表达水平。结果表明:与对照组相比,HO组p-NF-κB蛋白表达水平升高;与HO组相比,RvD1+HO组p-NF-κB蛋白表达水平降低,NF-κB的磷酸化差异均有统计学意义(F
=41.14,P
<0.001)。见表5、图8。
表5 各组细胞内p-NF-κB/NF-κB的蛋白相对表达
2.6 RvD1降低DHBE细胞中H
O
诱发的炎症因子和黏蛋白MUC5AC的表达
采用qRT-PCR检测炎症细胞因子TNF-α、IL-8及MUC5AC的mRNA表达水平。与对照组相比,HO组DHBE细胞中的TNF-α、IL-8、MUC5AC的表达水平升高,而RvD1处理后则降低。TNF-α、IL-8和MUC5AC的mRNA相对表达差异均有统计学意义(F
=81.67,P
<0.001;F
=37.31,P
<0.001;F
=22.59,P
<0.001)。见表6、图9A~C。收集上述4组细胞培养的上清液,采用ELISA法检测炎症因子TNF-α和IL-8的含量,结果与mRNA的表达趋势一致(F
=32.25,P
<0.001;F
=72.89,P
<0.001)。见图9D、E。与此同时,采用免疫荧光技术检测MUC5AC的表达水平,也提示NAC处理后可以降低MUC5AC的表达(F
=17.76,P
<0.001)。见图10。
图6 qRT-PCR法和ELISA法检测H2O2刺激DHBE细胞后TNF-α、IL-8及MUC5AC的表达
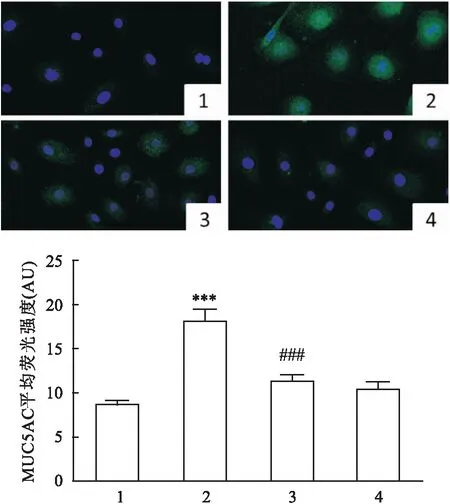
图7 免疫荧光法检测H2O2和(或)NAC作用后的DHBE细胞中的MUC5AC ×400
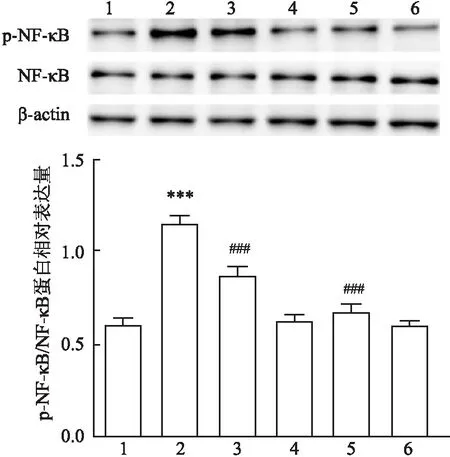
图8 Western blot 法检测H2O2刺激DHBE细胞后p-NF-κB/NF-κB 蛋白相对表达变化
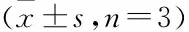
表6 qRT-PCR检测的各组细胞内TNF-α、IL-8、MUC5AC蛋白相对表达
图9 qRT-PCR法和ELISA法检测H2O2刺激DHBE细胞后TNF-α、IL-8及MUC5AC的表达
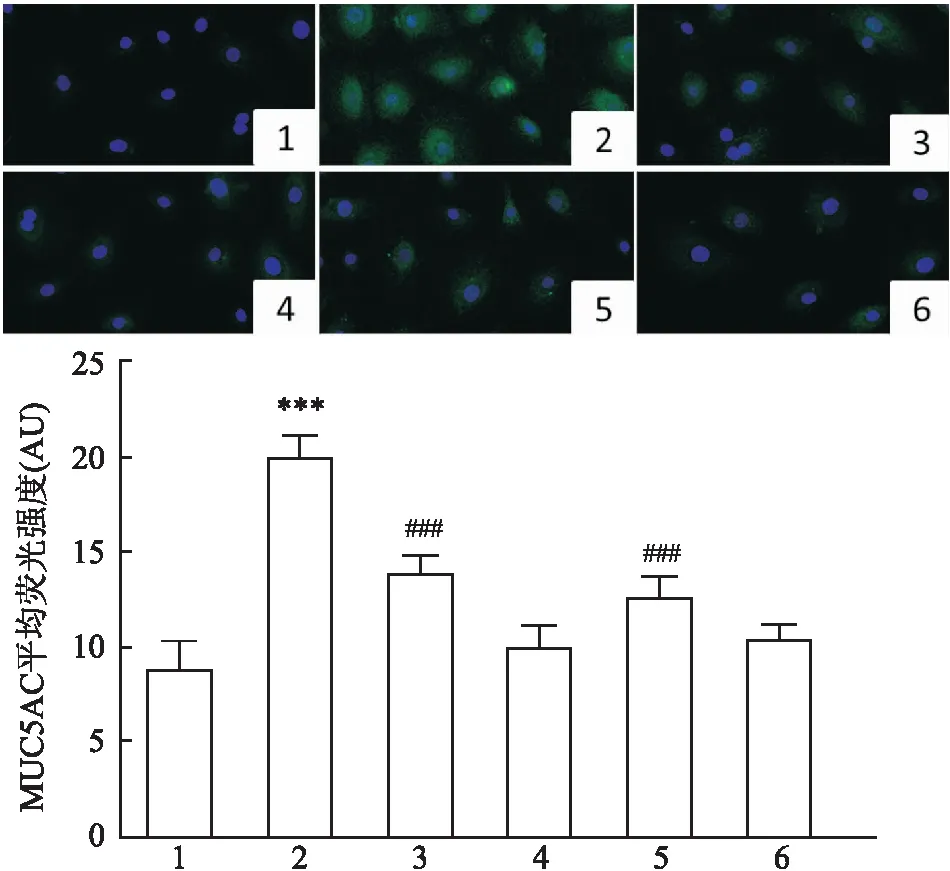
图10 免疫荧光法检测H2O2和(或)RvD1作用后的DHBE细胞中MUC5AC ×400
3 讨论
国内大规模流行病学调查结果显示,40岁以上成人慢阻肺的患病率为13.7%,严重影响患者的生活质量,而氧化应激是COPD患者疾病进展的重要诱发因素,氧化应激启动和加重了炎症反应,同时参与气道黏液高分泌。
该研究中主要采用HO刺激DHBE细胞制备体外氧化应激模型,HO刺激后,细胞内ROS水平升高,p-IKKβ和p-NF-κB表达增加;同时炎症细胞因子TNF-α、IL-8和MUC5AC的表达升高,而NAC处理细胞后能降低上述表达。以上研究结果表明氧化应激可增强DHBE细胞的炎症反应和黏液高分泌,而NAC抑制了细胞内的氧化应激水平并且通过IKKβ/NF-κB信号通路减少炎症性黏液高分泌。既往研究也支持氧化应激可以通过NF-κB的胞内信号通路调节炎症物质释放和黏蛋白的表达。
IKKβ/NF-κB是一种广泛存在的炎症信号通路,调控细胞的炎症、免疫、增殖和凋亡等多种基因的表达,因此,抑制IKKβ/NF-κB信号通路在一定程度上可以起到治疗COPD患者的作用。同时,IKKβ/NF-κB信号通路也是连接炎症因子和胰岛素抵抗的最主要信号通路,NF-κB介导炎症反应的放大和持续,抑制胰岛素信号通路,导致胰岛素抵抗和2型糖尿病的发生,对COPD患者的合并症也有很大影响。
进一步研究表明,消退素RvD1抑制了p-NF-κB的表达,减少了炎症细胞因子TNF-α和IL-8的表达及MUC5AC的分泌。既往研究也表明,RvD1在炎症性疾病中发挥重要的调控作用,对香烟烟雾提取物诱导的人小支气管上皮细胞、IL-6、IL-8等多种炎症因子的表达有抑制作用。但是,RvD1在抑制黏蛋白表达的作用上尚不是十分明确。研究表明,RvD1治疗慢性过敏性眼病模型中的杯状细胞黏蛋白分泌。该实验结果表明RvD1可通过NF-κB信号通路抑制HO介导的DHBE炎症反应及黏液高分泌。

