sigma-1受体对口腔鳞癌细胞增殖、迁移和侵袭影响的实验研究
张红丽,徐小立,戴永铮,应松成,蒋 勇,4
口腔鳞状细胞癌(oral squamous cell carcinoma, OSCC)患者占所有口腔恶性肿瘤的90%以上,且容易复发和转移。早期患者的5年生存率约为55%~60%,晚期患者的5年生存率仅为30%~40%。探索并识别新的诊断和治疗分子,从而实现OSCC的早发现和早治疗,改善预后,仍然是当前OSCC研究的主要任务。研究表明sigma-1受体是一种具有伴侣活性的非阿片类独立受体,包括sigma-1受体和sigma-2受体2种亚型。sigma-1受体(简称Sig1R,又称σ1受体)分子量约26 ku,含223个氨基酸,其基因定位和蛋白结构较sigma-2受体更清晰,具有更广泛的特征。研究表明sigma-1受体在结直肠癌、前列腺癌、宫颈癌和乳腺癌等中呈高表达,并参与癌细胞的发生发展。研究表明,sigma-1受体的表达与乳腺癌患者的总生存率降低相关,且sigma-1受体在细胞水平上增强细胞增殖和迁移。在乳腺癌中的研究表明,sigma-1受体的表达增加了电压门控钠离子通道亚型Nav1.5的电流密度,提示sigma-1受体可能通过增加Nav1.5活性进而增强细胞侵袭。该研究拟检测sigma-1受体在OSCC组织和细胞中的表达水平,探讨sigma-1受体在OSCC细胞增殖、迁移和侵袭中的作用及sigma-1受体与Nav1.5之间可能的相互作用,为OSCC的治疗提供新的诊断和治疗靶点。
1 材料与方法
1.1 主要材料
DMEM 高糖培养基、PBS购自美国Hyclone 公司;胎牛血清(FBS)购自乌拉圭ExCell公司;胰酶细胞消化液、RIPA裂解液、蛋白酶磷酸酶抑制剂混合物、蛋白浓度测定试剂盒、SDS-PAGE配胶试剂盒、0.5% Trixton X-100、DAPI、DAB、CCK-8试剂盒、结晶紫均购自上海碧云天生物技术有限公司;sigma-1受体和Nav1.5多克隆抗体购自美国Affinity公司;IgG标记的山羊抗鼠、抗兔二级抗体购自北京中杉金桥公司;FITC标记的荧光二抗购自成都正能生物公司;PVDF 膜购自美国Millipore公司;TRIzol试剂购自美国Invitrogen公司;逆转录试剂盒、实时荧光定量PCR(qRT-PCR)试剂盒购自南京诺唯赞公司;Lipofectamine2000购自美国 Thermo Fisher 公司;Matrigel 胶、Transwell 小室购自美国 Corning公司;人OSCC细胞系(SCC-4、HSC-3、CAL-27和SCC-9)由南京大学医学院附属口腔医院中心实验室赠送;人OSCC组织及邻近正常组织取自安徽医科大学第一附属医院口腔科。1.2 方法
1
.2
.1
细胞培养 OSCC细胞系SCC-4、HSC-3、CAL-27和SCC-9在添加了10%胎牛血清和1%青霉素链霉素混合液的高糖型DMEM培养基的细胞培养瓶中,置于37 ℃、5% CO培养箱中培养。每隔2 d换1次培养基,细胞长至90%左右用胰酶细胞消化液消化传代。1
.2
.2
免疫组织化学检测 为了防止破坏组织抗原性,石蜡包埋的组织切片被放置在60 ℃恒温箱中烘烤2 h,随后用二甲苯和乙醇进行脱蜡和水化。用3%过氧化氢室温孵育10 min,以消除内源性过氧化物酶的活性。蒸馏水冲洗后将切片放入装有磷酸盐缓冲液(PBS)的容器中,并在微波炉中加热15 min以促进抗原修复。将冷却后的切片用山羊血清封闭15 min,然后加入抗sigma-1受体的一抗(1 ∶200)后4 ℃孵育过夜。将切片与辣根过氧化物酶标记的山羊抗兔二级抗体(1 ∶1 000)室温孵育90 min,并用DAB显色,苏木精复染。最后用中性树脂封片后观察切片,并使用Image J软件进行分析。1
.2
.3
细胞免疫荧光实验 将长好细胞的爬片用4%多聚甲醛固定15 min,然后在室温下用0.5% Trixton X-100室温通透20 min。随后,在PBS浸洗后的爬片上滴加正常山羊血清封闭细胞30 min。加入稀释好的抗sigma-1受体的一抗(1 ∶200),并在4 ℃孵育过夜,第二天加入FITC标记的荧光二抗(1 ∶200)在湿盒中37 ℃避光孵育2 h。然后用DAPI对细胞核染色5 min后,用含抗荧光淬灭剂的封片液封片,随后在激光共聚焦显微镜下观察。1
.2
.4
Western blot实验 细胞用RIPA裂解液处理以获得总蛋白裂解物,蛋白质浓度用BCA蛋白质测定试剂盒测定,随后按比例加入蛋白酶磷酸酶抑制剂混合物后-20 ℃保存。样品用10%(sigma-1 受体)或6%(Nav1.5)十二烷基硫酸钠聚丙烯酰胺(SDS-PAGE)凝胶电泳分离,并转移到PVDF膜上,然后用5%奶粉室温封闭2 h。将膜与稀释好的一抗在4 ℃孵育过夜,随后用相应的山羊抗兔或抗鼠IgG二抗孵育90 min。最后,通过化学发光成像系统曝光,蛋白质印迹条带通过密度分析定量。1
.2
.5
qRT-
PCR实验 按照制造商的说明,用TRIzol试剂从OSCC细胞中提取总RNA。然后用引物逆转录试剂盒进行基因合成,将RNA逆转录为cDNA。定量聚合酶链反应在20 μl的反应体积中进行扩增,每组3个复孔。反应条件如下:95 ℃、5 min;95 ℃、10 s,60 ℃、30 s,扩增40个循环。所有引物均由上海生物工程公司进行设计合成,引物序列见表1。
表1 引物序列
1
.2
.6
siRNA转染 根据制造商的说明,使用Lipofectamine2000用Sig1R-siRNA或阴性对照的siRNA-NC转染CAL-27细胞。转染6 h后,用添加10%胎牛血清的DMEM培养基代替无血清基础培养基,然后在转染后24 h或48 h收集细胞进行下一步实验。所有siRNAs均由上海吉玛制药有限公司合成。相关siRNA序列见表2。
表2 siRNA序列
1
.2
.7
CCK-8检测细胞增殖 根据制造商的说明,使用CCK-8试剂盒测定细胞增殖情况。对照组和经siRNA转染后的CAL-27细胞重新接种在96孔板中(每组设5个复孔)并培养至24、48、72 h。在指定的时间加入CCK-8溶液(10 μl /孔)后37 ℃培养2 h,显色反应后,用酶标仪测定450 nm 处吸光度值(optical density,OD)。1
.2
.8
Transwell实验 Transwell细胞迁移实验是将各组细胞血清饥饿过夜,用无血清DMEM培养基重悬细胞后取200 μl接种到Transwell小室的上室中,然后在下室中加入600 μl含有20% FBS作为化学引诱剂的DMEM培养基。在37 ℃孵育24 h后(侵袭48 h),用棉签轻轻擦去上室中剩余的细胞,然后将黏附在过滤器下表面的细胞用4%多聚甲醛固定20 min,并用结晶紫染色30 min。在倒置显微镜下观察被侵入或迁移的细胞图像,并进行拍照和计数。Transwell侵袭实验除需要在细胞接种前在上室中预先涂好基质凝胶外,其余方法与迁移实验一致。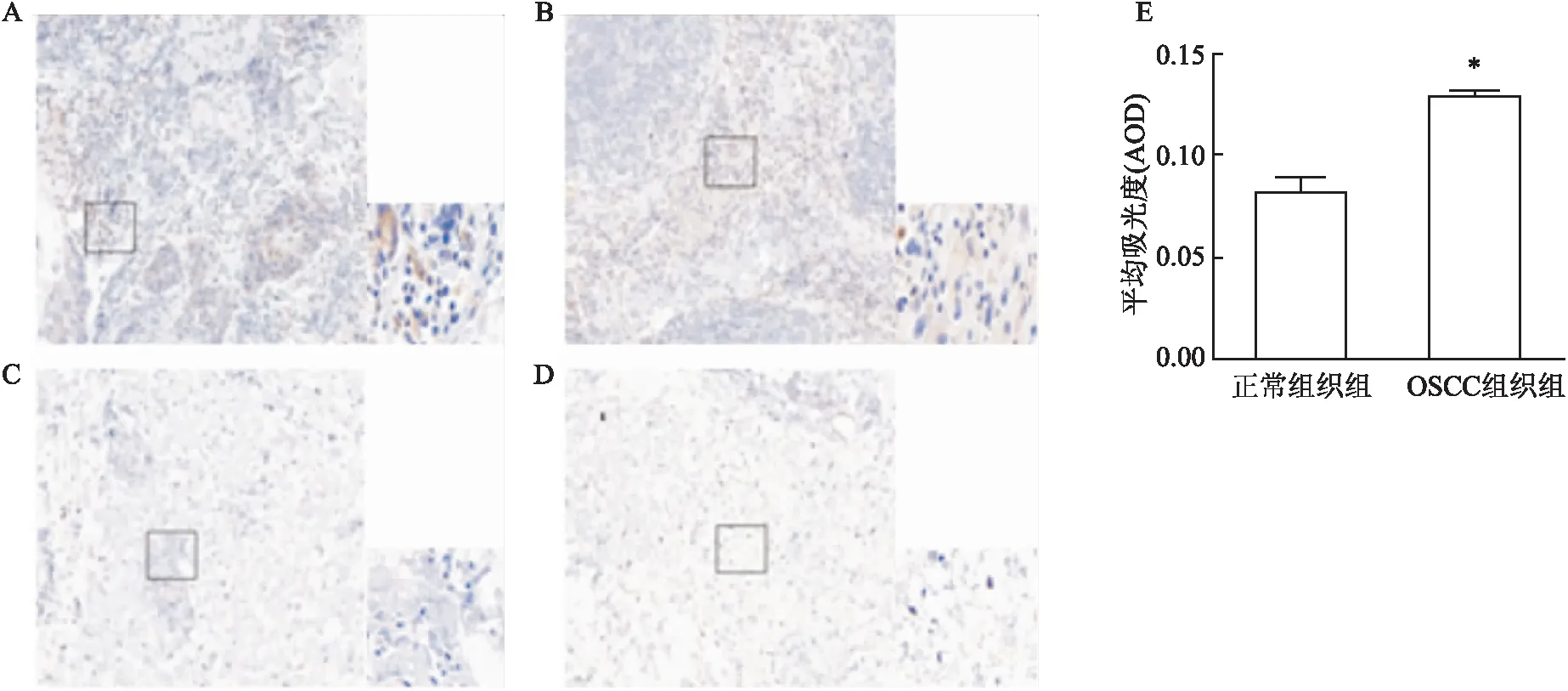
图1 免疫组化法检测sigma-1受体的表达
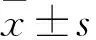
2 结果
2.1 sigma-1受体在人OSCC组织中的表达情况
免疫组化检测临床收集的OSCC组织及邻近正常组织中sigma-1受体的表达。结果显示OSCC组织中可见明显的棕黄色染色,表明sigma-1受体呈阳性表达;相反,在正常组织中几乎看不到棕黄染色,见图1。结果表明,与正常组织比较,sigma-1受体在OSCC中呈高表达(P
<0.05)。2.2 sigma-1受体的表达水平与OSCC患者预后的相关性
利用GEPIA数据库分析sigma-1受体表达水平与OSCC患者预后的相关性。结果表明,sigma-1受体的表达水平与OSCC患者的总体生存率呈负相关,即sigma-1受体表达水平高的患者的总体生存率低于表达水平较低者,差异有统计学意义(P
<0.05)。见图2。提示sigma-1受体的高表达可能影响OSCC患者的生存和预后。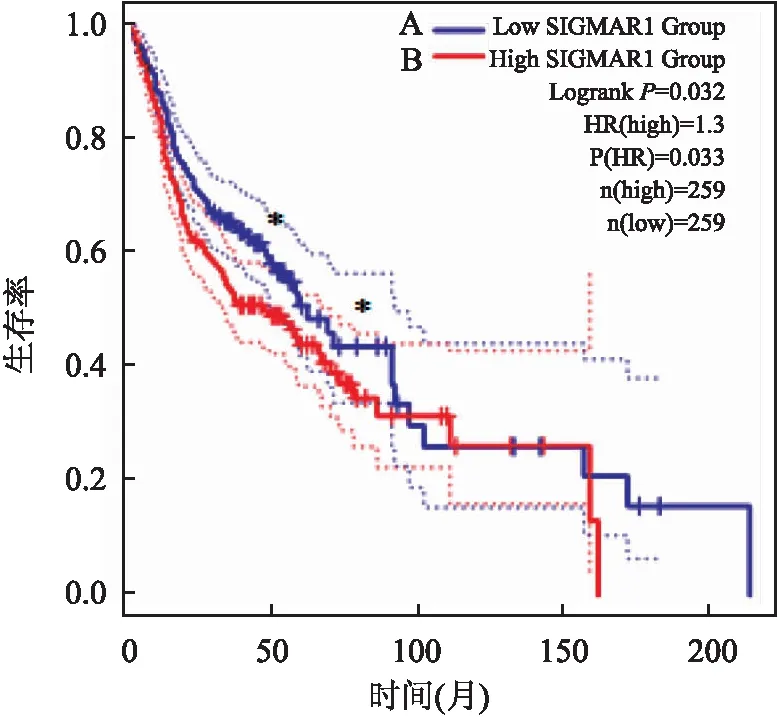
图2 sigma-1受体表达水平与OSCC患者总生存率的相关性
2.3 sigma-1受体在OSCC细胞系中的表达情况及定位
Western blot检测了sigma-1受体在4种OSCC细胞系中的表达水平,包括SCC- 4、HSC-3、CAL-27和SCC-9。结果表明sigma-1受体在4种人OSCC细胞系中均有表达,且在CAL-27细胞中sigma-1受体的表达水平高于其他细胞,见图3A,因此,选择CAL-27细胞用于之后的研究。此外,还通过细胞免疫荧光分析检测sigma-1受体在OSCC细胞中的表达定位,激光共聚焦结果显示sigma-1受体在CAL-27细胞中主要表达在质膜上,见图3B。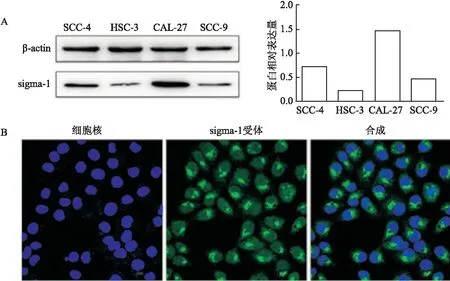
图3 sigma-1受体在OSCC细胞中的表达及定位
2.4 Sig1R-siRNA对CAL-27细胞中sigma-1受体表达水平的抑制作用
为了检测Sig1R-siRNA在CAL-27细胞中的沉默效果,分别通过qRT -PCR和Western blot检测了sigma-1受体在Control组、siRNA-NC组以及3种Sig1R-siRNA中的mRNA和蛋白质表达水平。与Control组比较,Sig1R-siRNA 1组、Sig1R-siRNA 2组和Sig1R-siRNA 3组sigma-1受体的mRNA表达均明显下调。sigma-1受体的蛋白表达水平仅被Sig1R-siRNA 2和Sig1R-siRNA 3有效下调,差异有统计学意义(P
<0.01)。与之相反,Control 组和 siRNA-NC组之间差异无统计学意义,见图4。这些数据表明Sig1R-siRNA能有效地抑制CAL-27细胞中sigma-1受体的表达水平,接下来的实验均采用Sig1R-siRNA 3 转染。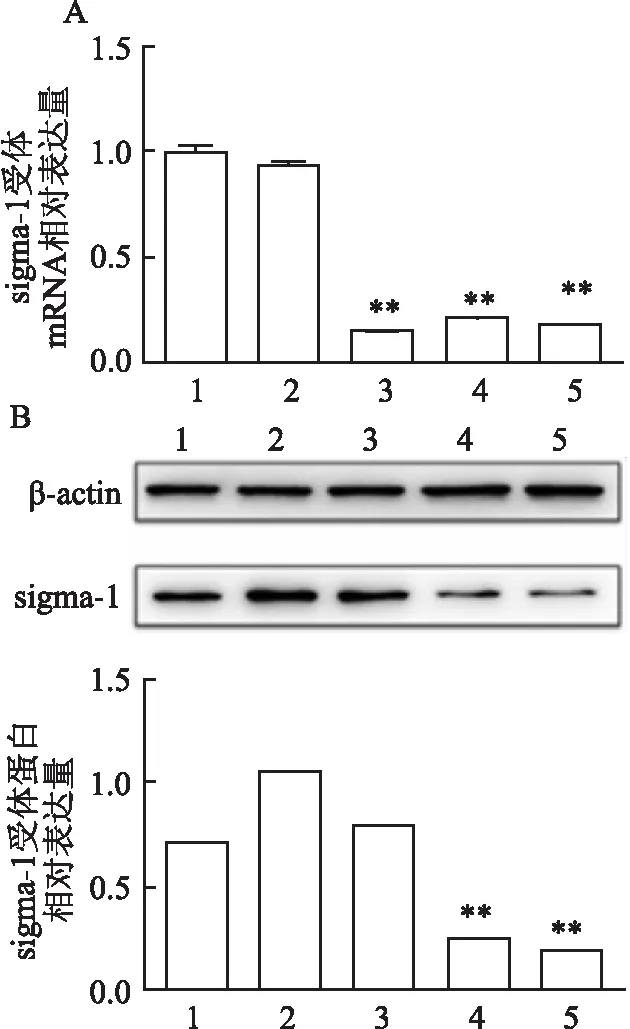
图4 经 siRNA转染后 sigma-1受体的表达水平
2.5 下调sigma-1受体表达对CAL-27细胞增殖、迁移和侵袭的影响
通过CCK-8和Transwell分析探究了sigma-1受体在OSCC细胞CAL-27发展中的作用。分别在转染24、48、72 h后检测细胞OD值,CCK-8测定结果显示,与Control组和NC组相比,转染24 h后,Sig1R-siRNA3组的细胞增殖能力显著降低(F
=3.04,P
<0.05)。见图5A。通过Transwell试验检测了下调sigma-1受体表达对CAL-27细胞迁移和侵袭能力的影响。与Control组和NC组比较,Sig1R-siRNA3组明显抑制CAL-27细胞的迁移和侵袭(F
=0.145、0.009,P
<0.01)。Control 组和 siRNA-NC组之间差异无统计学意义,见图5B、C。研究证明下调sigma-1受体可以显著抑制CAL-27细胞的增殖、迁移和侵袭。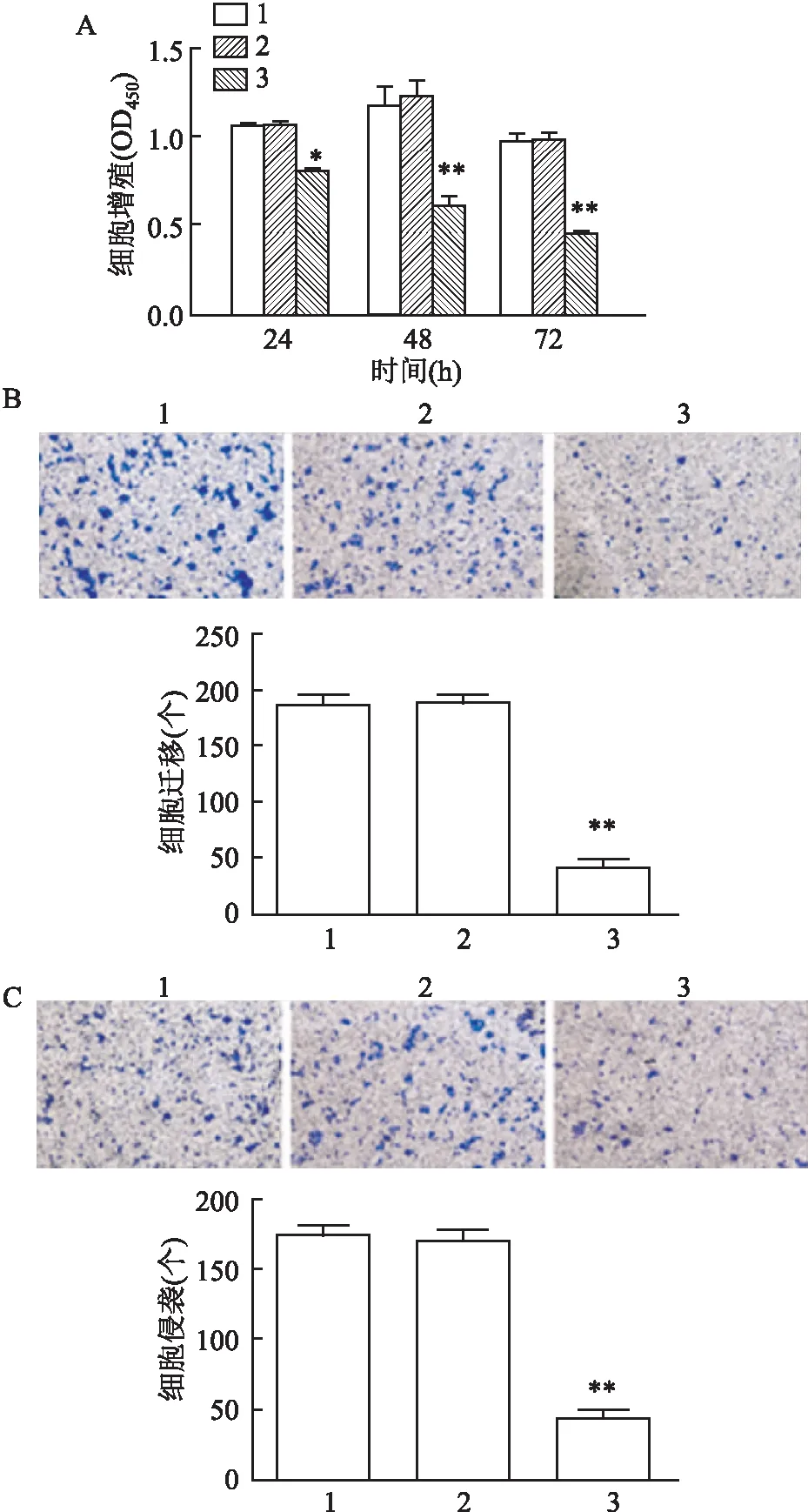
图5 经 siRNA转染后对CAL-27细胞增殖、迁移和侵袭的影响
2.6 沉默sigma-1受体表达对CAL-27细胞中Nav1.5表达的影响
分别采用qRT-PCR和Western blot检测了转染Sig1R-siRNA 3后CAL-27细胞中Nav1.5的mRNA和蛋白质表达水平。结果表明,与Control组和NC组相比,Sig1R-siRNA 3组沉默sigma-1受体表达后细胞内Nav1.5的mRNA和蛋白质表达水平也明显降低(F
=1.28,P
<0.05)。见图6。结果表明sigma-1受体可能通过与Nav1.5的相互作用从而影响OSCC生物学行为的改变。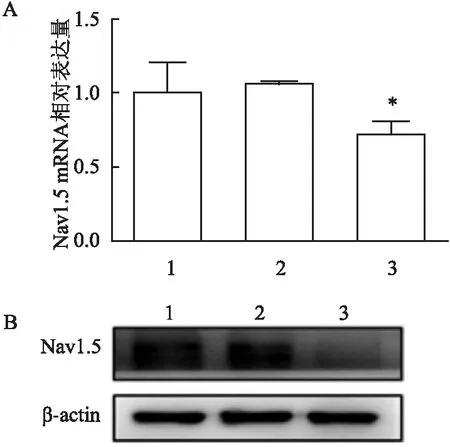
图6 沉默sigma-1受体表达后CAL-27细胞内Nav1.5的表达水平
3 讨论
sigma受体最初被误认为是阿片受体亚型,随后研究表明其是一种独特的药理学调控的伴侣或支架蛋白,独立于任何其他已知的受体。sigma-1受体最初主要在中枢神经系统进行研究,临床研究表明sigma-1受体与许多疾病相关,如抑郁症、神经退行性疾病和药物成瘾等。研究表明,sigma-1受体在肺癌、乳腺癌、前列腺癌和恶性黑色素瘤等多种人类癌细胞和组织中表达上调,sigma-1受体通过介导脂质筏重构影响乳腺癌细胞系的黏附和增殖。研究表明,siRNA沉默sigma-1受体以及sigma-1受体配体药物可以抑制乳腺癌、结肠癌和前列腺癌细胞的增殖和迁移。因此,sigma-1受体作为癌症潜在的新治疗靶点和预后标志物,具有重要的研究价值。该研究表明sigma-1受体在OSCC组织和细胞系中高表达,通过转染siRNA下调sigma-1受体表达显著抑制了OSCC细胞的增殖、迁移和侵袭行为,表明sigma-1受体可作为OSCC治疗靶点和预后生物标志物的可能性,为OSCC的治疗提供了新的方向。
研究表明Nav1.5参与OSCC的发生发展,在乳腺癌中的研究表明sigma-1受体通过与Nav1.5通道的功能性相互作用增加了乳腺癌细胞的侵袭和黏附能力,在乳腺癌细胞系MDA-MB-231中sigma-1受体以4倍对称性结合Nav1.5通道,增加Nav1.5电流密度,使细胞侵袭能力增强。在MDA-MB-231和MDA-MB-468细胞中,sigma-1受体通过与幼稚型Nav1.5通道的功能作用增加了细胞对底物的黏附。电压门控钠离子通道(VGSCs)已被证明在多种癌症组织和细胞中异常表达,并与肿瘤的恶性表型和侵袭转移明确相关。课题组前期研究表明,低分化OSCC组织中Nav1.5的表达水平高于高分化OSCC组织,其表达水平与NLR、PLR、TNM分期及淋巴结转移密切相关,通过转染特异性siRNA沉默Nav1.5基因可显著抑制OSCC细胞的生物学行为。该研究表明转染Sig1R-siRNA沉默sigma-1受体表达后,CAL-27细胞中Nav1.5的表达水平也随之降低。因此,研究OSCC中sigma-1受体与Nav1.5可能的相互作用机制及其配体药物对癌细胞功能的影响具有重要意义和价值。该研究通过细胞免疫荧光实验表明sigma-1受体可以分布在整个细胞质中,在靠近核周区有聚集分布,可能是在线粒体相关的内质网膜上,这与之前文献中的研究结果是一致的。综上所述,该研究表明sigma-1受体参与OSCC的发生发展,并为OSCC的诊断和治疗提供了新的思路。

