去乙酰化酶SIRT6通过激活PI3K-AKT通路促进肾癌细胞增殖、迁移
李天宇,汪 鑫,张 森,毕良宽,王德光
肾细胞癌(renal cell carcinoma,RCC)是肾脏中最常见的恶性肿瘤。在过去的10年中,RCC的发生率以每年2%的速度增长。转移和化疗耐药性是RCC的特征。由于缺乏有效的治疗方法,RCC患者的中位生存时间仅为6~12个月,而5年生存率不到20%。最近的研究表明,超过90%的肾癌相关死亡与RCC的转移有关。因此,迫切需要确定新的治疗靶点。
SIRT6是NAD依赖的去乙酰化酶Sirtuins家族成员之一,在染色质信号传导和基因组维持中已确定作用。通过这些功能,SIRT6可以预防与衰老相关的疾病,包括代谢性疾病和癌症,并可以延长小鼠的寿命。在RCC发展过程中,SIRT6的表达是否发生变化及其对RCC细胞转移能力的调控尚不清楚。该研究通过RCC患者组织及细胞系,观察SIRT6在RCC发展中的表达及其对RCC细胞增殖、迁移能力的影响。
1 材料与方法
1.1 主要试剂
RPMI-1640培养基(美国Hycolne公司),胎牛血清(美国Gibco公司);转染试剂jetPRIME transfection reagent(法国Polyplus-transfection公司),RIPA裂解液(上海碧云天生物技术有限公司),小干扰RNA(上海吉玛制药技术有限公司),Western blot SIRT6抗体(英国Abcam公司),免疫组化SIRT6抗体(美国Proteintech公司),兔二步法试剂盒(北京中杉金桥公司),兔源H3、H3K9ac、GAPDH、Akt、p-Akt抗体和山羊抗兔二抗(美国Affinity公司),兔源β-Tubulin(美国Cell signaling technology公司),二甲基亚砜(美国Sigma公司),OSS_128167粉末(美国MCE公司)。1.2 病例资料
从安徽医科大学第二附属医院病理科调取术后17例患者的肾癌组织和癌旁组织切片,肾癌组织类型皆为透明细胞癌,同时患者已签署知情同意书。人肾癌细胞系ACHN、786-O细胞购自ATCC,使用含10%胎牛血清、1%青链霉素的RPMI-1640培养基于37 ℃、5% CO的细胞培养箱培养。1.3 细胞转染
转染选择在对数生长期的细胞,按照说明书将SIRT6-siRNA转染到ACHN、786-O细胞中,并在转染48 h后用于划痕实验或收集细胞蛋白等。1.4 细胞加药处理
将OSS_128167粉末离心后溶于DMSO中,并配制成用药浓度为50、100、200 μmol/L培养基培养细胞24 h后进行MTT及划痕实验,并收集细胞蛋白。1.5 Western blot免疫印迹法检测细胞蛋白表达
RIPA法提取处理后的细胞总蛋白,通过SDS-PAGE电泳分离并转移至PVDF膜,5%脱脂牛奶封闭2 h,一抗4 ℃孵育过夜,TBST洗膜,二抗室温孵育1 h,随之ECL化学发光反应,化学发光图像系统分析系统进行图片拍照,Image J对图像进行半定量分析。1.6 划痕实验
将对数生长期细胞接种于6孔板中,待贴壁后用1 ml枪头从上到下用力划出一条痕迹,拍照记录,后续每隔6 h进行1次拍照,直至24 h最后1次拍照,测量划痕两侧细胞之间的面积用来计算24 h细胞愈合率。1.7 四甲基偶氮唑蓝法检测细胞增殖活力
将细胞种于96孔板中,每孔含有细胞2 000个,并加入药物OSS_128167进行24 h刺激,浓度分别为50、100、200 μmol/L,每组做10个复孔。每孔加入10 μl MTT溶液,继续在细胞培养箱中培养4 h,每孔再加入10 μl Formazan溶解液并适当混匀放入培养箱中继续孵育,3~4 h后显微镜下观察到紫色Formazan结晶全部溶解则移至酶标仪处测570 nm处吸光度。1.8 免疫组织化学染色
将切片放置在枸橼酸盐缓冲液中,加热至沸腾使温度维持在90~100 ℃、7 min,再沸腾1次,PBS缓冲液冲洗3次(每次5 min),内源性过氧化物酶阻断剂封闭10 min,PBS冲洗3次(每次5 min),4 ℃一抗孵育过夜,PBS冲洗3次(每次5 min),显色增强剂孵育30 min,PBS冲洗3次(每次5 min),酶标山羊抗兔IgG二抗孵育30 min,PBS冲洗3次(每次5 min),DAB显色。1.9 Transwell迁移实验
将细胞消化后接种在含200 μl无血清培养基的小室中,24孔板里放入800 μl含30%小牛血清的培养基中,放入培养箱24 h,取出并加入4%多聚甲醛固定30 min,再加入0.1%结晶紫染色8 min,PBS清洗3次后用棉签轻擦小室上部,放于显微镜下拍照。用Image J计算穿过小室的细胞数,并进行统计学分析。1.10 统计学处理
采用GraphPad Prism 8.0软件进行统计学处理,多组间比较采用单因素方差分析(One-way ANOVA),正态性检验采用Shapiro-Wilk检验,方差齐性检验采用Brown-Forsythe校正,两独立样本之间采用t
检验。以P
<0.05为差异有统计学意义。Transwell的细胞数计算和划痕实验的细胞愈合率采用Image J进行定量或半定量分析。2 结果
2.1 SIRT6在人肾癌组织和肾癌细胞系中的表达
从17例病人中随机选取了3例肾透明细胞癌患者癌组织和癌旁组织,免疫组化结果显示:肾癌组织中SIRT6的表达明显升高,而癌旁组织中SIRT6几乎不表达,见图1A。同时选取人肾癌细胞系ACHN、786-O和正常人肾小管上皮细胞HK-2检测SIRT6的表达。Western blot结果显示,与HK-2细胞比较,SIRT6在肾癌细胞系ACHN、786-O中表达分别升高1.43倍(t
=8.409,P
<0.01)和1.22倍(t
=4.122,P
<0.05),见图1B。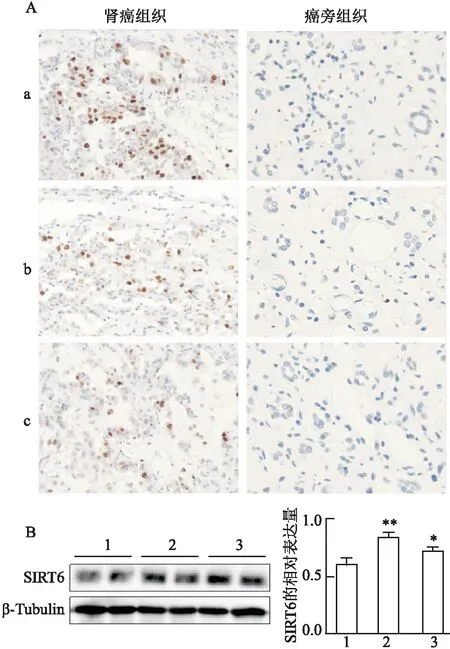
图1 SIRT6在肾癌中的表达变化
2.2 干扰SIRT6对ACHN细胞迁移能力的影响
使用SIRT6-RNAi干扰ACHN细胞。合成的3条siRNA片段用于进行SIRT6的干扰,Western blot结果显示,与Vector组比较,SIRT6-siRNA1能够显著降低ACHN细胞中SIRT6的表达(F
=72.01,P
<0.01),故选用siRNA1进行后续实验,见图2A。ACHN细胞转染SIRT6-siRNA后,与Vector组比较,SIRT6下游蛋白H3K9乙酰化水平显著升高(F
=10.89,P
<0.001),而H3总蛋白表达没有明显变化,见图2B。划痕实验结果表明,与Vector组比较,SIRT6-siRNA转染后ACHN细胞划痕愈合面积较小,提示其迁移能力明显减弱(F
=149.4,P
<0.01)。Transwell实验结果显示,与Vector组比较,转染SIRT6-siRNA转染后ACHN穿过小室的细胞数较少(F
=59.27,P
<0.01),迁移能力明显降低,见图2C、D。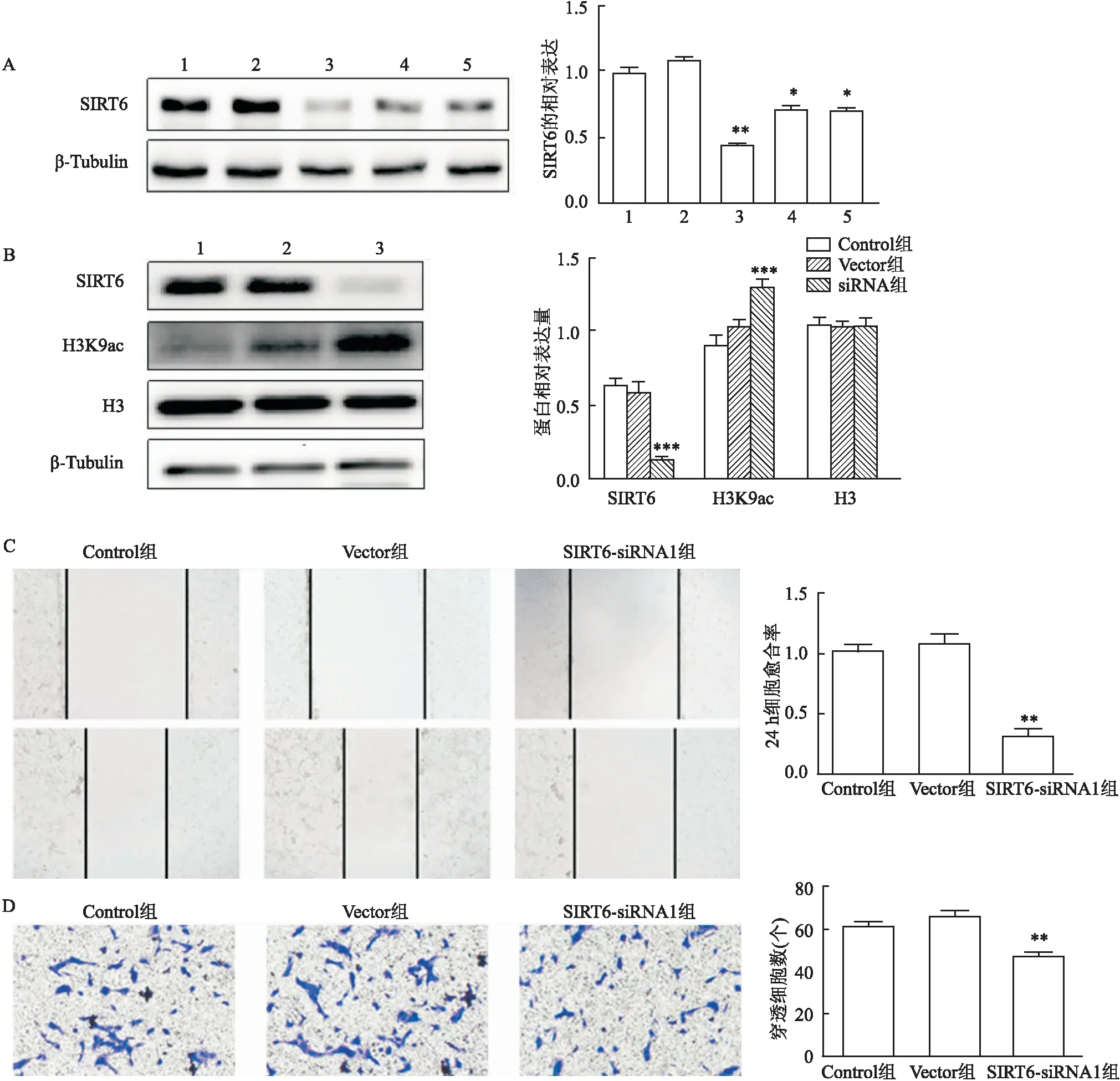
图2 SIRT6-siRNA对ACHN的影响
2.3 SIRT6特异性抑制剂OSS_128167对肾癌细胞增殖能力的影响
Western blot结果显示,与DMSO组比较,随着OSS_128167(50、100、200 μmol/L)浓度的增加(F
=96.27,P
<0.001),在ACHN细胞中乙酰化H3K9蛋白表达逐渐升高,而对SIRT6蛋白和H3总蛋白表达无影响(图3A)。MTT结果显示,不同浓度的OSS_128167(50、100、200 μmol/L)处理24 h后,与DMSO组比较,ACHN的增殖活力随着用药浓度提高而显著降低(F
=43.39,P
<0.001)(图3B)。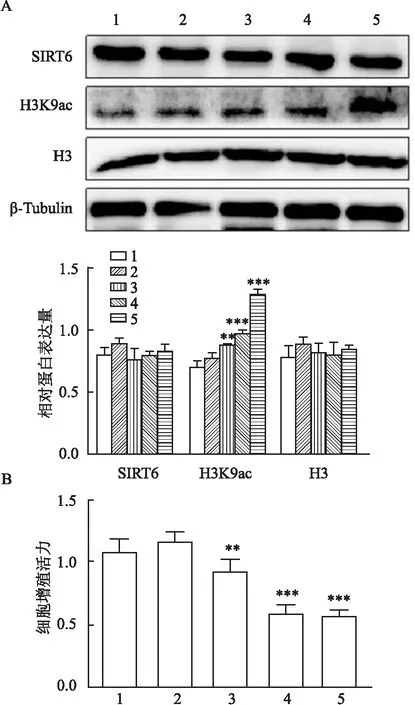
图3 OSS_128167对ACHN细胞SIRT6、H3K9ac表达和增殖活力的影响
2.4 SIRT6特异性抑制剂OSS_128167对肾癌细胞ACHN中PI3K、AKT表达的影响
Western blot结果显示,与DMSO组比较,不同浓度OSS_128167(50、100、200 μmol/L)处理ACHN细胞后,随着浓度的升高,p-PI3K、p-AKT蛋白的表达逐渐降低(F
=84.66,P
<0.001;F
=23.39,P
<0.001),而PI3K、Akt蛋白的表达没有明显变化,见图4。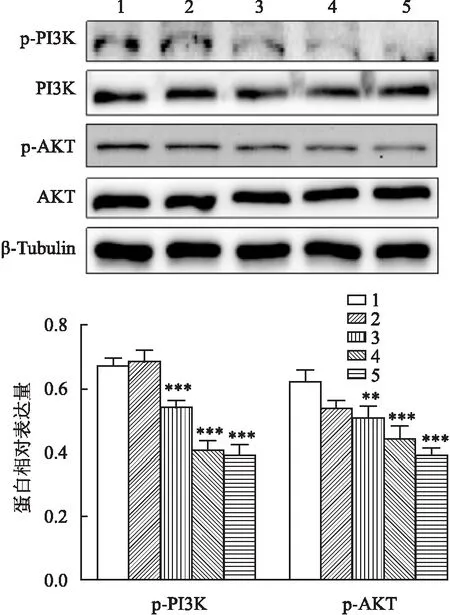
图4 OSS_128167对PI3K/AKT信号通路的影响
3 讨论
肾癌的发病机制较为复杂,尚未能完全明确,且面临治疗方法敏感性较差,肿瘤耐药等问题,因此,确定新的肾癌治疗靶点和药物是当前肾癌研究的关键。
Sirtuins家族包含7个NAD依赖性酶(SIRTs1-7),它们涉及衰老、代谢和癌症等多种途径,因此,其被认为是细胞活动的主要调节剂。SIRT6作为家族成员之一,对SIRT6的研究从最初的衰老和长寿的调控到近几年在肿瘤,多样化的功能使其能够参与基因组的稳定性、DNA修复、癌症及代谢的调节,由于这些过程与癌症的发生发展具有密切的联系,因此,SIRT6也被认为是癌症研究中较有吸引力的靶标。
SIRT6在各种癌症中失调,SIRT6在肿瘤发生中的作用取决于肿瘤的类型和背景。在胰腺癌、乳腺癌、原发性黑色素瘤、非小细胞肺癌中,SIRT6在这些表达升高的癌症中可能代表了一种对抗肿瘤进展的补偿机制,在多发性骨髓瘤中SIRT6表达的增加,可以增强H3K9的脱乙酰基作用并抑制MAPK/ERK的转录,从而抑制肿瘤细胞的增殖。这些研究表明,细胞中SIRT6活性的调节随肿瘤类型和癌症分期而变化,反映SIRT6在癌细胞生物学中的复杂机制和多效作用。
在以往的研究中,肾癌中SIRT6表达水平尚有争议:肾癌的免疫组化显示SIRT6表达升高,且SIRT6抑制通过阻滞肾癌细胞786-O的G/S期来抑制肿瘤生长,而在另外的研究中,肾癌组织的免疫组化提示SIRT6的表达显著低于正常组织。在该研究中,结果显示SIRT6在肾癌组织中的表达高于癌旁组织,提示SIRT6的异常表达可能在肾癌进展中发挥调控作用。SIRT6-siRNA干扰ACHN细胞后,随后通过细胞划痕实验和Transwell实验表明了SIRT6蛋白的下降能抑制肾癌细胞迁移。由于药物的毒性和耐药性,治疗肾癌的手段选择有限。
OSS_128167作为SIRT6的特异性抑制剂已经被以往的研究证明,SIRT6作为NAD依赖性去乙酰化酶,OSS_128167与NAD的烟酰胺(NAM)部分的结合位点非常接近。抑制剂部分占据了肽底物结合位点,随后阻止了活性组氨酸朝向NAD定向以进行反应。OSS_128167可以通过抑制SIRT6的活性而不影响SIRT6蛋白表达而提高SIRT6的特异性下游靶标H3K9的乙酰化水平。细胞增殖实验所示,SIRT6的活性可被OSS_128167所抑制并且降低肾癌细胞的增殖。进一步的药物代谢动力学研究仍有必要,以确定OSS_12816单独使用或与其他药物联合使用的剂量和不良反应。
PI3K/AKT是一种众所周知的重要信号转导途径,在各种癌症的发生和发展中发挥着不可或缺的作用。PI3K/AKT作为经常被激活的癌症驱动因子在遗传上比其他生长因子信号途径靶向更多的途径组成成分和更多的肿瘤类型。在弥漫性大B细胞淋巴瘤中报道SIRT6在PI3K/AKT信号通路中富集,shSIRT6可抑制PI3K/AKT通路的磷酸化激活,该研究中SIRT6活性被OSS_128167抑制后出现PI3K/AKT磷酸化的抑制,说明SIRT6诱导的PI3K/AKT信号通路的激活可能是肾癌发展的重要分子机制,但需要进一步研究来证明SIRT6调控该通路的生物学机制和信号串扰。

