肝细胞癌患者TIM-3+ TIGIT+CD4+ T细胞和TIM-3+TIGIT+CD8+ T细胞免疫耗竭及其与疾病进展的关系
袁润林,郑美娟,陈正徐,徐元宏
肝细胞癌(hepatocellular carcinoma,HCC)作为世界范围内常见的恶性肿瘤,临床医师对晚期肝癌的治疗面临着巨大挑战。许多恶性肿瘤的治疗选择靶向免疫检查点抑制剂。T细胞免疫球蛋白和ITIM结构域蛋白(TIGIT)是T细胞或NK细胞抑制性受体,T细胞免疫球蛋白黏蛋白-3(TIM-3)是一种免疫负性调控因子,程序性死亡受体1(PD-1)是一种常见的免疫抑制受体。CD4和CD8调节性T淋巴细胞参与肿瘤微环境中的免疫抑制,在肿瘤微环境中,CD8和CD4T细胞等免疫细胞通常伴随着细胞表面异常表达的抑制性受体谱系。而且,针对单个免疫检查点的单克隆抗体在HCC患者的治疗中应答率较低。
该研究通过检测HCC患者外周血CD4T细胞、CD8T细胞中PD-1、TIM-3、TIGIT和白介素(interleukin,IL)-10的表达,探讨免疫检查点的表达状态与HCC进展、预后的关系,进而为逆转免疫细胞耗竭及HCC的临床治疗提供目标靶点。
1 材料与方法
1.1 材料
1
.1
.1
病例资料 收集安徽医科大学第一附属医院 2019年10月—2020年11月30例HCC患者临床资料。健康对照组(health controls,HC) 根据患者的依从性和年龄选择20例健康人;所有HCC患者诊断均符合《原发性肝癌诊断标准》,所有健康者排除患肿瘤、病毒性肝炎、自身免疫性肝炎。1
.1
.2
试剂与仪器 抗体PE-PD-1、BV421-TIM-3、APC-H7-CD8、BV421-IL-10、BV510-CD3均购自美国 BD 公司;抗体APC-TIGIT购自美国Biolegend公司;红细胞裂解液、CBA Human Th1 / Th2 Cytokine Kit(IL-2、IL-4、IL-6、IL-10、TNF、IFN-gamma) 购自美国BD公司;细胞固定液和穿膜液购自美国赛默飞公司;Ficoll液购自天津TBD公司;佛波醇12-十四酸酯13-乙酸酯(PMA)、莫能霉素(MON) 购自美国Sigma-Aldrich公司;离子霉素(ION) 购自美国Merck Millipore公司。FACS CANTO Ⅱ PLUS 型流式细胞仪购自美国BD公司;DXH800全自动血液分析仪购自美国Beckman公司。1.2 方法
1
.2
.1
标本采集 分别采集HCC患者和健康体检者外周血,置于血清管和EDTA抗凝管;EDTA抗凝血用于流式细胞术检测PD-1CD4T细胞、TIM-3CD4T细胞、TIGITCD4T细胞、PD-1CD8T细胞、TIM-3CD8T细胞、TIGITCD8T细胞和IL-10CD4T细胞的比例,全自动血液分析仪进行白细胞计数与分类;血清用于 Th1 / Th2细胞因子检测。1
.2
.2
分离单个核细胞(PBMC) 准备15 ml离心管1支,同时加入2 ml Ficoll液,将2 ml PBS加入患者和健康人2 ml抗凝全血中进行1 ∶1稀释。然后将稀释后的全血缓慢加在Ficoll液面,注意沿管壁进行缓慢加样,保持两液面清晰,不要让血液混入至分层液内。然后置于离心机中1 900 r/min配平离心30 min后,用吸管将白膜层细胞缓慢吸至流式试管中,即为外周血分离PBMC。1
.2
.3
PD-1CD4T细胞、TIM-3CD4T细胞、TIGITCD4T细胞、PD-1CD8T细胞、TIM-3CD8T细胞、TIGITCD8T细胞的检测 分离1×10PBMC后;在流式管中用加样枪分别加入相应抗体BV510-CD3、APC-H7-CD8、PE-PD-1、APC-TIGIT、BV421-TIM-3各10 μl并混匀,将流式管室温及避光条件下孵育20 min,然后加入2 ml PBS 1 800 r/min 离心5 min,弃上清液,200 μl PBS重悬细胞沉淀,BD流式细胞仪上机检测,采用Flowjo软件分析检测结果。1
.2
.4
IL-10CD4T细胞的检测 分离 PBMC后,将含10% FBS的DMEM 培养基、PMA,MON及ION按照比例配置成内标刺激液,在细胞中加入1 ml培养基,混匀之后放入温箱内孵育4 h,然后离心、弃上清液,PBS洗涤1次,分别加入相应抗体BV510-CD3、APC-H7-CD8并混匀,置于4 ℃冰箱内避光孵育30 min,加入100 μl固定液4 ℃冰箱避光孵育40 min后加入1 ml穿膜液破膜,PBS洗涤弃上清液后分别加入BV421-IL-10抗体10 μl,混匀后放入4 ℃冰箱内孵育60 min。然后加入1 ml PBS 1 800 r/min离心5 min,弃上清液,300 μl PBS重悬细胞沉淀, BD流式细胞仪上机检测,采用Flowjo软件分析检测结果。1
.2
.5
CBA技术用于检测Th1 /Th2 细胞因子 准备标准品,采用倍比稀释方法,将9个试管分别标记为原液,1 ∶2、1 ∶4、1 ∶8、1 ∶16、1 ∶32、1 ∶64、1 ∶128和1 ∶256;除原液管外,每根管子内加入50 μl稀释液,再依次转移50 μl至下一管内,完成梯度稀释;然后根据实验的样本和标准曲线的数量确定配置 Mixbeads所需量,配好的Mixbeads 3 500 r/min离心5 min,倒去上清液,并加入体积相同的Serum Enhancement Buffer液,混匀后避光孵育30 min;取新流式管编号,在每管中依次加入50 μl Mixbeads、50 μl抗体B液、50 μl标本血清或配备的标准品,振荡混匀,避光孵育3 h,然后每管中加1 ml PBS 1 500 r/min离心5 min,弃上清液,加入300 μl PBS重悬,BD流式细胞仪上机检测,细胞因子浓度采用DIVA 软件和OriginPro软件分析。
2 结果
2.1 病例资料
30例HCC患者中男性20例,女性10例,年龄37~70(55.2±7.6)岁。20例健康对照组(HC组)中男性13例,女性7例,年龄35~66(51.8±7.1)岁。HCC组与健康对照组性别、年龄比较差异无统计学意义。2.2 HCC患者外周血中CD4
T细胞相关表型表达比例的检测
采用流式细胞术检测外周血PBMC中CD4T细胞,HCC患者组外周血TIM-3CD4T细胞、TIGITCD4T细胞、PD-1CD4T细胞、TIM-3TIGITCD4T细胞比例高于健康对照组,差异有统计学意义(P
<0.001,t
=4.042、3.533、3.867、4.327),见图1A、B、C。进一步检测PD-1在HCC患者组外周血TIM-3TIGITCD4T细胞和TIM-3TIGITCD4T细胞两组中的表达,研究表明PD-1TIM-3TIGITCD4T细胞比例高于PD-1TIM-3TIGITCD4T细胞比例,差异有统计学意义(P
<0.001,t
=5.106),统计图见图1D。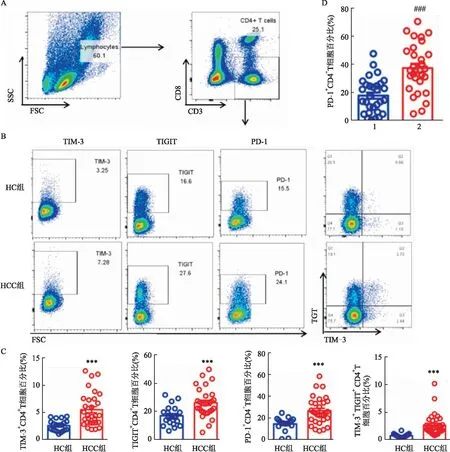
图1 HCC患者及健康对照者外周血CD4+ T细胞表型检测
2.3 HCC患者外周血中CD8
T细胞相关表型表达比例的检测
采用流式细胞术检测外周血PBMC中CD8T细胞,HCC患者组外周血TIM-3CD8T细胞、TIGITCD8T细胞、PD-1CD8T细胞比例高于健康对照组,差异有统计学意义(P
<0.01,t
=3.346、2.782、2.938)。此外,该研究进一步检测患者组TIM-3TIGITCD8T细胞比例明显高于健康对照组,差异有统计学意义(P
<0.001,t
=3.852)。见图2A、B、C。进一步检测PD-1在HCC患者组外周血TIM-3TIGITCD8T细胞和TIM-3TIGITCD8T细胞两组中的表达,研究表明PD-1TIM-3TIGITCD8T细胞比例高于PD-1TIM-3TIGITCD8T细胞比例,差异有统计学意义(P
<0.001,t
=4.642),见图2D。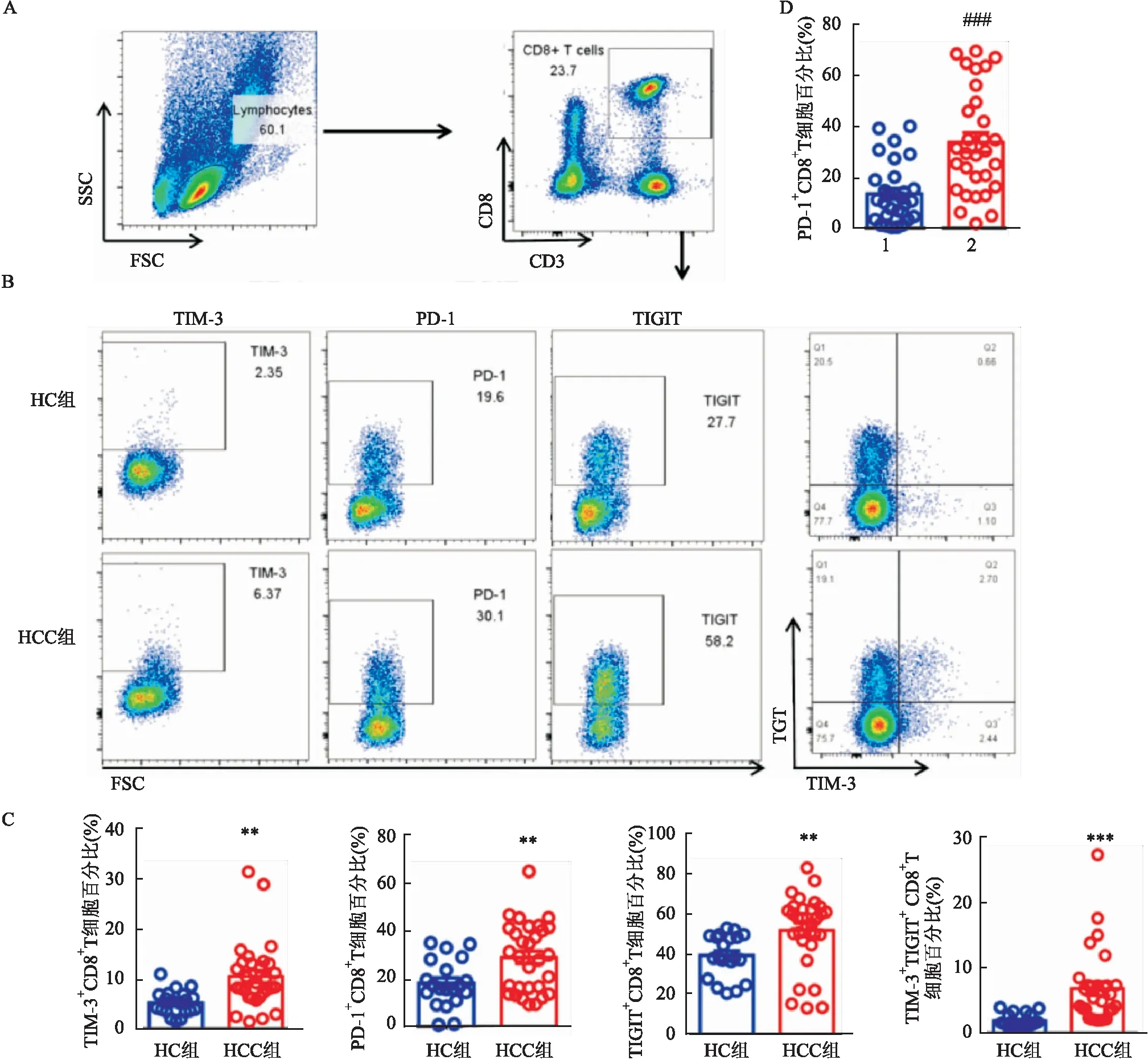
图2 HCC患者及健康对照者外周血CD8+ T细胞表型检测
2.4 HCC患者外周血中TIM-3
TIGIT
CD8
T细胞比例与TIM-3
TIGIT
CD4
T细胞比例的ROC曲线分析
利用 ROC曲线分析外周血中TIM-3TIGITCD8T细胞比例与TIM-3TIGITCD4T细胞比例在HCC的诊断价值,该研究表明TIM-3TIGITCD8T细胞比例在HCC的诊断效能(AUC=0.915,cutoff value=1.95%, 95%CI
: 0.839~ 0.991)均大于TIM-3CD8T细胞比例(AUC=0.796)和TIGITCD8T细胞比例(AUC=0.772),见图3A。同时,TIM-3TIGITCD4T细胞比例在HCC的诊断效能(AUC=0.950,cutoff value=1.05%, 95%CI
: 0.897~1.004)均大于TIM-3CD4T细胞比例(AUC=0.835)和TIGITCD4T细胞比例(AUC=0.780),见图3B。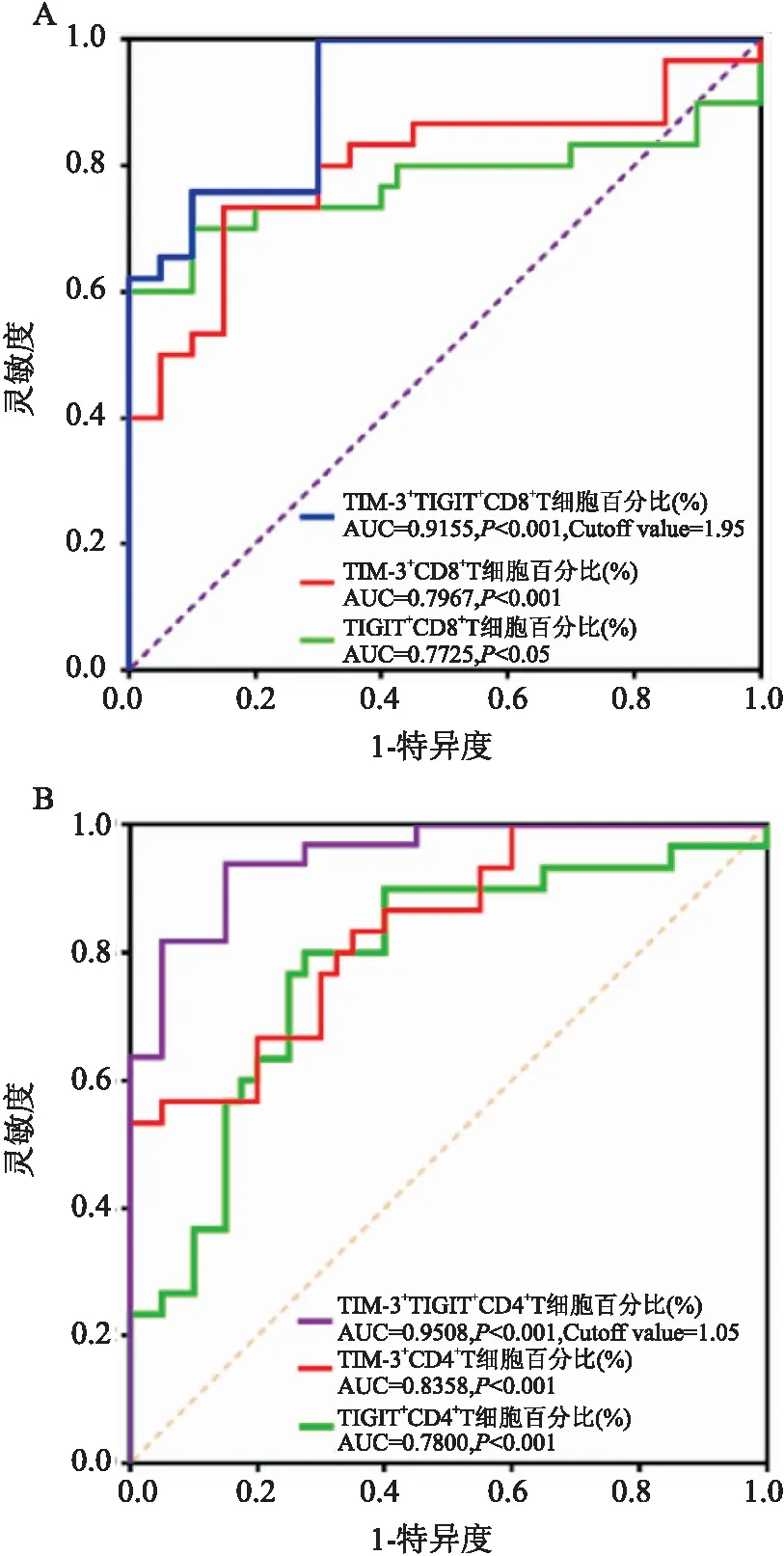
图3 HCC患者外周血中CD8+ T细胞与 CD4+ T细胞高表达抑制性受体的ROC曲线分析
2.5 比较HCC患者及健康对照者外周血IL-10
CD4
T细胞表达的百分比及血清IL-10含量
HCC患者组外周血IL-10CD4T细胞在患者外周血中表达比例明显高于健康对照组,差异有统计学意义(P
<0.001,t
=4.579),见图4A。此外,该实验检测患者组血清IL-10含量也高于健康对照组,差异有统计学意义(P
<0.05,t
=2.046),见图4B。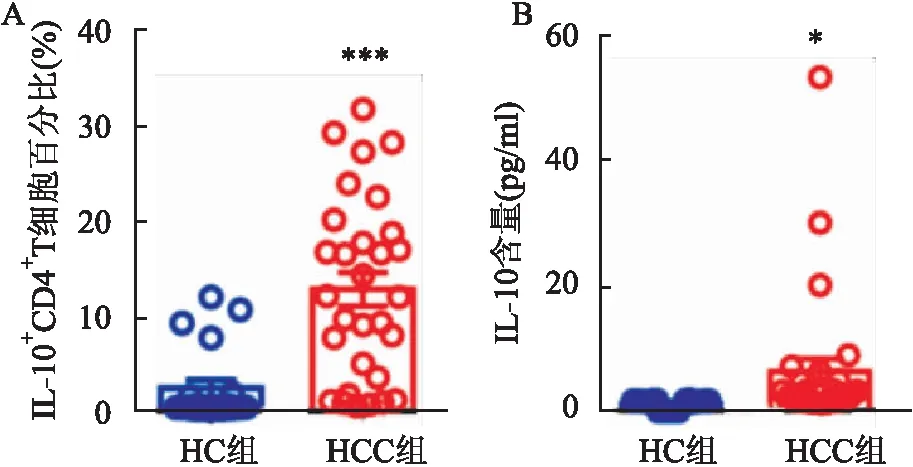
图4 HCC 患者及健康对照者外周血IL-10+ CD4+ T细胞的百分比及血清IL-10含量检测
2.6 TIM-3
TIGIT
CD8
T细胞、TIM-3
TIGIT
CD4
T细胞比例高低两组HCC患者中性粒细胞/淋巴细胞比值(NLR)的比较
依据HCC中TIM-3TIGITCD8T细胞比例cutoff value=1.95%,将HCC患者分为高TIM-3TIGITCD8T细胞比例组和低TIM-3TIGITCD8T细胞比例组,比较两组患者NLR,高TIM-3TIGITCD8T细胞比例组NLR结果高于低TIM-3TIGITCD8T细胞比例组,差异有统计学意义(P
<0.05,t
=2.593),见图5A。同时,依据HCC中TIM-3TIGITCD4T细胞比例cutoff value=1.05%,将HCC患者分为高TIM-3TIGITCD4T细胞比例组和低TIM-3TIGITCD4T细胞比例组,比较两组患者NLR,研究结果表明高TIM-3TIGITCD4T细胞比例组NLR结果高于低TIM-3TIGITCD4T细胞比例组,差异有统计学意义(P
<0.05,t
=2.054),见图5B。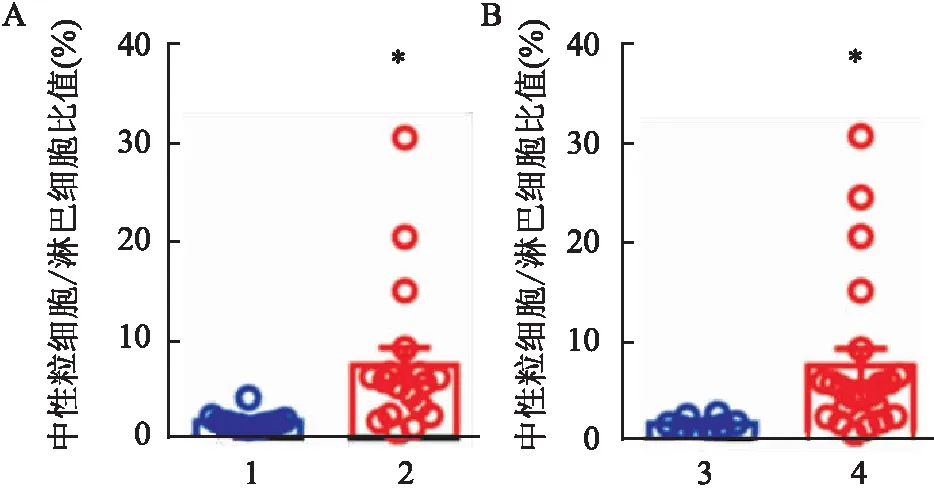
图5 比较TIM-3+ TIGIT+ CD8+ T细胞比例高低两组以及TIM-3+ TIGIT+ CD4+ T细胞比例高低两组HCC患者NLR
3 讨论
淋巴细胞免疫耗竭现象普遍存在于肿瘤及慢性感染中,其不利于免疫系统对肿瘤细胞杀伤以及病毒感染的清除。在肿瘤及慢性感染中,T细胞及NK细胞逐渐失去效应功能,并且普遍高表达抑制性受体。已有研究表明免疫细胞表达多种共刺激、共抑制性受体和其相应的配体相结合后,通过对细胞的刺激信号促进细胞活化,或抑制信号削弱免疫细胞的功能,抑制抗肿瘤反应,通过阻碍肿瘤清除来促进癌症免疫逃逸。免疫耗竭的细胞会出现多种抑制性受体持续高表达,抑制性受体在慢性病毒感染和肿瘤微环境中发挥其作用,如: PD-1、TIM-3、CTLA-4、LAG-3及 TIGIT等。TIGIT属于脊髓灰质炎病毒受体家族,在淋巴细胞表达,在效应和调节性CD4T细胞、滤泡辅助CD4T细胞、效应CD8T细胞和NK细胞中高表达。该研究TIGIT在HCC患者外周血中CD4T细胞、CD8T细胞表达比例均高于健康对照组,提示TIGIT与T细胞耗竭有关,阻断TIGIT可防止T细胞衰竭并促进T细胞依赖性肿瘤免疫。Zhou et al研究表明从HCC组织分离的CD8和CD4T细胞上的TIM3、LAG3和CTLA4的表达明显高于无肿瘤组织或外周血。该研究表明HCC患者组外周血中TIM-3在CD4T细胞、CD8T细胞的表达比例也均高于健康对照组。
TIM-3TIGITCD8T细胞和TIM-3TIGITCD4T细胞在HCC患者外周血中的表达比例上调,这与Liu et al报道的结果相似,该研究进一步表明PD-1在HCC患者组外周血TIM-3TIGITCD8T细胞和TIM-3TIGITCD4T细胞两组中高表达,同时HCC的ROC效能分析显示TIM-3TIGITCD8T细胞、TIM-3TIGITCD4T细胞比例曲线下面积均高于单一抑制性受体,可见,相较于单一抑制性受体,两种抑制性受体共表达的水平对HCC的诊断更具有价值,此外,该研究表明HCC患者组外周血PD-1CD4T细胞、PD-1CD8T细胞比例高于健康对照组;PD-1与HCC的发生及演进有关,外周淋巴细胞PD-1的表达可作为HCC监测的分子标志;提示免疫细胞衰竭的程度与抑制性受体在细胞上的表达有关,2个或2个以上抑制性受体的共同表达比单一抑制性受体的高表达更能代表免疫细胞衰竭的状态。
病毒慢性感染和肿瘤发生时,抑炎因子IL-10 通过促进T细胞耗竭与维持病毒长期存活发挥重要作用。有研究报道IL-10在HCC组织中的表达增加,因为Th1类细胞因子在机体抗肿瘤免疫中发挥非常重要的作用,而IL-10升高抑制了Th1细胞功能,所以IL-10升高能够促进HCC的发生发展。该研究显示HCC患者组外周血中IL-10CD4T细胞比例高于健康对照组,此外,患者组血清IL-10 含量也高于健康对照组,进一步证实IL-10在HCC免疫逃逸中起重要作用。
有研究表明NLR可以反映促进肿瘤的炎症反应和抗肿瘤的炎症反应之间的平衡,NLR水平与HCC患者的预后有一定的相关性,NLR值越高,预后越差。该研究结果显示高值组NLR均高于低值组,提示TIM-3TIGITCD8T细胞、TIM-3TIGITCD4T细胞与HCC疾病进展加快和不良预后有关,这可能不仅对预后具有重要的临床意义,而且还为免疫治疗中的新靶点提供了理论依据。
综上所述,免疫耗竭现象普遍存在于肿瘤微环境中,HCC患者外周血中普遍高表达抑制性受体,同时存在几种抑制性受体共表达。而且,相较于单一抑制性受体,两种抑制性受体共表达水平对HCC的诊断更具有价值,高TIM-3TIGITCD4T细胞表达及TIM-3TIGITCD8T细胞表达与HCC疾病进展加快和不良预后有关。针对于单分子靶向治疗较低反应率、双分子或多分子靶向治疗可能会具有更大的临床意义。该研究通过分析HCC患者外周血中T细胞表面高表达抑制性受体及其相关性研究可能为临床治疗提供了更多、更新颖的靶点,可能在肿瘤患者的免疫检查点阻断治疗中发挥作用。

