肺癌患者肌少症发生率及其影响因素分析
祖 爽,郝 丽,蒋建华,管石侠,侯丽丽,程 靖,杨 乐,李会贤,吴寒寒,张 宝
肺癌发病率和病死率在全球范围内迅速增长,肺癌是中国因癌症死亡的主要原因。因肿瘤本身消耗及放化疗等治疗手段影响,肺癌患者营养不良的发生率高达30%~60%。营养不良多表现为体质量下降、体脂肪量降低、骨骼肌肌量及肌力异常,严重影响患者生活质量、预后及存活率,而骨骼肌肌量减少是肌少症最突出的临床表现。肌少症是指随年龄增长进行性出现骨骼肌肌量减少、肌肉强度下降及肌肉生理功能异常的综合征。近年来,肌少症相关性研究受到普遍重视,现有研究指出合并肌少症的呼吸系统疾病患者疾病转归差,病死率高。然而目前针对肺癌患者合并肌少症的研究较少,因此,该研究选取该院78例肺癌患者行人体成分测量,旨在探讨肺癌患者肌少症的发生率及其影响因素,以期为改善肺癌患者预后提供依据。
1 材料与方法
1.1 病例资料
选取安徽医科大学第一附属医院2019年8月—2020年7月在呼吸与危重症科经组织病理或影像学明确诊断为肺癌患者78例,年龄为45~79(63.37±9.09)岁。选取同期健康管理中心78例体检人群作为对照组,年龄为44~84(63.04±9.10)岁。排除标准:① 肺癌患者合并其他恶性肿瘤者,体检人群合并恶性肿瘤者;② 合并肌无力者;③ 合并严重水肿、胸水及腹水者;④ 合并行动、认知功能障碍者。所有研究对象均已获得知情同意。1.2 临床及实验室资料
记录所有研究对象一般资料:性别、年龄、身高及体质量。记录肺癌患者临床资料及实验室指标:确诊时间、TNM分期、治疗手段、血红蛋白、白蛋白、前白蛋白及空腹血糖。1.3 人体成分检测
所有研究对象在空腹、排空大小便后,采用直接节段多频率生物电阻抗测试法(ASM-BIA法,韩国Inbody720人体成分分析仪)行人体成分检测,包括:体质指数(body mass index,BMI)、蛋白质、去脂体质量(fat free mass,FFM)、肌肉量(soft lean mass,SLM)、四肢骨骼肌量(appendicular skeletal muscle mass,ASM)、体脂肪(body fat mass,BFM)、体脂百分比(percent body fat,PBF)、内脏脂肪面积(visceral fat area,VFA)。1.4 肌少症判断标准及BMI分组
肌少症定义为生物电阻抗法测得四肢骨骼肌质量指数(appendicular skeletal muscle mass index,ASMI)男性<7.0 kg/m,女性<5.7 kg/m。肺癌组患者根据BMI分为3组:消瘦组(BMI<18.5 kg/m),正常组(18.5 kg/m≤BMI<23.9 kg/m),超重/肥胖组(BMI≥24 kg/m)。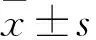
2 结果
2.1 肺癌组与对照组肌少症发生率及各指标比较
两组间在性别组成、年龄、身高、体质量、BMI、BFM、PBF水平差异无统计学意义。肺癌组肌少症发生率、VFA高于对照组(均P
<0.001),平均蛋白质、FFM、SLM、ASM及ASMI水平低于对照组(均P
<0.05)。见表1。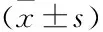
表1 肺癌组与对照组肌少症发生率及各指标比较
2.2 78例肺癌患者肌少症组与非肌少症组各指标比较
两组间在肺癌确诊时间、TNM分期、肺癌治疗手段差异无统计学意义。见表2。两组间在性别组成、年龄、身高、PBF、VFA、血红蛋白、白蛋白、前白蛋白及空腹血糖水平差异无统计学意义。肌少症组肺癌患者平均体质量、BMI、蛋白质、FFM、SLM、ASM、ASMI及BFM水平低于非肌少症组肺癌患者(均P
<0.05)。见表3。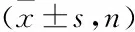
表2 78例肺癌患者肌少症组与非肌少症组临床指标比较
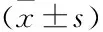
表3 78例肺癌患者肌少症组与非肌少症组人体成分及实验室指标比较
2.3 78例肺癌患者不同BMI分组肌少症发生率比较
78例肺癌患者不同BMI分组间肌少症的发生率差异有统计学意义(χ=13.569,P
=0.001)。消瘦组、正常组、超重/肥胖组肌少症的发生率分别为100%、62.5%、33.3%。见表4。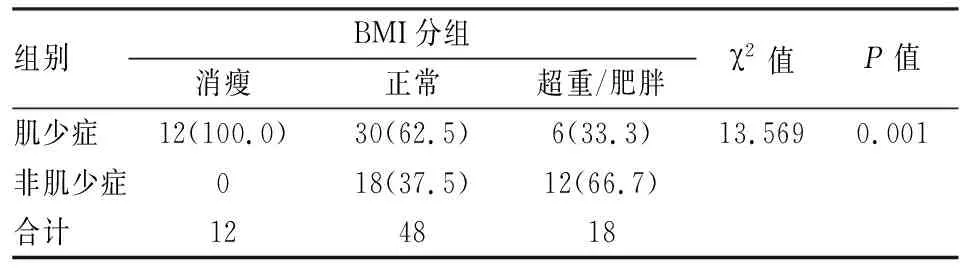
表4 78例肺癌患者不同BMI分组肌少症发生率比较[n(%)]
2.4 156例研究对象ASMI与其他指标Pearson相关性分析
对156例研究对象行Pearson相关性分析,结果显示ASMI与身高、体质量、BMI、蛋白质、FFM、SLM及ASM呈正相关(均P
<0.001),与年龄、PBF呈负相关(均P
<0.05)。见表5。
表5 156例研究对象ASMI与其他指标Pearson相关性分析
2.5 二分类Logistic回归分析肺癌患者并发肌少症的影响因素
以肺癌患者是否并发肌少症为因变量(0=未发生肌少症,1=发生肌少症),以单因素Logistic回归中P
<0.05的变量为备选自变量,选取定量变量体质量、BMI、蛋白质、ASM、BFM为自变量(原值代入)进入回归方程,结果显示高BMI(OR
=-1.997,95%CI
:0.046~0.400,P
<0.001)、高ASM(OR
=-2.696,95%CI
:0.012~0.389,P
=0.003)是肺癌患者并发肌少症的保护因素。见表6。
表6 二分类Logistic回归分析肺癌患者并发肌少症的影响因素
3 讨论
近年来,随着恶性肿瘤发病率及病死率的升高,肿瘤相关性肌少症开始引起广泛注意。有研究表明肌少症与肺癌患者肺功能低下、抗肿瘤治疗中的毒性作用以及生存率降低相关,然而目前国内针对肺癌与肌少症的相关性研究并不多见。国外有研究通过计算机断层扫描图像对41例非小细胞肺癌患者进行测量,结果显示肺癌患者肌少症的发生率为61%,其中BMI<25 kg/m组肌少症发生率为62%,BMI≥25 kg/m组肌少症发生率为55%。该研究中,肺癌患者肌少症发生率高达61.5%,高于体检人群肌少症的发生率(17.9%),且肺癌患者较体检者有着更低水平的蛋白质、FFM、ASM和更高水平的VFA。不同BMI分组结果显示消瘦组肺癌患者肌少症发生率为100%,远远高于正常组(62.5%)及超重/肥胖组患者(33.3%)。
低水平BMI代表肿瘤患者存在严重的营养不良风险,而Collins et al研究指出在肿瘤患者出现营养不良症状之前,肌肉质量和肌力已经开始出现下降。该研究中肺癌组消瘦患者占比为15.4%(12/78),远低于肌少症的发生率为61.5%(48/78)。目前有研究显示骨骼肌减少是评价营养状态较为灵敏及特异的指标,故欧洲姑息治疗研究协作组建议将肌少症与体质量降低、BMI下降同时作为恶病质诊断的一项标准。
骨骼肌作为反映营养不良的重要指标,是恶性肿瘤患者重要的生存预测因子。肺癌患者由于进食减少、身体活动下降、放化疗措施或靶向药物对肌肉的直接影响可导致肌少症的发生。化疗药物如顺铂、阿霉素、依托泊苷等通过激活转录因子NF kappa B可直接引起肌肉损失。肺癌细胞分泌TNF-α加速蛋白质丢失、增加胰岛素抵抗、破坏肌肉生成,并导致肌肉力量下降。增加蛋白质摄入及抗阻运动是肌少症的主要干预方式。增加蛋白质摄入不仅可以促进肌肉蛋白质合成,且呈剂量依赖关系。因此,建议每日摄入蛋白质1.2~1.6 g /(kg·d),并补充缺乏的能量和维生素,可以预防与年龄相关的肌少症。机体缺乏活动与肌肉力量和质量的丧失有关,因此,运动疗法被认为是治疗肌少症的基础。短期抗阻运动是预防和治疗骨骼肌减少的有效干预措施,运动对肌肉系统有积极影响,可以改善骨骼肌的代谢能力,增强其对氨基酸摄取和蛋白质合成,促使蛋白质合成/分解代谢向合成代谢转变。该研究表明肺癌合并肌少症患者体质量、BMI及蛋白质量低于无肌少症肺癌患者,且ASMI与BMI、蛋白质呈正相关,回归分析结果显示高BMI、高ASM是肺癌患者并发肌少症的保护因素,这提示补充适当能量、摄入足够蛋白质维持肺癌患者合适的BMI,增加运动以保持高ASM是减少肺癌患者发生肌少症的有效手段。
该研究尚存在一些不足之处。有研究显示随着年龄增长肌肉量出现不可逆的下降,年龄是肌少症发生的独立危险因素。从20岁至80岁,个体肌肉质量将减少30%,肌肉活检提示I型肌肉纤维数量明显减少,且肌肉毛细血管与肌纤维比例显著下降。该研究中ASMI与年龄存在负相关关系,但在回归分析中,年龄并未进入回归方程,分析可能的原因为肺癌组患者年龄集中在60岁左右,且该研究肺癌患者样本例数偏少。

