lncRNA PWAR5通过靶向miR-30a-5p/SOCS3分子轴降低心肌炎心肌细胞的损伤
卢英红,迟伟峰,谭玉婷,王春筱,纪文岩,吴 赛
心肌炎是指心肌受累导致心肌细胞病变的炎症性疾病,由多种病因如免疫损伤、细菌感染、病毒感染等引起。心肌炎可引起心律失常,导致心脏收缩和舒张功能障碍。心肌炎临床表现为胸闷、心悸、心律不齐甚至心力衰竭等症状,严重者可导致患者心源性猝死。心肌炎的病理过程尚不完全明确,临床治疗主要是对症治疗。长链非编码RNA(long non-coding RNA,lncRNA)是一类大于200个核苷酸的内源性非编码RNA,广泛存在于细胞质或细胞核中。lncRNA在转录水平、转录后水平以表观遗传的方式调控基因的表达,影响细胞分化、增殖、凋亡等功能。研究表明,lncRNA的异常表达与各种心脏疾病的发生和发展相关。近年来PWAR5是lncRNA研究的热点,其在甲状腺癌、胶质瘤中发挥的抑癌基因作用。PWAR5在心脏疾病特别是心肌炎中的功能及作用机制尚不明确。该研究旨在观察PWAR5在脂多糖诱导心肌炎时对大鼠原代心肌细胞的保护作用及可能的分子机制。
1 材料与方法
1.1 主要材料
空载慢病毒(含绿色荧光蛋白GFP)、载有PWAR5序列的慢病毒(含绿色荧光蛋白GFP)、miR-30a-5p、miR-NC、PWAR5荧光报告载体(野生型WT和突变型MT)购自上海碧云天生物科技有限公司。用于解离原代心肌细胞的3 d新生SD大鼠购自上海杰思捷实验动物有限公司。293T细胞购自中国典型培养物保藏中心。MTS试剂盒、ELISA试剂盒和Annexin V-FITC细胞凋亡检测试剂盒购自武汉博士德生物工程有限公司。qRT-PCR试剂盒购自日本Takara公司。转染试剂Lipofectamine3000购自美国Invitrogen公司。DMEM培养基、胎牛血清购自美国Gibco公司。双荧光素酶报告基因检测试剂盒购自北京威格拉斯生物技术有限公司。胶原酶Ⅰ购自美国Sigma公司。一抗和二抗购自美国BD公司。1.2 细胞解离、培养及分组
采用胶原酶Ⅰ将大鼠心脏组织解离成单细胞悬液,在37 ℃、5% CO条件下,采用含20%胎牛血清的DMEM培养基培养。分别载有PWAR5序列的慢病毒和空载慢病毒,定义为PWAR5组和Control组,24 h后在荧光显微镜下拍照。每组分别滴加100 μl脂多糖(浓度为10 μmol/L),孵育24 h进行后续实验。1.3 qRT-PCR检测PWAR5、miR-30a-5p和SOCS3 mRNA的表达
每组细胞加入TRIzol提取总RNA,逆转录为cDNA后,配制qRT-PCR反应体系。PWAR5和SOCS3 mRNA的相对表达以α-Tubulin为内参,miR-30a-5p的相对表达以U6为内参。引物序列如下,miR-30a-5p正向引物:ACACTCCAGCTGGGTGTAAACATCCTCGAC,反向引物:CAGTGCGTGTCGTGGAGT;U6正向引物:CGCGCTTCGGCAGCACATATACT,反向引物:ACGCTTCACGAATTTGCGTGTC。α-Tubulin正向引物:CCAAGCTGGAGTTCTCTA,反向引物:CAATCAGAGTGCTCCAGG;PWAR5正向引物:TGATGTGGGTGTTGATAC,反向引物:ACTCAAAGGCAAGAACTA;SOCS3正向引物:CCTGCGCCTCAAGACCTTC,反向引物:GTCACTGCGCTCCAGTAGAA。反应参数:95 ℃预变性6 min,95 ℃变性30 s,60 ℃退火25 s,72 ℃延伸25 s,40个循环,采用2法计算PWAR5、miR-30a-5p和SOCS3 mRNA的相对表达。1.4 MTS法检测大鼠原代心肌细胞活力
将脂多糖处理的大鼠原代心肌细胞接种于96孔板,每孔2×10个细胞。24 h后,避光条件下加20 μl/孔 MTS溶液,培养箱内培养3 h。通过酶标仪检测每孔在450 nm波长处的吸光度(A)值,代表各组大鼠原代心肌细胞的活力。1.5 ELISA法检测上清液中白细胞介素(interleukin,IL)-1β和肿瘤坏死因子(tumor necrosis factors,TNF)-α的含量
收集脂多糖处理后的各组细胞上清液,按照ELISA试剂盒说明书操作,通过酶标仪检测每孔在450 nm波长处的吸光度(A)值,比较各组上清液中IL-1β和TNF-α的含量。1.6 流式细胞术检测细胞凋亡比例
消化、离心收集脂多糖处理后的大鼠原代心肌细胞,采用缓冲液进行重悬。每组取100 μl细胞悬液至流式管,分别加Annexin V-FITC溶液和PI溶液各5 μl,充分混匀后在冰箱内静置20 min。上机前,每管加100 μl缓冲液,采用流式细胞仪检测每组细胞的凋亡比例。1.7 生物信息学方法预测和双荧光素酶报告基因实验验证PWAR5的靶基因
采用starBase V 3.0(http://starbase.sysu.edu.cn/)预测PWAR5结合的微小(miRNA)。将PWAR5-WT和PWAR5-MT荧光报告载体分别与miR-NC或miR-30a-5p共转染293T细胞,48 h后通过双荧光素酶报告基因检测试剂盒检测萤火虫萤光素酶活性和海参萤光素酶活性,相对萤光素酶活性=萤火虫萤光素酶活性值/海参萤光素酶活性值。1.8 Western blot法检测SOCS3蛋白及凋亡相关蛋白表达
胰酶消化各组大鼠原代心肌细胞,细胞裂解液裂解细胞,离心提取总蛋白。加入上样缓冲液,100 ℃水浴8 min,进行十二烷基聚丙烯酰胺凝胶电泳,转膜至硝酸纤维素膜。采用5%脱脂牛奶封闭3 h,与一抗在4 ℃冰箱孵育过夜。加入二抗孵育3 h,滴加ECL化学发光试剂,通过凝胶成像系统观察蛋白条带。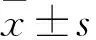
2 结果
2.1 两组大鼠原代心肌细胞中PWAR5的相对表达水平
荧光显微镜显示,Control组和PWAR5组大鼠原代心肌细胞均表达绿色荧光蛋白,表明细胞慢病毒感染成功。见图1。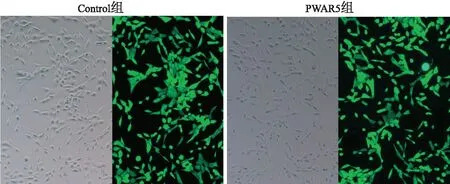
图1 Control组和PWAR5组大鼠原代心肌细胞绿色荧光蛋白表达 ×100
qRT-PCR结果显示,Control组和PWAR5组大鼠原代心肌细胞中PWAR5相对表达分别为(1.03 ± 0.15)和(9.71 ± 1.20),PWAR5组PWAR5相对表达高于Control组(t
=7.199,P
<0.01)。见图2。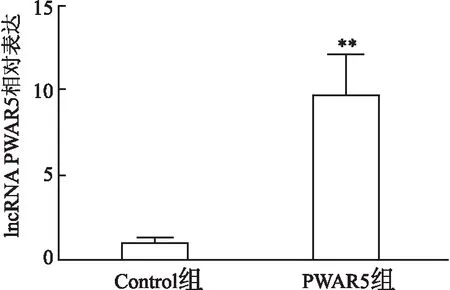
图2 Control组和PWAR5组大鼠原代心肌细胞中PWAR5的相对表达与Control组比较:**P<0.01
2.2 高表达PWAR5对大鼠原代心肌细胞活力的影响
MTS法结果显示,脂多糖处理后的Control组和PWAR5组大鼠原代心肌细胞活力分别为(1.02 ± 0.10)和(5.35 ± 0.48),与Control组相比,PWAR5组大鼠原代心肌细胞的活力增加(t
=8.795,P
<0.01)。2.3 高表达PWAR5对上清液IL-1β和TNF-α含量的影响
ELISA法结果显示,脂多糖处理后的Control组和PWAR5组上清液中IL-1β含量分别为(25.13 ± 2.03)pg/ml和(10.28 ± 1.68)pg/ml,差异有统计学意义(t
=5.631,P
<0.01);Control组和PWAR5组上清液中TNF-α含量分别为(32.26 ± 3.71)pg/ml和(14.26 ± 1.95)pg/ml,差异有统计学意义(t
=4.297,P
<0.01);与Control组相比,PWAR5组上清液中IL-1β和TNF-α含量均下降。2.4 高表达PWAR5对大鼠原代心肌细胞凋亡比例的影响
流式细胞术显示(图3),脂多糖处理24 h后,PWAR5组和Control组大鼠原代心肌细胞凋亡比例分别为(12.61 ± 2.05)%和(29.25 ± 2.46)%,与Control组相比,高表达PWAR5抑制大鼠原代心肌细胞的凋亡,差异有统计学意义(t
=5.191,P
<0.01)。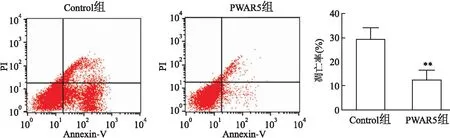
图3 流式细胞术检测PWAR5对大鼠原代心肌细胞凋亡比例的影响与Control组比较:**P<0.01
2.5 生物信息学方法预测PWAR5的靶基因
采用生物信息学软件starBase V 3.0预测PWAR5可靶向结合miR-30a-5p。见图4。
图4 生物信息学方法预测PWAR5的靶基因
2.6 PWAR5与miR-30a-5p的靶向关系
双荧光素酶报告基因检测结果显示,PWAR5-WT/miR-NC组、PWAR5-WT/miR-30a-5p组、PWAR5-MT/miR-NC组和PWAR5-MT/miR-30a-5p组的相对荧光素酶活性分别为(1.03 ± 0.12)、(0.33 ± 0.05)、(0.96 ± 0.04)和(0.99 ± 0.10),PWAR5-WT/miR-30a-5p组较PWAR5-WT/miR-NC组降低(t
=5.350,P
<0.01)。结果显示PWAR5与miR-30a-5p之间可靶向结合。见图5。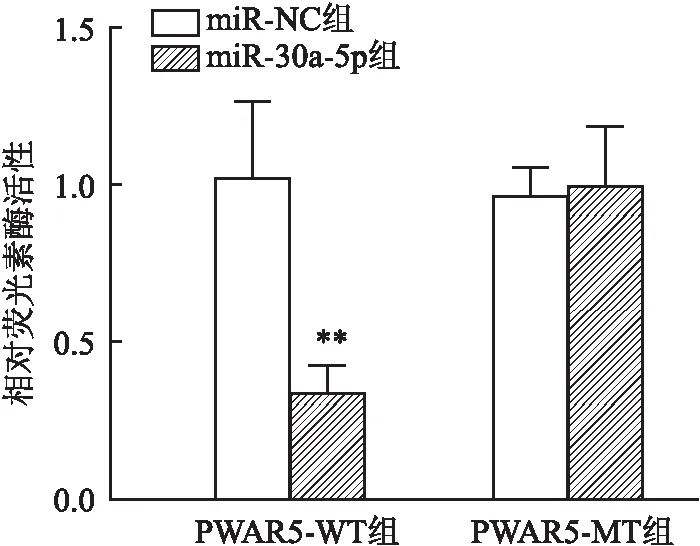
图5 双荧光素酶报告基因实验验证PWAR5与miR-30a-5p的靶向关系与miR-NC组比较:**P<0.01
2.7 高表达PWAR5对大鼠原代心肌细胞中miR-30a-5p和SOCS3 mRNA表达的影响
qRT-PCR结果显示,PWAR5组和Control组大鼠原代心肌细胞miR-30a-5p的表达分别为(0.29 ± 0.05)和(1.02 ± 0.12),高表达PWAR5可抑制miR-30a-5p的表达(t
=5.80,P
<0.01)。PWAR5组和Control组大鼠原代心肌细胞SOCS3 mRNA的表达分别为(5.82 ± 0.79)和(1.05 ± 0.08),高表达PWAR5可促进SOCS3 mRNA的表达(t
=6.081,P
<0.01)。2.8 高表达PWAR5对SOCS3蛋白和凋亡相关蛋白表达的影响
Western blot结果显示,与Control组相比,PWAR5组大鼠原代心肌细胞中SOCS3蛋白的表达增加,抗凋亡蛋白Bcl-2表达上升,促凋亡蛋白Bax、Caspase-3表达降低。见图6。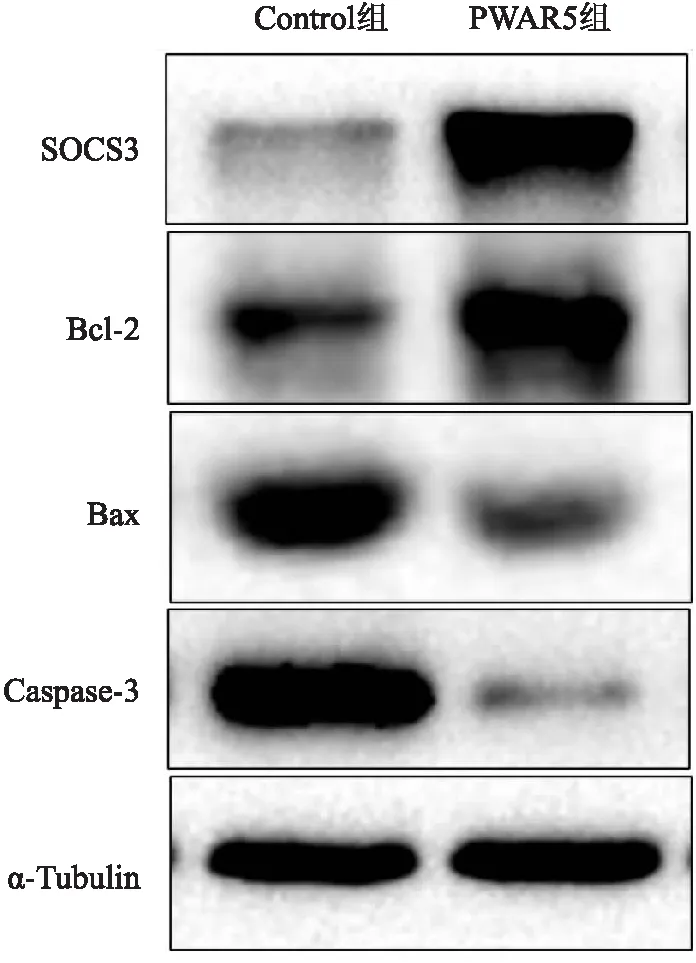
图6 Western blot法检测SOCS3蛋白和凋亡相关蛋白的表达
3 讨论
心肌炎诱发炎性渗出,导致心肌细胞的耗氧量增加,心肌细胞的活力下降,心肌细胞凋亡比例增加。心肌炎的发病机制复杂,组织病理学及免疫组织化学是目前心肌炎的主要诊断方式。寻找新的分子靶点对心肌炎的诊断、治疗及预后具有重要临床意义。lncRNA广泛参与调控各种心血管疾病的发生、发展。Cao et al报道,lncRNA HIF1A-AS1在柯萨奇病毒B3诱导的心肌炎中表达上升,下调lncRNA HIF1A-AS1表达可有效抑制心肌细胞的凋亡,miR-138是lncRNA HIF1A-AS1的靶基因。Zhang et al报道,lncRNA ROR通过影响C-Myc蛋白的表达,促进病毒性心肌炎大鼠心肌的纤维化。研究表明,PWAR5在胶质瘤、甲状腺癌中发挥抑癌基因作用,可抑制肿瘤的增殖和进展,与肿瘤患者的预后密切相关。PWAR5对心肌炎时心肌细胞的作用及分子机制并不明确。
该研究结果显示,脂多糖处理后,过表达PWAR5可抑制炎症因子IL-1β、TNF-α的渗出,降低炎症反应。同时,PWAR5可增强大鼠原代心肌细胞的活力,抑制心肌细胞的凋亡,降低心肌细胞的损伤。lncRNA发挥作用的主要方式是“海绵作用”,即互补结合miRNA,降低miRNA对其下游靶基因的干扰作用,从而上调miRNA下游靶基因的表达。该研究通过starBase V 3.0预测显示,PWAR5可能互补结合的miRNA是miR-30a-5p。双荧光素酶报告基因检测进一步表明,PWAR5可互补结合miR-30a-5p。研究显示,急性病毒性心肌炎患者血清外泌体中miR-30a-5p的含量增加,miR-30a-5p通过靶向干扰细胞因子信号传导抑制因子3(suppressor of cytokine signaling 3,SOCS3)促进心肌炎症反应的发生,诱导心肌细胞的不可逆损伤。SOCS3基因位于染色体17q25.3,SOCS3蛋白在细胞因子信号通路中发挥负反馈调控作用,可抑制心肌炎的进展。该研究结果显示,上调PWAR5表达后,大鼠原代心肌细胞中miR-30a-5p表达下降,SOCS3 mRNA表达增加,表明PWAR5可通过靶向结合miR-30a-5p上调SOCS3 mRNA的表达。Western blot检测进一步显示,与Control组相比,高表达PWAR5后,SOCS3、Bcl-2蛋白表达上调,Bax、Caspase-3蛋白表达下调,表明PWAR5可抑制大鼠原代心肌细胞的凋亡。
综上所述,PWAR5可有效降低脂多糖诱导的炎症反应,增强大鼠原代心肌细胞的活力并抑制其凋亡,其分子机制是PWAR5通过靶向结合miR-30a-5p上调SOCS3基因的表达。该研究表明PWAR5在心肌炎心肌细胞中发挥保护作用,可能为心肌炎的靶向治疗提供了新的思路。

