等离子体激活液对血管瘤内皮细胞增殖与凋亡作用及相关机制
张晨晨,杨兴宇,高 静,王俪昀,赵 军,夏传开,吕永梅,杨春俊
婴儿血管瘤(infantile hemangioma,IH)是婴儿常见的良性肿瘤,由胚胎期血管组织增生形成的,以血管内皮细胞异常增生为特点,发生于皮肤及软组织的良性肿瘤。常用的治疗方法有冷冻、激光、口服普萘洛尔、局部注射抗细胞增生性药物等,但是这些疗效并不满意,且存在严重不良反应,寻找新的安全高效的治疗手段仍是IH治疗中需要解决的问题。
等离子体是除固体、液体和气体外物质的第4种状态,是由气体在高电压环境下被离子化后产生的包含分子、原子、离子、电子、光子和活性物质等组成的一种混合存在形式。低温等离子体(cold atmospheric plasma, CAP)因其温度接近正常人体温度,有效杀灭病原微生物、促进伤口愈合和抑制体内外癌细胞而受到越来越多的关注。尤其是等离子体激活液(plasma-activated solution, PAS)可以选择性抑制癌细胞增生,使得人们对PAS未来应用于恶性肿瘤的治疗充满了期待。该研究探讨PAS对体外培养的血管瘤内皮细胞(hemangioma endothelial cells, HemECs)的抑制效应及机制。
1 材料与方法
1.1 主要材料
HemECs细胞(上海青旗公司)。磷酸盐缓冲液(PBS)、高糖DMEM 培养基(美国Hyclone公司),胎牛血清(澳大利亚Gibco公司),AKT抗体、PI3K抗体、p-AKT抗体、p-PI3K抗体、辣根过氧化物酶标记的羊抗兔IgG(美国Affinity公司),NO试剂盒、O试剂盒、HO试剂盒(德国MERCK公司),胰蛋白酶、CCK-8试剂盒、细胞内活性氧(reactive oxygen species, ROS)检测试剂盒、BCA蛋白浓度测定试剂盒(上海碧云天生物技术有限公司),Annexin V-FITC/PI双染细胞凋亡检测试剂盒(上海贝博公司)。流式细胞仪(美国BD Biosciences公司),荧光酶标仪(美国Molecular Devices公司)。1.2 HemECs细胞培养
将HemECs细胞置于含有10%胎牛血清的高糖DMEM培养基中,在含有5% CO、温度为37 ℃的细胞培养箱中培养。细胞长至70%~80%时传代,用0.25%胰蛋白酶消化,按1 ∶3的比例传代。1.3 PAS的制备
该研究中使用的DBD等离子体发生装置由中国科学院等离子体物理研究所开发和设计。该DBD装置主要包括3部分:交流电源,面式正极和接地负极。吸取4.0 ml PBS于小培养皿(ø 35 mm)中,水平放置在正负极中间。调整正极高度,距液面5 mm。开启DBD装置电源,调整输入电压电流参数(45.0 V,2.0 A),进行辐照处理,同时使用计时器记录暴露时间。使用CAP设备对PBS分别进行 10、20、30、40、50 s的处理。等离子体活化液的剂量定义为在相同的放电参数下不同的处理时间。将制备好的活化溶液放入冰水浴或在4 ℃存放。1.4 PAS中pH值及ROS和活性氮(reactive nitrogen species, RNS)物质浓度的测定
1
.4
.1
pH值 取制备好的PAS溶液2 ml置于试管中,将校准好的电子pH计探针完全浸入液面以下,静置10 min后,待屏幕读数稳定后读取并记录。重复3次取均值。1
.4
.2
NO浓度 按照说明书,从NO检测试剂盒中,取4.0 ml的1号液放入试管中。然后吸取0.50 ml制备好的PAS加入试管中,不混匀。再吸取试剂盒中的2号液0.50 ml加入试管中,混匀。混匀后静置10 min,取混合液于检测管中,于分光光度计中检测,读取结果并记录。重复3次取均值。1
.4
.3
HO浓度 按照说明书,从HO检测试剂盒中取0.50 ml的1号液加入试管中,然后吸取8.0 ml制备好的PAS加入试管中,混匀。再加入2号液0.50 ml,混匀后静置10 min。取混合液于检测管中,于分光光度计中检测,读取结果并记录。重复3次取均值。1
.4
.4
O浓度 按照说明书,取10 ml制备好的PAS加入试管中,向试管中加入2滴O检测试剂盒的1号液,混匀。加入2号粉末试剂1勺(试剂盒自带小勺)。摇匀后静置3 min。取混合液于检测管中,于分光光度计中检测,读取结果并记录。重复3次取均值。1.5 CCK-8法检测细胞增殖能力
将HemECs细胞以每孔8 000个细胞的密度接种于96孔微量培养板中,并在含有10% FBS的高糖DMEM培养基中培养至贴壁,PAS处理HemECs细胞1 h后,弃去PAS。加入培养基继续培养24 h后,每孔中加入10 μl的CCK-8试剂,1 h后分光光度计在450 nm处测定吸光度(optical density, OD)值。1.6 流式细胞术检测细胞凋亡
将HemECs细胞接种于6孔板中,培养至贴壁,PAS孵育1 h。弃去PAS,替换新鲜培养基继续培养24 h。收集细胞用于染色。将细胞悬浮在Annexin V结合液中。随后,加入5 μl Annexin V-FITC染色液,混匀后避光孵育15 min,然后加入10 μl PI染色液,28 ℃避光孵育5 min。流式细胞仪上机检测,使用FlowJo-V10软件用于数据的分析及作图。1.7 DCFH-DA荧光标记细胞内ROS水平
将处于对数生长期的HemECs细胞接种在96孔培养板上,每孔10 000个细胞,培养至贴壁。将细胞装载荧光探针DCFH-DA,PAS孵育1 h后,荧光酶标仪在激发波长为488 nm和发射波长为525 nm下检测荧光,计算细胞内ROS水平。1.8 蛋白免疫印迹法检测凋亡蛋白
收集细胞,加入RIPA裂解液提取细胞中的蛋白,BCA试剂盒检测提取的蛋白浓度。选择8%分离胶和5%浓缩胶进行电泳,蛋白转移至PVDF膜上,5%脱脂奶粉中室温封闭1.5 h后,TBST溶液洗膜,与AKT(1 ∶1 000)、PI3K(1 ∶1 000)、p-Akt(1 ∶1 000)和p-PI3K(1 ∶1 000)单克隆抗体4 ℃孵育过夜,辣根过氧化物酶标记的山羊抗兔IgG溶液(1 ∶5 000)室温孵育60 min,底物化学发光法显影。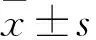
2 结果
2.1 PBS在DBD的作用下pH值以及主要活性物质的变化
CAP分别处理PBS 10、20、30、40、50 s后,与对照组相比,PAS的pH值呈下降趋势,具有剂量依赖性,差异均有统计学意义(F
=29.79,P
<0.05)。在实验选择的处理时间内,pH值均在6以上,见图1。随着DBD处理时间的增加,PBS中NO、HO和O这3种主要活性物质浓度均呈剂量依赖性上升,差异均有统计学意义(F
=130.7、153.4、26.77,P
<0.05),其中,当DBD处理时间为50 s时,溶液中NO、HO和O的浓度最高,分别为(12.13±0.40)、(13.50±1.21)、(0.21±0.02)mg/L。见图2~4。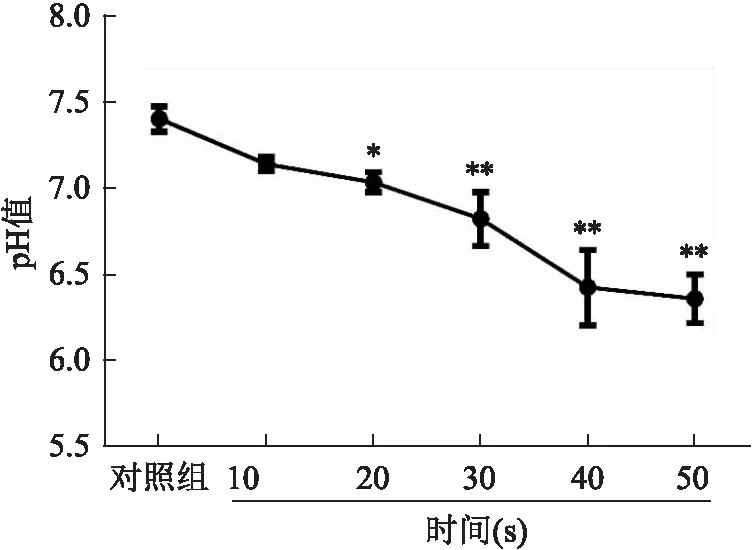
图1 PAS中pH值的变化
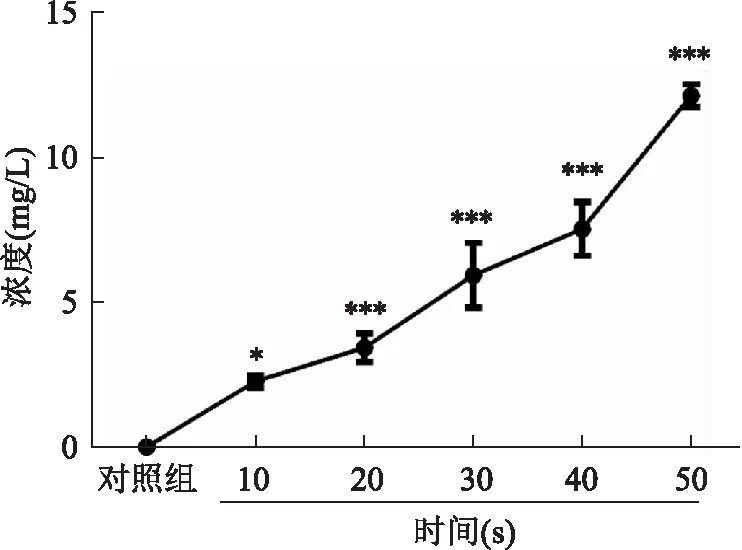
图2 PAS中NO3-的浓度变化
图3 PAS中H2O2的浓度变化
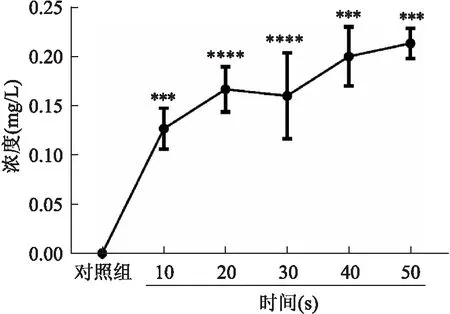
图4 PAS中O3的浓度变化
2.2 PAS抑制HemECs细胞增殖
CCK-8法检测结果显示,与对照组相比,不同DBD处理时间的PAS溶液对HemECs细胞均具有一定细胞毒性作用。CAP处理10 s时HemECs细胞的抑制率仅为(92.08±0.15)%,CAP处理50 s时HemECs细胞的抑制率为(50.10±0.04)%。随着CAP处理时间的增加,对HemECs细胞增殖的抑制作用逐渐增强,并且具有剂量依赖性,差异均有统计学意义(F
=25.41,P
<0.05)。见图5。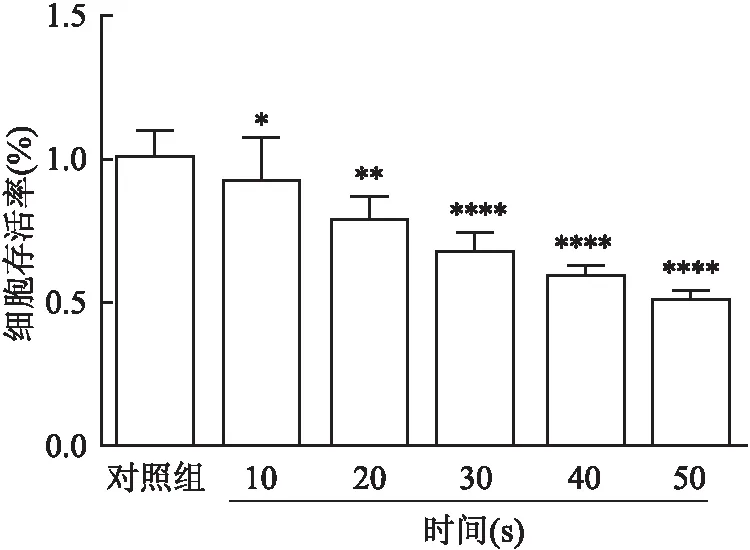
图5 PAS对HemECs细胞增殖的影响
2.3 PAS促进HemECs细胞凋亡
流式细胞仪分析每组细胞凋亡率,结果显示,DBD处理时间为10、20、30、40、50 s的PAS对HemECs细胞的凋亡率分别为(9.28±2.75)%、(28.79±6.88)%、(64.67±10.44)%、(72.53±4.69)%和(86.93±3.23)%,而对照组凋亡率为(4.56±2.52)%。与对照组相比,CAP处理时间为10 s时,对HemECs细胞有促进凋亡作用,但差异无统计学意义(P
=0.911 2);其余实验组对HemECs细胞均具有促进凋亡的作用,且具有剂量依赖性,差异有统计学意义(P
<0.05)。见图6。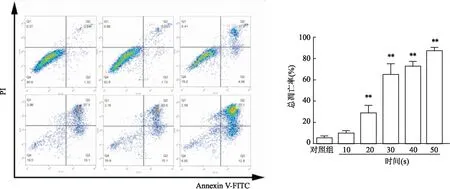
图6 PAS对HemECs细胞总凋亡率的影响
2.4 PAS以剂量依赖的方式升高细胞内ROS水平
与对照组相比,不同DBD处理时间的PAS均能提升HemECs细胞中ROS水平,且具有剂量依赖性。CAP处理10 s时HemECs细胞的ROS相对表达水平变化不大,仅为(136.9±1.3)%(P
=0.76);CAP处理时间从20 s提升至50 s时,HemECs细胞中ROS相对表达水平提升明显,差异有统计学意义(P
<0.05)。见图7。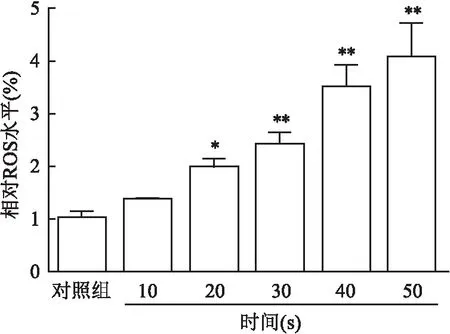
图7 PAS对HemECs细胞中相对ROS水平影响
2.5 PAS对HemECs细胞中PI3K/AKT通路的影响
Western blot结果显示,与对照组相比,CAP处理10 s时,HemECs细胞中AKT的磷酸化水平变化不明显,处理时间增加至20、30、40、50 s后,AKT的磷酸化水平迅速降低;另一方面,PI3K的磷酸化水平变化则不显著。见图8。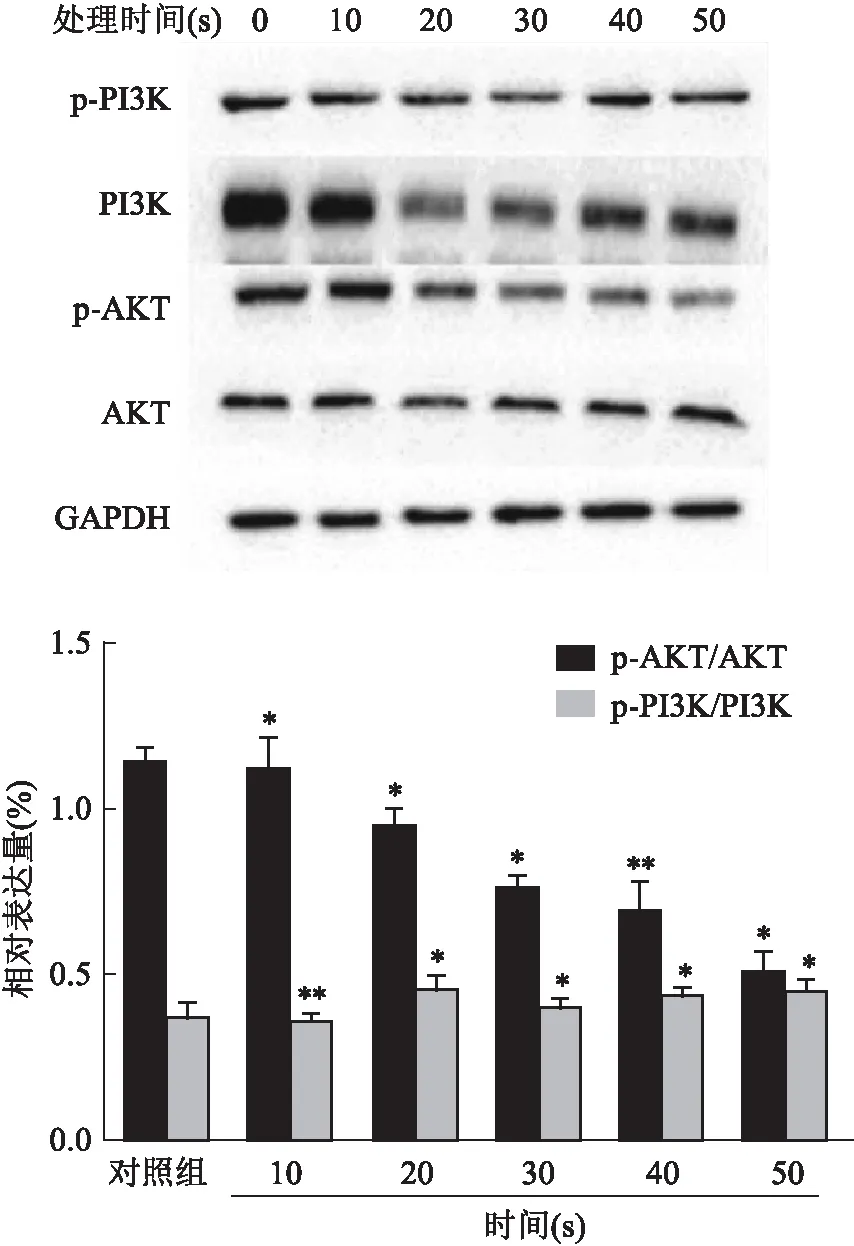
图8 PAS处理后HemECs细胞中AKT、p-AKT、PI3K和p-PI3K的相对表达量
3 讨论
近年来由于CAP强大的抑制恶性肿瘤细胞增殖能力而受到广泛重视,已经在体外对包括骨肉瘤、胰腺癌和恶性黑素瘤等多种肿瘤细胞进行了研究,均提示有良好的抑制效果。该团队早期对皮肤基底细胞癌和鳞状细胞癌进行了直接CAP和PAS的体外处理,也显示出良好的抑制效应。增殖期血管瘤内皮细胞与肿瘤细胞有类似的生物学活性,因此,猜测PAS对增殖期血管瘤内皮细胞具有同样的抑制效果。
该研究选择PBS作为底物,采用DBD装置处理PBS获得不同处理时间的PAS作为不同的剂量,在体外进行HemECs细胞作用研究。结果提示PBS中的pH值随着CAP处理时间的增加不断下降,50 s时,pH值下降至6左右,而此时的pH值仍然是可接受的变化。随着CAP处理时间的增加,溶液中NO、HO和O活性介质的浓度也在提高,对细胞的抑制作用也在增强,这可能与溶液中ROS和RNS的浓度有关。有研究表明,等离子体激活的长寿命活性物质HO、NO和NO等是发挥抑制效应的主要物质,可以破坏细胞膜和线粒体等。ROS是正常生理条件下重要的细胞内次级信使,但在病理条件下,当细胞内ROS积累过多或细胞内ROS清除系统受损,可能导致氧化或硝化应激以及细胞成分的损伤,包括核酸、膜脂和蛋白质,继而可影响各种生理和病理过程,包括代谢、炎症、细胞信号转导、免疫、转录调控和凋亡。
磷酯酰肌醇-3激酶/蛋白激酶B(PI3K/AKT)信号通路在细胞生长、发育、凋亡等生理过程中起重要的调节作用。该信号通路中,P13K激活的结果是在质膜上产生第二信使3,4,5-三磷酸磷脂酰肌醇(PIP3),当PI3K被磷酸化激活后,其合成的PIP3与细胞中AKT和磷酸肌醇依赖性蛋白激酶-1 (PDK1) 结合,促使 PDK1磷酸化 AKT蛋白的Ser308导致AKT活化。研究显示激活的PI3K磷酸化AKT,p-AKT移动到胞质及胞核,结合其下游靶蛋白Bad、Caspase9、NF-κB、Bcl-2和mTOR等,调控炎症细胞活化和炎症介质释放,故p-AKT可作为PI3K/AKT信号通路活化的标志物。
该研究在体外采用PAS处理HemECs细胞,以观察PAS对HemECs细胞增殖及凋亡水平的作用。结果显示,CAP辐照时间10、20、30、40、50 s的PBS处理HemECs细胞,与对照组相比,PAS可显著抑制HemECs细胞的增殖,也能显著促进其凋亡,且具有剂量依赖性。并且,这种作用效果与细胞内ROS水平的上升具有相关性。初步对PI3K/AKT信号通路在CAP影响HemECs细胞增殖和凋亡中的作用研究表明,CAP处理10 s以上的激活液可以显著抑制HemECs细胞的磷酸化AKT水平,但对PI3K的磷酸化水平没有明显抑制作用。因此,CAP来源的活性氧类物质通过直接影响细胞内ROS水平,下调AKT磷酸化的表达,进一步表现出对HemECs细胞的增殖抑制及促进凋亡的效果。
综上所述,该研究从细胞和蛋白水平上表明了CAP激活液对HemECs细胞的增殖具有抑制作用,并通过细胞内ROS下调p-AKT表达促进凋亡,为今后婴儿血管瘤的靶向治疗研究提供了方向。

