调控ABCG2对胃癌细胞迁移的机制研究
于 超,王亦高,杨 天,徐 龙,张 震
ATP结合盒转运蛋白亚家族G2(ABCG2)是编码人类肿瘤多药耐药的ABC运输超家族成员之一,ABCG2蛋白最初是在乳腺癌耐药细胞系中发现的,故又称为乳腺癌耐药蛋白,ABCG2自发现以来,一直是研究的热点,最新研究表明ABCG2蛋白与多种肿瘤包括胃癌的耐药性相关。研究表明ABCG2的表达上调可以使药物外排增加导致细胞耐药。尽管Wang et al研究表明,在多发性骨髓瘤中,PI3K/Akt信号通路可以调控ABCG2活性,但具体机制不明。PI3K/Akt信号通路在促进癌细胞的生长、增殖、迁移等周期方面具有重要作用,也对细胞多药耐药产生影响。人类表皮生长因子2(HER2)作为转录调控的重要因子,在信号转导中扮演重要角色,调节细胞的增殖、分化、侵袭和转移等功能。前期研究表明干扰胃癌细胞HER2表达后,可以增加胃癌对一线化疗药物奥沙利铂的敏感性,干扰HER2后, PI3K、Akt和ABCG2表达下降。该研究旨在探讨是否存在HER2-PI3K/Akt-ABCG2信号通路,调节ABCG2的表达,对胃癌细胞产生影响,进而为下一步对胃癌细胞的耐药机制的研究提供参考。
1 材料与方法
1
.1 病例资料
收集该院普外科八病区2018年1月—2019年12月行胃癌根治手术并经免疫组化病理证实HER2阳性及未在术前使用化疗药物的组织样本84例。从医院病历系统检索临床资料,回顾性分析,所有患者都经过电话随访,均知情同意,且该研究已经通过医院伦理委员会的许可。1
.2 主要试剂
人胃癌细胞株NCI-N87和MKN-7细胞(武汉普诺赛公司),胎牛血清(美国Gibco公司),RPMI 1640培养基(美国HyClone公司),慢病毒(上海吉玛公司),ABCG2抗体(美国Abcam公司),PV6000免疫组化试剂盒、DAB染色试剂盒(北京中杉金桥公司),TRIzol试剂(美国Invitrogen公司),PCR逆转录试剂盒(大连Takara公司)。1
.3 主要仪器
无菌细胞操作台(苏州安泰公司),细胞培养箱、低温离心机、酶标仪1510(美国Thermo Scientific公司),低速离心机(湖南湘仪公司),电泳仪(北京六一仪器厂),倒置、正置荧光显微镜(型号:DM3000B、DM4000,德国Leica公司),全自动数码凝胶成像系统(型号:ChemiQ4600,上海欧翔公司)。1
.4 方法
1
.4
.1
免疫组织化学 石蜡包埋标本4 μm连续切片,具体步骤根据试剂盒说明操作。显微镜下观察HER2阳性胃癌组织中ABCG2蛋白表达情况。1
.4
.2
细胞培养 NCI-N87和MKN-7细胞用含15%的胎牛血清、100 U/ml青霉素链霉素的RPMI 1640培养基于37 ℃、5% CO培养箱中培养。在细胞生长约80%融合度时,进行相关实验。1
.4
.3
慢病毒设计包装 根据人ABCG2基因编码序列,遵循设计原则,设计过表达和干扰慢病毒及相关阴性对照。1
.4
.4
细胞转染及免疫荧光测定 选取对数生长期的NCI-N87和MKN-7细胞,胰酶消化,分别种于6孔板中,贴壁后参照慢病毒包装手册进行操作,以感染复数(MOI)等于10的指数转染6孔板中细胞,培养24 h后,加入2 μl终浓度为5 μg/ml的 polybrene筛选1~2周,37 ℃培养,8~12 h根据细胞状态换液1次。转染72~96 h后,通过GFP荧光计数法在荧光显微镜下观察GFP荧光的表达强度和时间来确定转染情况。将转染成功各组细胞转移至细胞瓶中继续培养,得到稳定的细胞。细胞分组为:未处理的细胞组为Cell组;过表达阴性对照组为LV5NC组;过表达组为LV5-homo组;干扰阴性对照组为LV3NC组,3种干扰组为LV3-609组、LV3-1158组、LV3-1988组。1
.4
.5
RT-PCR检测ABCG2的表达情况 按试剂盒说明提取转染后各组细胞的总RNA,将RNA逆转录成cDNA。设计引物序列,将含有扩增序列的cDNA为模板进行PCR反应。反应结束后记录各组结果,以GAPDH作为内参,比较分析各组ABCG2的表达,见表1。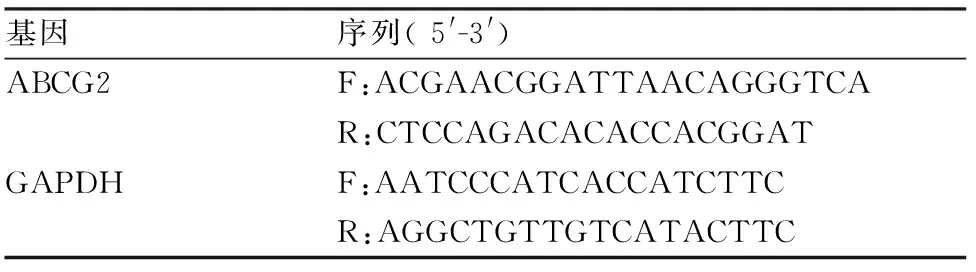
表1 引物序列
1
.4
.6
Western blot法检测蛋白表达 上述方法分组处理好的细胞,细胞裂解液冰上裂解转染好的NCI-N87和MKN-7细胞,细胞刮刮取细胞,提取细胞总蛋白,Bradford蛋白浓度测定。依次选用12%的浓缩胶和分离胶分离蛋白,转膜,封闭,一抗摇床孵育过夜,TBST清洗,相应二抗摇床孵育2 h,TBST和TBS洗膜,ECL发光显色对蛋白进行显色处理,分析结果。1
.4
.7
细胞划痕实验检测胃癌细胞迁移能力 通过划痕实验来评价ABCG2对细胞迁移的影响。将NCI-N87细胞和MKN-7细胞胰酶消化平铺于6孔板中,加入完全培养基,培养至80%~90%状态。用100 μl无菌枪头在孔板细胞中央划痕(划痕呈十字型),再用PBS洗去悬浮细胞,加入5% FBS完全培养基。划痕后分别于0、24、48、72 h,在相同位置用倒置显微镜拍照,评价细胞迁移速度。
2 结果
2.1 免疫组化检测胃癌细胞中ABCG2的表达情况
通过对临床标本免疫组化检测表明,在HER2阳性的84例病理标本中,ABCG2阳性表达有60例(棕色),主要在细胞质中表达。2.2 ABCG2的表达与胃癌临床病理特征的关系
收集HER2阳性的84例临床患者的病理结果,经χ检验ABCG2表达与患者临床病理特征的关系,结果显示,ABCG2阳性与年龄性别不相关,差异无统计学意义;ABCG2在胃癌组织中的差异表达与分化程度、淋巴结转移数和TNM分期存在相关性,差异有统计学意义,见表2。
表2 ABCG2表达与胃癌患者临床病理特征的关系[n(%)]
2
.3 细胞转染效率
经荧光显微镜观察慢病毒转染的NCI-N87细胞(图1)和MKN-7细胞(图2)内可见绿色荧光。各组慢病毒转染后转染效率均达80%以上,后以嘌呤霉素筛选稳定转染单克隆细胞系。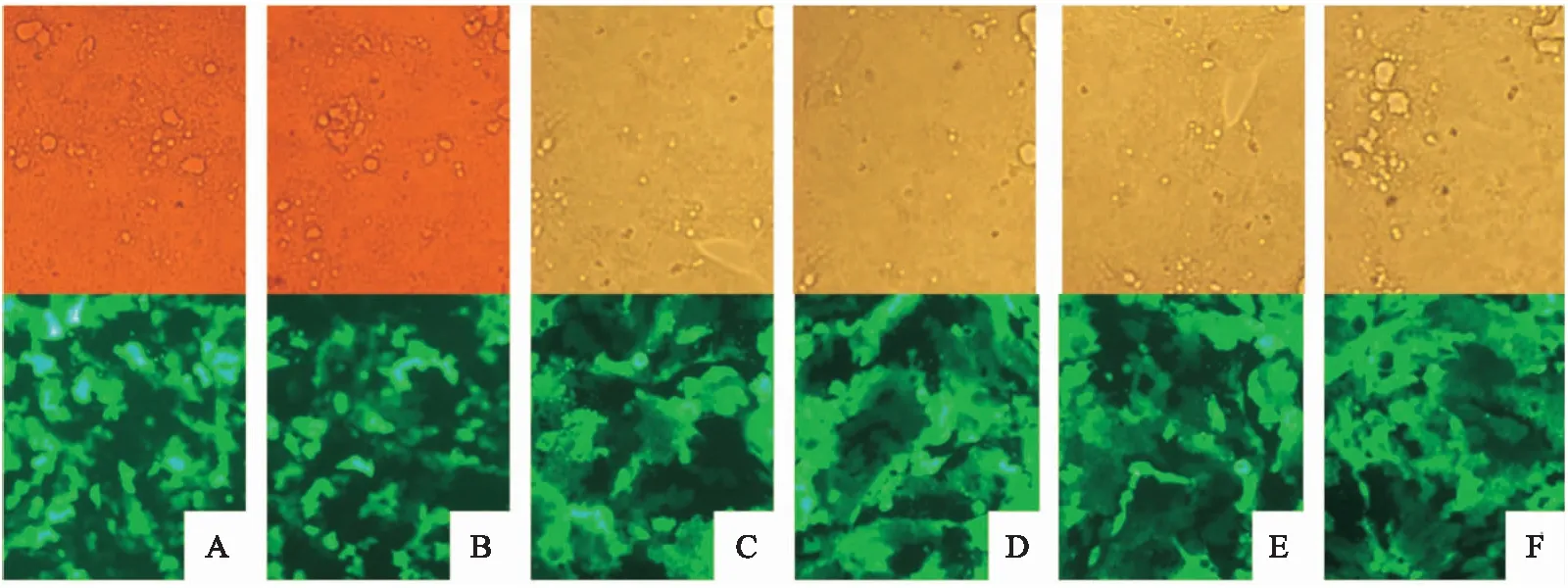
图1 荧光显微镜观察NCI-N87细胞各组转染效果 ×100A: LV5NC组; B: LV5- homo组; C: LV3NC组; D: LV3- 609组; E: LV3- 1158组; F: LV3- 1988组
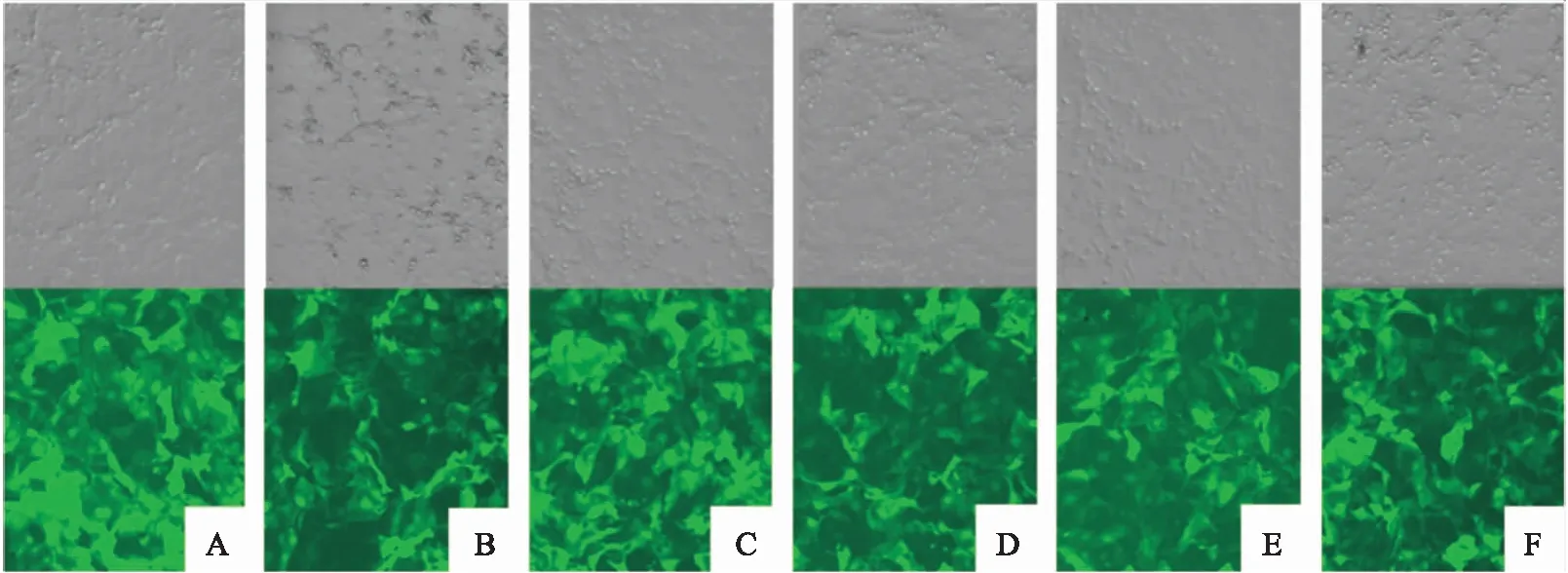
图2 荧光显微镜观察MKN-7细胞各组转染效果 ×100A: LV5NC组; B: LV5- homo组; C: LV3NC组; D: LV3- 609组; E: LV3- 1158组; F: LV3- 1988组
2.4 RT-PCR检测稳定细胞株中ABCG2的表达情况
该研究采用RT-PCR实验观察慢病毒转染后的胃癌NCI-N87和MKN-7细胞株中ABCG2 mRNA表达水平变化情况,结果显示:LV5-homo组ABCG2 mRNA表达水平明显提高,差异有统计学意义(F
=64.390、142.812,P
<0.01);LV3-609、LV3-1158、LV3-1988干扰组中ABCG2 mRNA表达水平明显降低,差异有统计学意义(F
=130.916、58.467,P
<0.05),其中LV3-1988干扰效果最明显(P
<0.01),效率最高,见图3、4。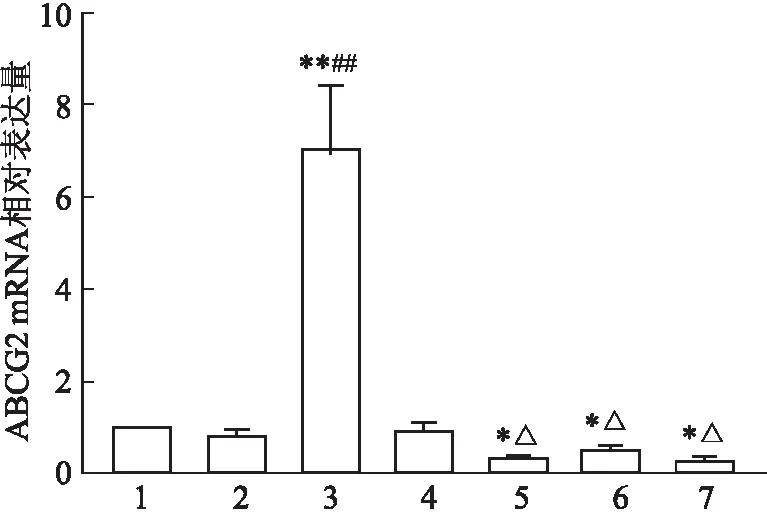
图3 NCI-N87细胞转染后ABCG2 mRNA的表达量
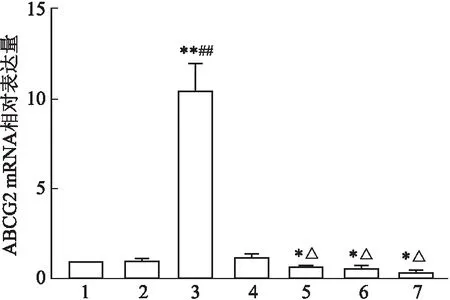
图4 MKN-7细胞转染后ABCG2 mRNA的表达量
2.5 Western blot检测ABCG2蛋白的表达情况
该研究采用Western blot实验观察慢病毒转染后的胃癌NCI-N87和MKN-7细胞株中ABCG2蛋白表达水平变化情况,结果显示:LV5-homo组中ABCG2蛋白表达明显增高,差异有统计学意义(F
=137.137、164.394;P
<0.01); LV3-609、LV3-1158、LV3-1988干扰组中ABCG2蛋白表达明显降低,差异有统计学意义(F
=122.657、555.982;P
<0.01),其中LV3-1988组干扰效率最高,见图5、6。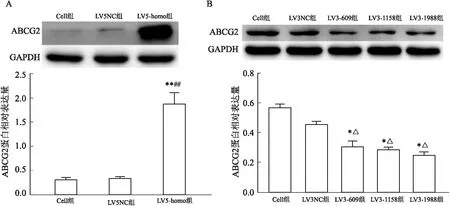
图5 Western blot检测人胃癌NCI-N87细胞转染后ABCG2蛋白表达
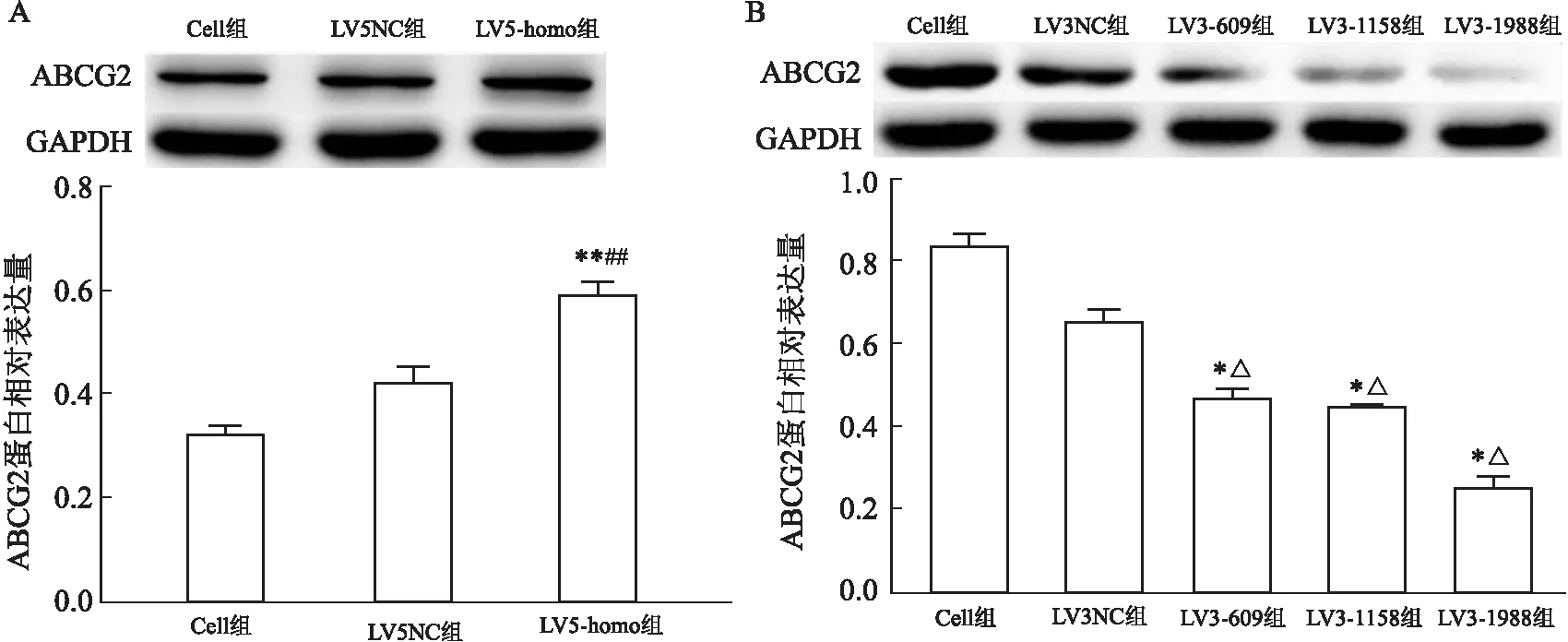
图6 Western blot检测人胃癌MKN-7细胞转染后ABCG2蛋白表达
2.6 调控ABCG2对HER2-PI3K/Akt信号通路的影响
该研究采用Western blot实验观察慢病毒转染后的胃癌NCI-N87和MKN-7细胞株中的HER2和PI3K/Akt信号通路中关键蛋白表达水平的变化情况。结果显示:LV5-homo组中HER2、PI3K和P-Akt蛋白表达明显增高,差异有统计学意义(F
=144.618、351.626、284.821,P
<0.05);LV3-1988组中HER2、PI3K和P-Akt蛋白表达明显降低,差异有统计学意义(F
=426.022、153.050、339.490,P
<0.05),见图7、8。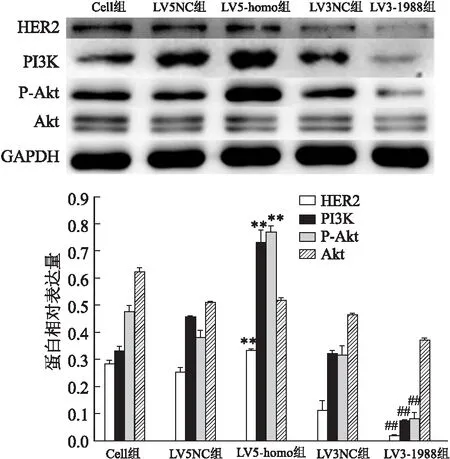
图7 Western blot检测人胃癌NCI-N87细胞转染后通路蛋白表达
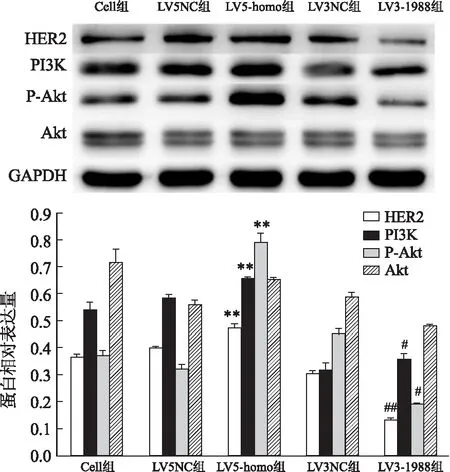
图8 Western blot检测人胃癌MKN-7细胞转染后通路蛋白表达
2.7 调控ABCG2对细胞迁移能力的影响
该研究经划痕实验对慢病毒转染胃癌细胞株后调控ABCG2表达水平对胃癌细胞的迁移能力的影响,结果显示:LV5-homo组在培养24、48和72 h后迁移能力明显增强,与LV5NC组、Cell组和LV3-1988组的差异有统计学意义[F
=(2.
649vs
42.
402)、(2.
938vs
56.217)、(33.420vs
29.
886),P
<0.05],表明增强ABCG2基因的表达后,能明显促进胃癌细胞的迁移,见图9、10和表3、4。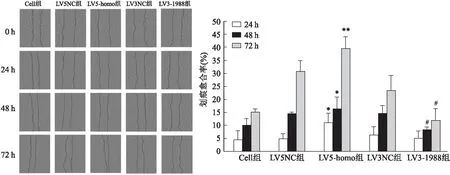
图9 ABCG2表达对胃癌NCI-N87细胞迁移的影响 ×100与Cell组、LV5NC组和LV3-1988组比较:*P<0.05、**P<0.01;与Cell组和LV3NC组比较:#P<0.05
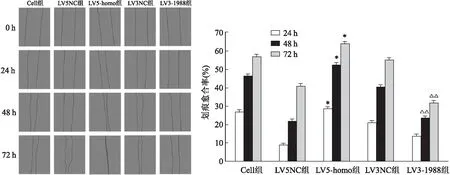
图10 ABCG2表达对胃癌MKN-7细胞迁移的影响 ×100与Cell组、LV5NC组和LV3-1988组比较:*P<0.05;与Cell组、LV3NC组和LV5-homo组比较:△△P<0.01
表3 NCI-N87各组细胞迁移距离的比较
表4 MKN-7各组细胞迁移距离的比较
3 讨论
胃癌是世界上常见的恶性肿瘤之一。根据全国肿瘤登记中心发布的《2015中国肿瘤登记年报》显示,胃癌发病率与病死率居所有癌症前三。胃癌的治疗方案是以手术为主,结合放化疗的综合治疗。许多患者虽然接受了胃癌根治性切除术和规范的术后治疗,但仍出现肿瘤耐药和复发转移。
ABCG2是一种结合盒式运输机,其主要通过水解ATP产生运输功能。典型的ABCG2由两个高度保守的 ATP 绑定域和两个跨膜域组成,并能识别多种抗癌药物,其自身也是生物体内自我保护机制的重要组成部分。有研究表明,在多种类型的细胞中,ABCG2对细胞自噬产生重要作用,在表达ABCG2的细胞中,观察到更高的自噬率。研究表明通过下调ABCG2基因的表达,有抑制胃癌细胞增殖的作用,同时也存在防止凋亡的作用。
该研究表明在HER2阳性的胃癌细胞中ABCG2高表达,ABCG2与胃癌的分化程度、淋巴结转移和TNM分期呈正相关。课题组前期发现HER2可以间接调控ABCG2,产生耐药作用。为了明确ABCG2对胃癌的影响,该研究通过慢病毒转染胃癌NCI-N87和MKN-7细胞,调控ABCG2以探究对胃癌细胞的影响。通过转染后PCR和Western blot检测验证转染是成功的,细胞划痕实验表明调控ABCG2基因表达后,在ABCG2过表达的胃癌细胞中迁移明显增快,结果显示ABCG2参与调控胃癌细胞的迁移活动。另外PI3K/Akt信号通路可以调控ABCG2活性,而干扰HER2后,PI3K、P-Akt和ABCG2表达下降,所以该研究进一步通过Western blot分析HER2和PI3K/Akt通路蛋白表达情况,结果显示ABCG2与HER2、PI3K、Akt和P-Akt呈现正反馈联系。综上所述,ABCG2可能对胃癌细胞迁移、分化程度、淋巴结转移和TNM分期等产生重要作用,且通过向上调节PI3K/Akt通路,在HER2阳性的胃癌细胞中产生重要影响,这可能作为胃癌耐药机制研究的一个新思路。

