WDR12对GC-1细胞增殖凋亡及核糖体蛋白基因表达的影响
郭 兰,华 娟
据报道,全球约15%的夫妇患有不孕不育,其中男性因素约占30%~55%。精子发生是一系列基因参与的复杂生物学过程。该课题组前期研究表明,WDR12基因突变与1例近亲婚配家系锥形头部畸形精子症的男性患者有关。WDR12 是WD重复蛋白家族的成员,内源性WDR12 在细胞的多个生物学过程中发挥作用,例如细胞分裂和增殖、细胞周期调控和核糖体生物发生。核糖体是细胞内合成蛋白质的重要细胞器,目前,已经有研究报道核糖体在精子发生过程中发挥重要作用。该研究利用shWDR12敲低小鼠精原细胞GC-1中WDR12的表达,观察WDR12对精原细胞增殖、凋亡及核糖体相关蛋白基因表达的影响。
1 材料与方法
1.1 材料
1
.1
.1
细胞株 小鼠精原细胞GC-1受赠于安徽医科大学组胚教研室。1
.1
.2
Q-
PCR引物序列 应用于Q-PCR的相关引物序列(上游序列以F表示,下游序列以R表示),见表1。
表1 Q-PCR引物序列
1
.1
.3
试剂与抗体 DMEM高糖培养液(C11995500BT)购自美国Gibco公司,胎牛血清(04-001-1A)购自以色列BI公司,青霉素和链霉素(ST488)、吐温-20(ST825)、SDS-PAGE蛋白上样缓冲液(P0015)、预染蛋白质分子量标准(P0078)、丽春红染色液(P0022)均购自上海碧云天生物技术有限公司,胰酶细胞消化液(BL512A)、Puromycin(BS080A)、CCK-8试剂盒(BS350B)均购自上海桥星贸易有限公司(Biosharp),TRIzol试剂(15596026)、Lipofectamine 3000转染试剂(L3000015)购自美国Thermo Fisher Scientific公司,RIPA组织/细胞裂解液(R0020)、PMSF(P8340)均购自北京Solarbio公司,异丙醇(80109218)、甲醇(10014118)、甲醛(10010018)、无水乙醇(13015069)、三氯甲烷(10006818)、二甲苯(10023418)等购自中国医药集团有限公司,TUNEL试剂盒(A112)购自南京诺唯赞生物科技股份有限公司,逆转录试剂盒(E047-01A)、SYBR Green qPCR SuperMix试剂盒(E168-01B)购自北京安诺伦生物科技有限公司(novoprotein)。shWDR12质粒购自上海吉凯基因公司。WDR12多克隆抗体(PA5-57635)购自美国Thermo Fisher Scientific公司。β-actin抗体(AF7018)和山羊抗兔IgG(H+L)HRP二抗(S0001)购自美国Affity公司。1.2 方法
1
.2
.1
细胞培养 GC-1细胞培养条件为:10%胎牛血清(FBS)+ 1%青霉素-链霉素双抗+ 高糖DMEM培养基,日常培养在恒温37 ℃、5% CO浓度的细胞培养箱中。1
.2
.2
细胞转染 转染前1 d将5×10~5×10个GC-1细胞均匀接种到6孔板中,使细胞密度在转染时达到60%~80%。转染前30 min取出细胞孔板,用37 ℃预热的PBS洗2遍,加入2 ml无血清的DMEM 饥饿;EP管1:125 μl DMEM+3.75 μl Lipofectamine 3000,指腹轻弹混匀;EP管2:125 μl DMEM+2.5 μg DNA+5 μl P3000,指腹轻弹混匀;各自静置5min,将管1的体系完全加入管2内混匀后室温静置15~20 min,多位置轻轻滴加到饥饿的细胞中,在桌面上交叉晃动孔板使转染液均匀分布;转染6 h后更换为完全DMEM培养基,48 h后开始添加已经确定好的嘌呤霉素浓度(1 μg/ml)进行筛选,4~6 d后收取细胞进行相关检测。将稳定转染的干扰组和对照组GC-1细胞分别命名为shWDR12组和NC组。1
.2
.3
蛋白提取与Western blot实验 6孔板每孔加入160 μl新鲜配制的蛋白裂解液(1 ml RIPA裂解液+10 μl PMSF),冰上充分裂解30 min。按比例加入40 μl 5×蛋白上样缓冲液混匀,100 ℃煮沸10 min,分装放于-20 ℃冰箱保存。按说明书配制SDS-PAGE凝胶(下层12%的分离胶,上层5%的浓缩胶),上样完成后,先80 V恒压电泳40 min,再120 V恒压1.5 h;转膜到硝酸纤维素膜(NC膜)上进行电转(冰上150 mA恒流转膜2.5 h);5%脱脂奶粉封闭1 h后TBST洗3次;NC膜于湿盒中室温孵育一抗(WDR12与β-actin均1 ∶1 000稀释)1 h后4 ℃过夜,TBST洗3次;湿盒中二抗(1 ∶5 000稀释)室温孵育1 h后洗3次;化学发光成像设备进行显影后保存图片。1
.2
.4
RNA提取、逆转录及Q-
PCR实验 RNA提取:6孔板每孔加入1 ml TRIzol试剂,冰上放置5 min后转移到无酶EP管内,每管加入200 μl三氯甲烷(TRIzol ∶三氯甲烷=5 ∶1),剧烈混匀15 s;冰上静置 2~3 min,4 ℃ 、12 000 r/min离心15 min;将上层无色透明水相转移至新的无酶EP管;加入500 μl异丙醇(与吸出的上层水相等量),颠倒混匀,冰上静置10 min;4 ℃、12 000 r/min离心10 min后,底部出现白色沉淀,弃上清液;每管加1 ml 75%乙醇(用预冷的DEPC水提前配制),轻轻旋转颠倒管壁进行洗涤,缓慢倒掉洗液;重复洗涤1次;4 ℃、9 000 r/min 再次离心5 min;将离心管倒扣在滤纸上30 min,开盖使管壁内的乙醇充分挥发;加入20~50 μl DEPC水充分混匀后使用RNA浓度测量仪Nano-Drop检测并调整RNA浓度(加DEPC水使终浓度为500 ng/μl),-20 ℃保存。逆转录反应:① 去基因组DNA反应:模板RNA 2 μl,gDNA purge 1 μl,无酶水7 μl;总体积10 μl,42 ℃孵育5 min,结束后立即插入碎冰中;② 逆转录反应:上一步得到的的反应体系10 μl,2× cDNA SuperMix 10 μl,轻轻混匀,点动离心,50 ℃、15 min;③终止反应:75 ℃、5 min,-20 ℃冰箱保存。
Q-PCR:先将引物加入ddHO溶解使终浓度为10 μmol/L,然后按说明书配制体系。2× SYBR Q-PCR SuperMix Plus:10 μl,10 μmol/L Primer F:1 μl,10 μmol/L Primer R:1 μl,模板cDNA(10 ng/μl):1 μl,RNase-free water:7 μl。95 ℃、1 min,95 ℃、20 s,60 ℃、1 min,40个循环;β-actin作为内参,采用相对定量的2计算方法分析目的基因表达的拷贝数倍增变化情况。
1
.2
.5
CCK-8检测细胞增殖 转染及药筛后的细胞按照每孔2 000个接种到96孔板,48 h后每孔加入10 μl CCK-8,2 h后用酶联免疫检测仪上机检测GC-1细胞在450 nm处的吸光度值,重复3次以上实验。1
.2
.6
TUNEL-DAPI双染色 转染及药筛后的细胞在24孔板内进行细胞爬片,长满至70%~90%时拿出进行实验:阻水笔固定爬片,1×PBS洗2遍;加50~100 μl 4%多聚甲醛,4 ℃放置25 min进行细胞固定后浸于0.2% TritonX-100溶液中,室温孵育5 min进行通透处理;1×PBS洗2~3次;加入100 μl 1×Equilibration Buffer全部覆盖待检样本区域,室温平衡10~30 min;平衡结束后,每个样本滴加新鲜配制的50 μl TdT孵育缓冲液(34 μl ddHO,10 μl 5×Equilibration Buffer,5 μl BrightGreen Labeling Mix,1 μl Recombinant TdT Enzyme);封口膜盖于样本上均匀分布试剂,湿盒内37 ℃孵育60 min;1×PBS洗2次;然后用1×PBS新鲜配制2 μg/ml的DAPI溶液在黑暗中对样本进行复染,室温放置5 min;1×PBS清洗3次;样本区域加入抗淬灭剂,湿润封片;荧光显微镜下分析样本,在不同波长处观察绿色(TUNEL)和蓝色荧光(DAPI),拍照保存。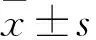
2 结果
2.1 GC-1细胞转染后WDR12的表达水平
与阴性对照组(NC组)相比,转染shWDR12后GC-1细胞中WDR12蛋白的表达水平明显降低(t
=22.83,P
<0.01),见图1A。Q-PCR结果同样显示细胞内WDR12的mRNA表达水平降低(t
=4.94,P
<0.01),见图1B。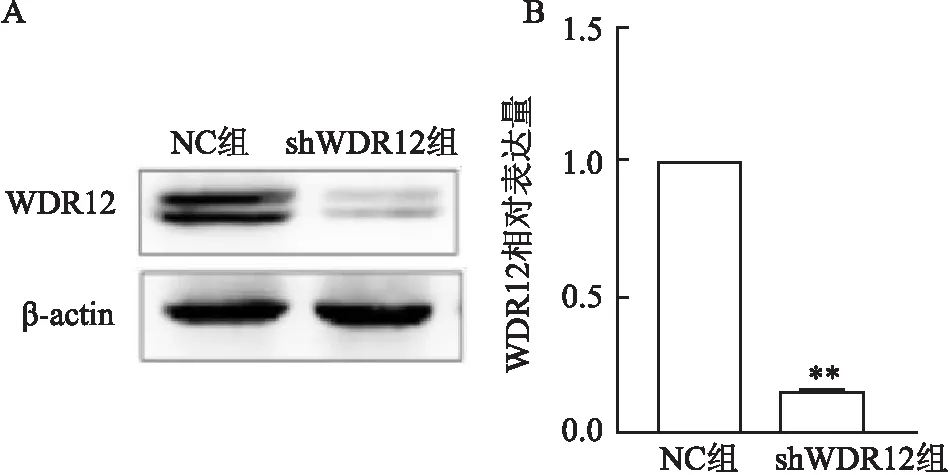
图1 GC-1细胞转染shWDR12后内源性WDR12的表达情况
2.2 GC-1细胞转染shWDR12后对细胞增殖的影响
对转染及药筛后的细胞加入CCK-8,2 h后用酶联免疫检测仪检测细胞在450 nm处的吸光度变化情况,以此反映细胞的增殖速率,经统计显示WDR12敲低的细胞增殖能力低于NC组的细胞增值能力,差异有统计学意义(t
=21.77,P
<0.01),见图2。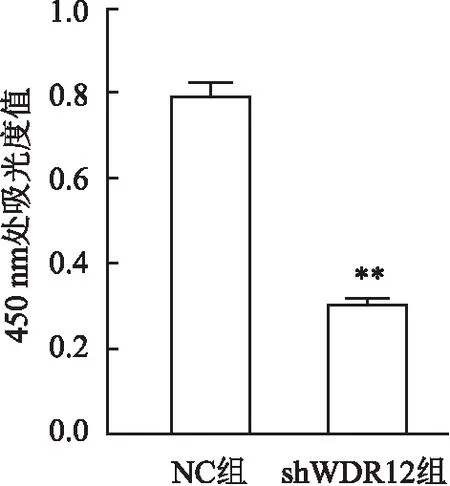
图2 GC-1细胞转染shWDR12后细胞的增殖情况与阴性对照组比较:**P<0.01
2.3 GC-1细胞转染shWDR12后对细胞凋亡的影响
用TUNEL-DAPI双染色检测NC组和shWDR12组细胞的凋亡情况,DAPI标记细胞核,TUNEL标记凋亡细胞,Merge为两种染色叠加后的效果,荧光显微镜下可以看到,shWDR12组的凋亡细胞数量较NC组多(图3)。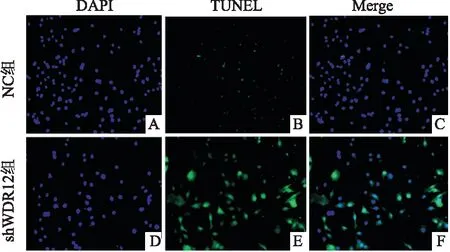
图3 GC-1细胞转染shWDR12后细胞的凋亡情况 ×200
2.4 GC-1细胞转染shWDR12后对核糖体蛋白基因的影响
利用Q-PCR分析了敲低WDR12后核糖体蛋白基因的表达情况,结果显示RPS3(t
=31.35,P
<0.05)、RPL11(t
=21.47,P
<0.01)、RPS15(t
=16.03,P
<0.05)的mRNA表达量下降,差异有统计学意义,而RPL31(t
=2.3,P
>0.05)的mRNA水平与NC组相比差异无统计学意义,见图4。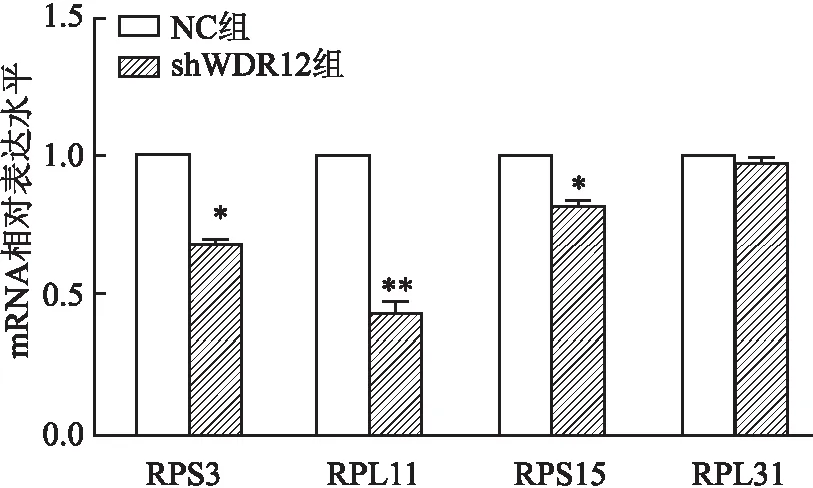
图4 GC-1细胞转染shWDR12后细胞内的核糖体蛋白基因表达情况与阴性对照组比较:*P<0.05,**P<0.01
3 讨论
在哺乳动物中,WDR12与核糖体生物发生因子1(Pes1)和增殖阻断蛋白1(Bop1)共同组成1个名为PeBoW的稳定复合物,该复合物对于哺乳动物细胞的增殖和大核糖体亚单位的成熟至关重要。作为PeBoW的成员,WDR12在32S前体rRNA加工、细胞周期进程、细胞凋亡和细胞增殖中发挥着关键作用,而其中最重要的是对于核糖体生物发生的影响。研究显示WDR12是32S前体核糖体RNA加工和细胞增殖的必需因子,WDR12的N端或C端截短可以阻止32S前rRNA加工为成熟的28S rRNA,并触发依赖于p53的细胞周期阻滞,从而使细胞正常功能的发挥出现损害甚至缺失。
该研究前期通过对1名来自近亲家族的不育男性病例及相关家系进行分析,鉴定了一个WDR12基因的纯合错义突变(p.Ser162Ala/c.484T>G),经研究表明该突变是导致患者出现重度畸形精子症的重要原因。WDR12在睾丸组织中高表达,为了进一步了解WDR12在精子发生过程中的作用,该研究使用脂质体转染方法对来自小鼠的精原细胞系GC-1细胞进行了WDR12的敲低,根据细胞的一些行为学差异表现来探究WDR12的功能。研究结果表明转染shWDR12后细胞的内源性WDR12表达水平显著降低。进一步的生物学分析显示,转染shWDR12后GC-1细胞的增殖能力减弱,这与前期的研究结果一致。同时在敲低WDR12的小鼠精原细胞中观察到RPS3、RPL11和RPS15这3个核糖体蛋白基因的表达量下降,核糖体是催化蛋白质合成的细胞器,由1个小的40S亚基和1个大的60S亚基组成,RPS3、RPS15编码的核糖体蛋白是40S亚基的1个组成部分,RPL11编码的核糖体蛋白是60S亚基的组成部分,提示了WDR12可能是通过降低核糖体亚基生成的途径影响核糖体的生物发生过程,但其具体机制还有待进一步研究。
已有研究报道核糖体功能与男性不育之间息息相关。如Zhang et al系统地分析了畸形精子症患者的基因表达谱,并发现了畸形精子症患者中下调的基因。其中一些下调的基因就是核糖体蛋白基因,如核糖体蛋白S3(RPS3)、RPS5、RPS6、RPS16和RPS23。Rpl10l是小鼠生精细胞中的一种核糖体成分,参与核糖体的组装。Rpl10l缺陷的雄性小鼠精子发生障碍并且完全不育,具体表现为绝大多数精母细胞发育停滞在减数第一次分裂前期向中期的转换,没有减数分裂后的生殖细胞产生。且Rpl10l缺失后粗线期及双线期精母细胞中的核糖体生成减弱并且大量蛋白的含量发生变化。此外,利用全外显子测序(WES)的方法在3例男性不育患者中发现了Rpl10l突变。WDR12是核糖体生物发生所必需的关键蛋白,目前对WDR12功能的相关研究主要集中在心肌细胞和肿瘤细胞中,而在男性不育患者中未见相关WDR12基因功能的研究。该研究通过干扰GC-1细胞中WDR12的表达,观察WDR12对GC-1增殖、凋亡以及核糖体蛋白基因表达的影响,进一步揭示了WDR12在精子发生过程中的可能作用,为临床上鉴定不育男性的致病基因提供了新的参考。

