FoxO1蛋白在癌细胞质中的差异表达及其功能研究
陈 洁,耿慧武,王凤杰,陈姝文,刘晓颖,范晓云
叉形头转录因子O亚型1(forkhead-box O class 1, FoxO1)是叉形头转录因子O(forkhead-box class O, FoxOs)超家族中的一员,哺乳动物FoxOs超家族包含了FoxO1、FoxO3A、FoxO4等4名成员。已知的FoxOs家族成员的功能包括参与细胞增殖、细胞存活、分化、凋亡、氧化应激、代谢、炎症、衰老及肿瘤抑制等。FoxO1通过转录调节参与糖代谢、脂肪代谢等相关的疾病,此外,已有研究表明,FoxO1参与了肿瘤的发生发展,FoxO1在某些种类的肿瘤中表达下调,如乳腺癌、子宫颈癌、肾癌、前列腺癌等。然而,有研究指出了FoxO1在其他一些类型肿瘤中高表达,如膀胱癌。因此,FoxO1在肿瘤发生发展过程中是否发挥不同作用值得探究。该研究对肺癌和食管癌及其相应的癌旁组织制作成的组织芯片(tissue microarray, TMA)进行免疫组化染色,探究FoxO1在肺癌和食管癌组织中的差异表达、具体亚细胞定位及相关影响因素;进一步在肺癌细胞系A549和食管癌细胞系Eca109中进行FoxO1的siRNA敲低及后续的克隆形成实验,初步探索FoxO1在肺癌和食管癌中的功能,了解FoxO1蛋白的亚细胞定位与肿瘤发生的可能关系。
1 材料与方法
1.1 材料
1
.1
.1
病例资料 收集2013—2015年在安徽医科大学第一附属医院经病理确诊的非小细胞肺癌组织及对应癌旁组织110例。收集2018—2019年在该院经病理确诊的食管癌组织样本及相应的癌旁组织48例。上述所有患者均未接受放化疗或靶向治疗。每位患者签署了知情同意书。肺癌样本中,鳞癌组织48例,腺癌组织62例。男性74例,女性36例,年龄48~73岁,中位年龄61岁。食管癌样本全部为鳞癌,男性38例,女性10例,年龄42~82岁,中位年龄66岁。1
.1
.2
主要试剂 胎牛血清购自以色列Biological Industries公司;RPMI 1640、DMEM培养基购自美国GE公司;胰酶细胞消化液购自上海碧云天生物技术有限公司;FoxO1抗体购自武汉Proteintech公司(18529-1-AP);Lipofectamine RNAi MAX购自美国Thermo Fischer Scientific公司;细胞总mRNA提取试剂盒购自美国OMEGA公司;二甲苯(AR)、无水乙醇(AR)和30% HO(AR)购自上海国药集团;辣根过氧化物酶标记的山羊抗小鼠IgG、辣根过氧化物酶标记的山羊抗兔IgG和DAB显色试剂盒购自北京中杉金桥生物有限公司。1
.1
.3
主要仪器 生物安全柜(BSC-2,新加坡ESCO公司);微量核酸浓度检测仪(NanoDrop,美国Thermo Fischer公司);自动组织包埋机(HistoCroe Arcadia H&C,德国徕卡公司);全自动轮转切片机(RM2255,德国徕卡公司);光学显微镜(CX21,日本尼康公司)。1
.1
.4
细胞株 肺癌细胞系A549和食管癌细胞系Eca109购自中国科学院上海细胞库。1.2 实验方法
1
.2
.1
细胞培养 A549和Eca109复苏后,分别用含10%血清的DMEM、RPMI 1640培养基置于37 ℃、5% CO、95%湿度的培养箱中培养,2~3 d换液1次,细胞生长达80%~90%时传代。1
.2
.2
siRNA knockdown实验 将细胞用胰酶消化离心后重悬,按合适密度接种至适当的培养板中,次日细胞汇合度约50%。用Opti-MEM分别稀释siRNA和Lipofectamine RNAi MAX,静置5 min后,将两者等体积温和混匀,静置20 min后加入培养的细胞中,6 h后更换不含抗生素的完全培养基继续培养。转染48 h后收集细胞进行后续检测。FoxO1 siRNA序列见表1。
表1 FoxO1 siRNA序列
1
.2
.3
Western blot实验 弃去6孔板中的细胞培养液,PBS洗涤1次,弃尽残液,加入50~80 μl细胞裂解液,冰上裂解15 min,转移裂解液至1.5 ml离心管,4 ℃、14 000 r/min离心20 min,取上清液,BCA法测定蛋白浓度。配制12% SDS-PAGE凝胶,每泳道上样30 μg总蛋白,电泳后转移至PVDF膜,5%脱脂奶粉封闭1 h,TBST洗涤后加入一抗置4 ℃冰箱孵育过夜。次日TBST洗涤后加入二抗孵育,再经TBST洗涤后进行ECL显影。1
.2
.4
qRT-
PCR实验 弃去12孔板细胞培养液,之后按试剂盒说明书提取细胞总mRNA。微量核酸浓度检测仪测定mRNA浓度和纯度。按逆转录试剂盒说明书进行逆转录获得cDNA。PCR反应体积20 μl,反应条件为:95 ℃初始变性3 min、95 ℃变性10 s、60 ℃退火30 s、70 ℃延伸30 s,32次循环。数据采用2法计算FoxO1与内参比值的相对表达量。FoxO1 qRT-PCR引物序列见表2。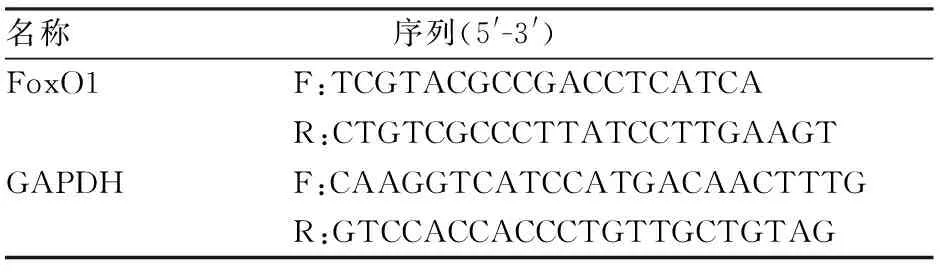
表2 FoxO1 qRT-PCR引物序列
1
.2
.5
免疫组化 组织芯片置于二甲苯中脱蜡15 min×2次,取出玻片,依次放入无水乙醇、95%乙醇、85%乙醇、75%乙醇和蒸馏水中,每次3 min。采用枸橼酸钠缓冲液进行抗原修复,微波炉中高火加热至沸腾开始计时7 min,暂停1 min后继续加热至沸腾5 min,自然冷却至室温。将玻片放置湿盒内,PBS清洗后滴加3% HO溶液完全覆盖整个组织,室温反应30 min,PBS洗涤3 min×3次,滴加一抗完全覆盖整个组织,置4 ℃冰箱内孵育过夜。次日恢复至室温,PBS洗涤3 min×3次,滴加二抗,室温孵育30 min,PBS洗涤3 min×3次,显微镜下进行DAB染色,蒸馏水终止反应。加入苏木精染液中染色2 min,1%盐酸乙醇分化、0.01 mol/L碳酸锂蓝化后烘干,二甲苯透明,滴加中性树脂封片,固定后显微镜下观察。根据染色强弱,对染色结果分别评分为0~3分。0分,细胞核和(或)细胞质内无棕色染色;1分,细胞核和(或)细胞质有淡黄色染色;2分,细胞核和(或)细胞质有中等棕色染色;3分,细胞核和(或)细胞质有棕褐色染色。根据染色肿瘤细胞占所有肿瘤细胞的比例,分别评分为1~4分。1分,0%<染色细胞占比≤25%;2分,25%<染色细胞占比≤50%;3分,50%<染色细胞占比≤75%;4分,染色细胞占比>75%。综合评分=染色评分×占比评分。综合评分>3分为阳性,综合评分>6分为高表达,3≤综合评分≤6分为低表达。1.3 统计学处理
采用SPSS 20.0软件对该实验数据进行统计分析,率的比较采用χ检验,相关性分析采用Spearman相关性检验。所有实验数据资料均保留小数点后3位,P
<0.05差异有统计学意义。2 结果
2.1 FoxO1在肺癌组织细胞质中表达情况
肺癌组织的免疫组织化学结果显示,在正常呼吸性支气管上皮细胞和细支气管上皮细胞中,FoxO1在细胞核和细胞质中都有表达;在肿瘤细胞中,FoxO1主要在细胞质中表达。比较FoxO1在癌组织及对应癌旁组织细胞质中的表达情况,结果显示,在肺鳞癌组中,癌组织FoxO1表达高于癌旁的有38例,低表达的有10例,占比分别为79.17%和20.83%;癌旁组织中高表达的有12例,低表达的有36例,占比分别为25.00%和75.00%。在肺腺癌组中,癌组织细胞质中FoxO1高表达的有43例,低表达的有19例,占比分别为69.35%和30.65%;癌旁组织细胞质中高表达的有20例,低表达的有42例,占比分别为32.26%和67.74%。χ检验比较肺鳞癌组和腺癌组FoxO1细胞质高、低表达占比情况,结果表明两种类型的肿瘤间差异无统计学意义(χ=1.342,P
=0.247)。见图1。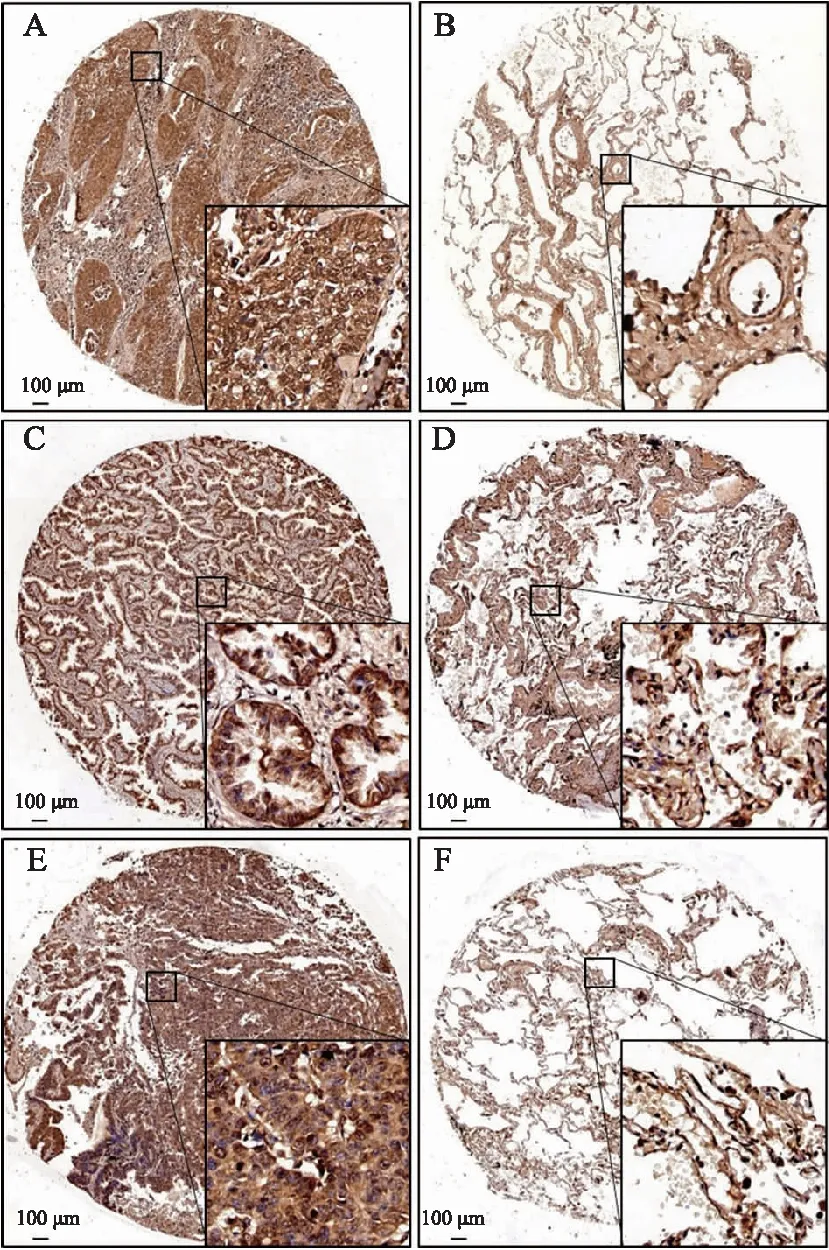
图1 FoxO1在肺鳞癌、肺腺癌及相应癌旁组织中的表达
2.2 FoxO1在肺癌组织细胞质中的表达与临床各指标间的相关性分析
FoxO1在肺癌组织细胞质中表达的免疫组化评分与临床各指标间的相关性分析表明,细胞质中FoxO1的表达与性别、年龄、分化程度、侵袭程度、淋巴结转移以及肿瘤分期差异无统计学意义。见表3、4。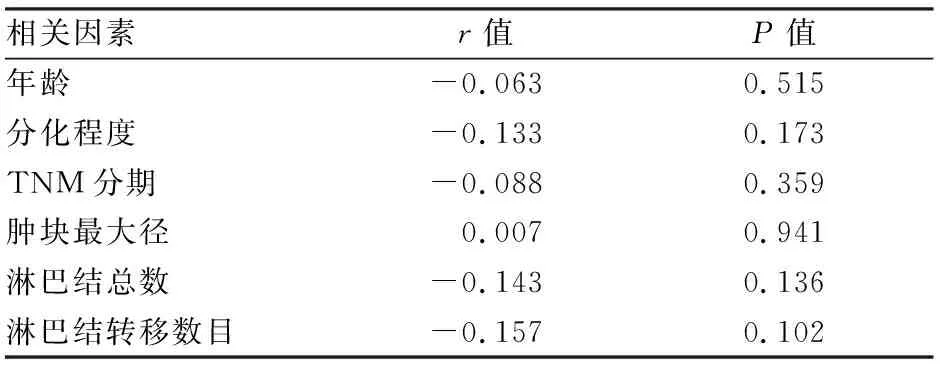
表3 FoxO1在肺癌组织细胞质中表达的免疫组化评分与临床各指标间的相关性
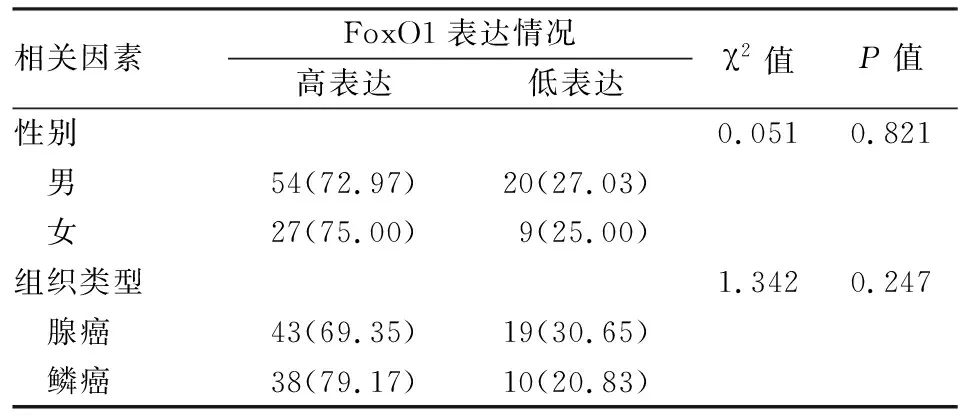
表4 性别及组织类型对肺癌组织细胞质中FoxO1表达的影响[n(%)]
2.3 FoxO1在食管癌组织中的表达
免疫组化结果显示,在食管癌癌旁组织中,FoxO1主要表达在基底层和上皮细胞的细胞核中,间质细胞中表达较低或不表达,见图2;在癌组织中,FoxO1主要表达于肿瘤细胞的细胞质中,细胞核中表达减少或不表达,其表达与正常细胞中的定位有显著差异。癌旁组织样本中阳性表达17例,阴性表达31例;癌组织中阳性表达41例,阴性表达7例,癌组织中阳性率高于癌旁组织(χ=15.875,P
<0.01)。癌旁组织样本中高表达9例,低表达39例;癌组织中高表达28例,低表达20例,癌组织中阳性率高于癌旁组织(χ=25.089,P
<0.01)。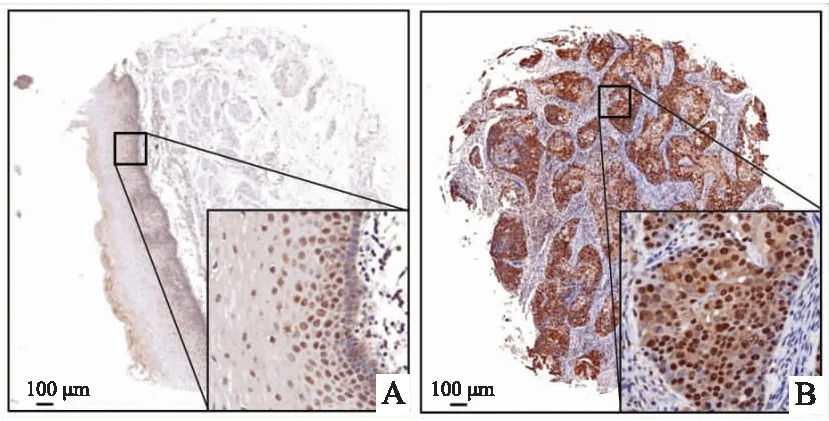
图2 FoxO1在食管癌癌旁和癌组织中的表达 A:癌旁组织;B:癌组织;原图 ×40;局部图 ×400
2.4 FoxO1在食管癌组织细胞质中的表达与临床各指标间的相关性分析
该实验对FoxO1在食管癌组织中的免疫组化评分与临床各指标间的关系进行相关性分析,结果显示,FoxO1的表达与肿瘤分期相关,差异有统计学意义(P
<0.05),而与性别、年龄、是否吸烟、是否饮酒、分化程度、侵袭程度、淋巴结转移分期以及是否有其他消化系统疾病差异无统计学意义,见表5、6。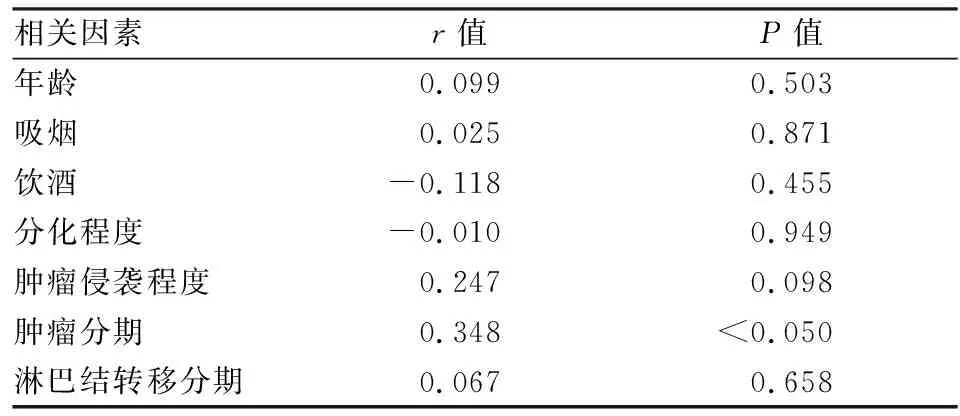
表5 FoxO1在食管癌组织中的免疫组化评分与临床各指标间的相关性

表6 性别及伴有其他消化系统疾病对食管癌FoxO1免疫组化评判的影响[n(%)]
2.5 FoxO1在肺癌细胞系A549和食管癌细胞系Eca109中的表达及定位
为了验证肿瘤细胞系中FoxO1的表达是否与组织中的表达一致,该实验选择常用的肺癌细胞系A549(图3A~C)和食管癌细胞系Eca109(图3D~F)中进行FoxO1的内源性免疫荧光实验,并在激光共聚焦显微镜下观察结果。显微图像显示,在上述两种细胞系中,FoxO1在细胞质和细胞核中均呈弥散分布,但细胞质的表达水平显著高于细胞核(P
<0.01),结果与组织中的免疫组化结果一致。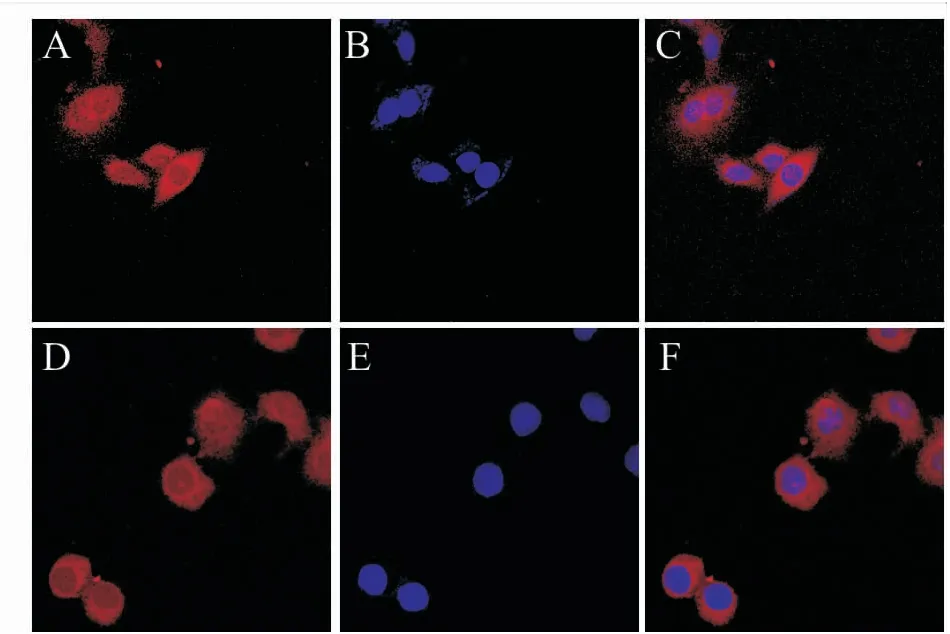
图3 FoxO1在A549和Eca109细胞中的定位 ×400
2.6 FoxO1 siRNA对A549和Eca109细胞中FoxO1的转录水平和蛋白表达水平的影响
为了进一步了解FoxO1在肿瘤细胞中的功能,该实验使用siRNA干扰技术敲低A549和Eca109细胞的FoxO1的表达。Western blot检测转染FoxO1 siRNA后A549和Eca109细胞中FoxO1蛋白表达水平(图4A~D);提取细胞总mRNA,qRT-PCR检测转染FoxO1 siRNA后A549和Eca109细胞中FoxO1 mRNA表达水平(图4E、F)。结果显示,在成功转染siRNA后,细胞内FoxO1的mRNA和蛋白水平的表达均明显受到抑制(P
<0.01)。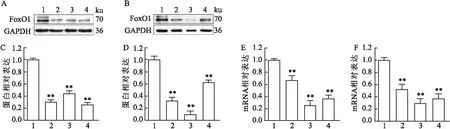
图4 FoxO1 siRNA knockdown后FoxO1 mRNA和蛋白表达水平检测
2.7 A549和Eca109细胞系中FoxO1的敲低对细胞增殖的影响
为了探索FoxO1能否影响肿瘤细胞的增殖能力,该实验在A549细胞系(图5A)和Eca109细胞系(图5B)中瞬时转染FoxO1 siRNA,随后进行相应的克隆形成实验。实验结果显示,在上述两种细胞系中,FoxO1敲低组相对于阴性对照组的细胞克隆数明显降低(P
<0.01),提示FoxO1的敲低抑制了肿瘤细胞的增殖。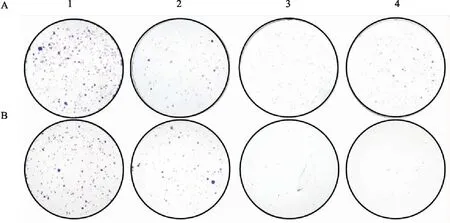
图5 A549和Eca109细胞系FoxO1 的siRNA敲低抑制细胞增殖A:A549细胞系;B:Eca109细胞系;1:阴性对照组;2~4:3个siRNA敲低组
3 讨论
在早期阶段,采用免疫组化实验研究蛋白分子在组织中的表达时,各样本组织贴附在多张载玻片上,在DAB显色操作时,各标本显色时间不易控制在相同时间,造成最终的组织显色存在误差,对染色结果产生较大的影响。近年来,利用组织芯片技术将多个样本组织贴附在同一张载玻片上制作成组织芯片,随后进行免疫组化实验,可有效避免显色时间差异的弊端,各组织样本间的差异性得到可靠体现。
该研究利用肺癌和食管癌组织芯片,使用兔FoxO1多克隆抗体检测肺癌和食管癌组织细胞质中FoxO1的表达情况,根据染色强弱和阳性细胞率形成综合评分并与临床病理多个指标进行相关性分析。该实验的免疫组化结果显示,在正常支气管上皮细胞中,FoxO1在细胞核和细胞质中都有表达;在肺癌细胞中,FoxO1主要在细胞质中表达。在正常食管上皮细胞中,FoxO1主要表达在细胞核内,细胞质中不表达或低表达;在食管癌细胞中,FoxO1主要表达在胞质中。可见,FoxO1在肿瘤细胞中的表达分布发生了明显的改变,即在细胞核中表达减少,而更多地发生了细胞核向细胞质的转位。通过内源性免疫荧光实验,可以清晰观察到,FoxO1在肺癌细胞系A549和食管癌细胞系Eca109细胞核中的表达显著低于细胞质。在缺乏外界应激刺激因子、存活因子或生长因子时,FoxO1定位在细胞核中并发挥转录因子活性。而在肿瘤细胞中,PI3K/AKT信号通路被组成性激活,随后AKT磷酸化FoxO1,进而促进FoxO1转移至细胞质中失去转录调节活性。用PI3K/AKT信号通路特异性抑制剂LY294002和MAPK/ERK信号通路特异性抑制剂UO126分别处理A549细胞,均可导致FoxO1从细胞质向细胞核的转位,进而能够抑制细胞增殖。因此,该结果提示,FoxO1在细胞核中发挥抑制肿瘤细胞增殖的作用。随后进行的siRNA敲低及相应克隆形成实验表明,细胞质中高表达FoxO1的A549和Eca109细胞中,FoxO1的敲低能够抑制细胞增殖,结合免疫组化结果即肿瘤组织细胞质中FoxO1普遍高表达,提示肿瘤细胞质中高表达的FoxO1可能发挥促癌作用。
FoxO1蛋白的表达和活性受到转录与翻译以及翻译后的乙酰化、磷酸化或泛素化修饰的多重调节。鉴于FoxO1在细胞内的不同定位、作用及其自身活性调节的复杂性,其在肿瘤发生、发展中的确切作用机制有待进一步揭示。

