PIK3R3对三阴性乳腺癌细胞侵袭和迁移能力的影响*
吕 峰, 秦景博, 潘力敏, 孔舒欣, 曹贝贝
河南大学人民医院,河南省人民医院乳腺外科,郑州 450003
2020年世界卫生组织(WHO)数据显示,乳腺癌是全球女性发病率最高的恶性肿瘤,全球乳腺癌确诊病例约226万[1]。其中,三阴性乳腺癌是乳腺癌所有类型中预后最差的一种,目前研究提示乳腺癌细胞的生长过程有多个信号通路的参与[2],其中,PI3K/Akt信号通路作为信号转导通路之一,对其研究相对较完善,已证实PI3K/Akt信号通路参与癌细胞分化、增殖以及凋亡等重要过程[3-4]。某些类型的乳腺癌表现出非常高的PI3K通路激活水平[5]。乳腺癌的突变通过胰岛素和一些生长因子诱导的关键代谢途径来传递信号,这一代谢途径可激活一种称为磷脂酰肌醇-3-激酶(phosphoinositide 3-kinases,PI3K)的酶,并调节响应PI3K脂类产物的信号蛋白。PI3K途径在体内与许多组织的生长调控和转化有关[6],并且在肿瘤的发展中具有关键作用[7-8]。在乳腺癌中,PI3K通路通过基因复制数目的改变和(或)其他基因的突变或缺失而被激活[9-13]。PIK3R3是ⅠA型PI3K的调节亚基之一,上调或敲减它的表达能显著影响肿瘤细胞分化等过程[14-15],如消化道肿瘤细胞及白血病细胞。我们的前期研究表明PIK3R3在激素受体不同状态下的乳腺癌细胞内表达情况不一样,其在激素受体阴性细胞内表达水平较高[16]。现阶段对PIK3R3在三阴性乳腺癌中的研究欠完善,其是否参与细胞周期及增殖进程、及其可能的机制尚不清楚,本实验以三阴性乳腺癌组织及三阴性乳腺癌细胞株MDA-MB-231为实验对象,观察PIK3R3的表达情况,并探讨其对乳腺癌细胞生物学行为的影响及可能的机制。
1 资料与方法
1.1 临床资料
收集2017年1月~2018年12月在河南省人民医院乳腺外科切除的53例三阴性乳腺癌标本,所有病例均有完整的临床资料。患者平均年龄53.4岁。淋巴结阳性者36例,淋巴结阴性者17例。TNM分期Ⅰ、Ⅱ、Ⅲ、Ⅳ期分别为8、17、24、4例(参照NCCN乳腺癌分期标准)。所有收集患者均未接受术前化疗、放疗和免疫治疗等。同时取此53例患者正常乳腺组织(距肿瘤边界5 cm以上)作为对照。
1.2 免疫组化检测
乳腺癌组织切片后按以下操作处理:①置于二甲苯一号、二甲苯二号溶液中分别浸泡10 min。②依次用无水乙醇5 min、90%乙醇3 min、80%乙醇3 min、70%乙醇3 min漂洗水化。③以蒸馏水冲洗3 min×3次,PBS冲洗3 min×3次。④置于3%过氧化氢中室温孵育10 min,PBS冲洗3 min×3次,再用蒸馏水冲洗3 min。⑤置于0.01 mol/L枸橼酸缓冲液(pH为6.0)中水煮修复10 min,自然冷却至室温,PBS冲洗3 min×3次。⑥加入一抗,放置于4℃冰箱孵育过夜,室温平衡30 min,PBS冲洗5 min×3次;加入二抗,保持37℃孵育10 min。PBS 3 min×3次,用蒸馏水洗3 min。⑦ DAB染色,显色后在显微镜下观察反应过程,再用自来水彻底冲洗。⑧苏木精复染,干燥后封片,拍照。
PIK3R3评分采用染色强度、阳性细胞数百分比结合的半定量分析方法。染色强度评分:多数细胞呈现的染色强度减去背景着色,无阳性着色为0分,弱阳性为1分,阳性为2分,强阳性为3分。阳性细胞百分比评分:每张免疫组化切片任意选择5个不同的视野(×200)观察计数,0~为0分,6%~为1分,26%~为2分,51%~为3分,>75%为4分。每一视野分别按照上述评分方法进行染色强度计分和阳性细胞百分比评分后,二者乘积即为最终评分,最终评分0~3分为阴性,>3分为阳性。
1.3 细胞培养及转染
将三阴性乳腺癌细胞株MDA-MB-231接种于含10%FBS和青链霉素的1640培养液,放入培养箱中培养,培养箱设置参数为37℃、5% CO2、饱和湿度。
依据Invitrogen公司转染操作方法指引,当细胞处于对数生长期时,选取正常培养的MDA-MB-231细胞株,消化制成单细胞悬液,铺6孔板,每孔3×105个细胞,静置过夜。第2天转染,6孔板每孔加入siRNA 6 μL,分空白对照组(Blank组)、空载体转染细胞组(siRNA-NC组)、敲减PIK3R3细胞组(siRNA-PIK3R3组),转染时质粒与脂质体的比例为1∶1。转染成功后放入培养箱中培养48 h,再进行下一步检测。
1.4 Western blot检测细胞内PIK3R3的表达
各组细胞转染48 h后,以胰酶消化,用PBS洗涤,然后加入NP-40进行裂解,滴管吸取上清液测细胞总蛋白,用BCA试剂法检测蛋白质的浓度。SDS-PAGE对蛋白进行电泳分析,转至PVDF超滤膜上后,滴加5%脱脂牛奶封闭静置2 h;滴加一抗,4 ℃状态下孵育过夜,然后浸于TBST缓冲液中,在摇床上充分洗涤3次,每次10 min;滴加二抗,室温下放置于摇床上孵育1 h,TBST缓冲盐溶液洗膜后,曝光显影,选取照片。
1.5 Transwell法检测MDA-MB-231细胞迁移能力
转染48 h后各组细胞消化收集,计数板上进行计数,再用无血清培养液重悬,将MDA-MB-231细胞稀释成5×105个/mL,铺于Transwell小室的上室,每孔200 μL,下室加入含10%FBS的500 μL完全培养液,24 h后,用PBS清洗3次,室温环境下用4%多聚甲醛溶液固定15 min,再用PBS清洗3次,轻轻用棉签擦去上室细胞,加入0.1%的结晶紫染色15 min,用PBS清洗3次,室温环境下风干,显微镜拍照(×200)。随机取5个视野,取平均值。实验重复3次,每组分别设置3个复孔。
1.6 MTT法检测MDA-MB-231细胞增殖
转染48 h后将各组细胞分别收集,将细胞密度调整为1×105个/mL,微量移液器取100 μL单细胞悬液,依次接种入96孔板内,并分别在接种24、48、72、96、120 h时,每孔内加入MTT 10 μL,于37 ℃温箱内放置4 h,再往每孔内加入DMSO 100 μL,用酶标仪检测各组细胞在570 nm波长处的吸光度值,绘制细胞生长曲线图。
1.7 流式细胞术检测MDA-MB-231细胞凋亡率
转染48 h后各组细胞消化收集,用PBS洗涤细胞2次,Binding buffer悬浮细胞,在细胞悬浮液中加入5 μL Annexin Ⅴ-PITC和10 μL PI,轻轻混匀后,控制室温为4 ℃,避光条件下孵育5 min,上机检测。
1.8 动物实验
为了进一步探究PIK3R3对动物体内肿瘤组织生长过程的影响,分别将空白对照组(Blank组)、空载体转染细胞组(siRNA-NC组)、敲减PIK3R3细胞组(siRNA-PIK3R3组)的MDA-MB-231细胞从尾静脉内注射到Balb/c小鼠体内,剂量为每只小鼠1×105个细胞。正常喂养6周,处死所有小鼠后取出乳腺组织。观察瘤体大小及小鼠存活期。
1.9 统计学方法
2 结果
2.1 PIK3R3在三阴性乳腺癌组织内的表达情况及其与乳腺癌临床病理特征之间的关系
PIK3R3主要定位于细胞质内,当细胞质呈黄色或棕黄色时定义为阳性着色,不同病理切片染色深度不同(图1),53例三阴性乳腺癌组织及正常组织中其阳性表达率分别为60.38%(32/53)和22.64%(12/53),差异有统计学意义(P<0.01)。
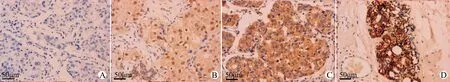
A:阴性着色,染色强度计为0分;B:弱阳性着色,染色强度计1分;C:阳性着色,染色强度计2分;D:强阳性着色,染色强度计3分图1 PIK3R3免疫组化着色强度评分(SP法染色,×200)Fig.1 The score of PIK3R3 immunohistochemical staining intensity(SP staining,×200)
53例三阴性乳腺癌组织中PIK3R3的表达与肿瘤TNM分期和淋巴结转移状态密切相关(表1)。有淋巴结转移者PIK3R3阳性表达率72.22%(26/36)高于无淋巴结转移者29.41%(5/17)(P<0.01),Ⅰ期患者PIK3R3阳性表达率明显低于Ⅱ、Ⅲ、Ⅳ期患者(均P<0.01),Ⅲ、Ⅳ期患者PIK3R3阳性表达率差异不明显(P>0.05)。
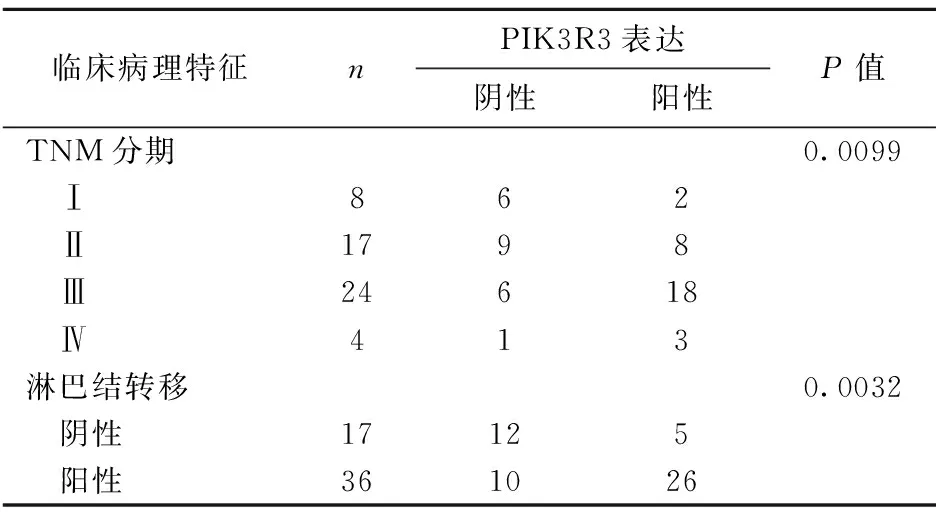
表1 PIK3R3表达情况与三阴性乳腺癌临床病理特征之间的关系Table 1 The relationship between the expression of PIK3R3 and clinicopathological features of triple negative breast cancer
2.2 下调PIK3R3对三阴性乳腺癌MDA-MB-231细胞的影响
Western blot检测结果显示:空白对照组和转染siRNA-NC组PIK3R3的表达未见明显差异,转染siRNA-PIK3R3组PIK3R3的表达水平则显著降低,说明siRNA-PIK3R3能够有效降低细胞内PIK3R3的表达,具体见图2A。
MTT检测显示:与空白对照组和siRNA-NC组相比,siRNA-PIK3R3组的细胞增殖活力在第2天开始降低,从第3天开始差异具有统计学意义(P<0.05),各组生长曲线见图2B。该检测结果提示下调PIK3R3可以抑制人三阴性乳腺癌细胞MDA-MB-231的增殖。
细胞迁移实验结果显示:空白对照组穿膜细胞数为(178.4±37.7),siRNA-NC组为(161.3±24.7),而siRNA-PIK3R3组穿膜细胞数为(89.9±7.3),空白对照组和siRNA-NC组之间穿膜细胞数差异无统计学意义(P>0.05),与其他两组相比,siRNA-PIK3R3组穿膜细胞数明显降低,差异具有统计学意义(均P<0.01),见图2C。实验结果表明降低PIK3R3的表达可引起MDA-MB-231细胞迁移能力减弱。
流式细胞术检测结果显示:空白对照组细胞凋亡率为(5.26±1.31)%,siRNA-NC组细胞凋亡率为(3.83±0.79)%,siRNA-PIK3R3组细胞凋亡率为(3.64±0.36)%。siRNA-NC组和siRNA-PIK3R3组的细胞凋亡率与空白对照组比较均有所降低,但差异无统计学意义(均P>0.05),见图2D。实验结果表明敲减PIK3R3的表达对MDA-MB-231细胞的凋亡没有明显影响。
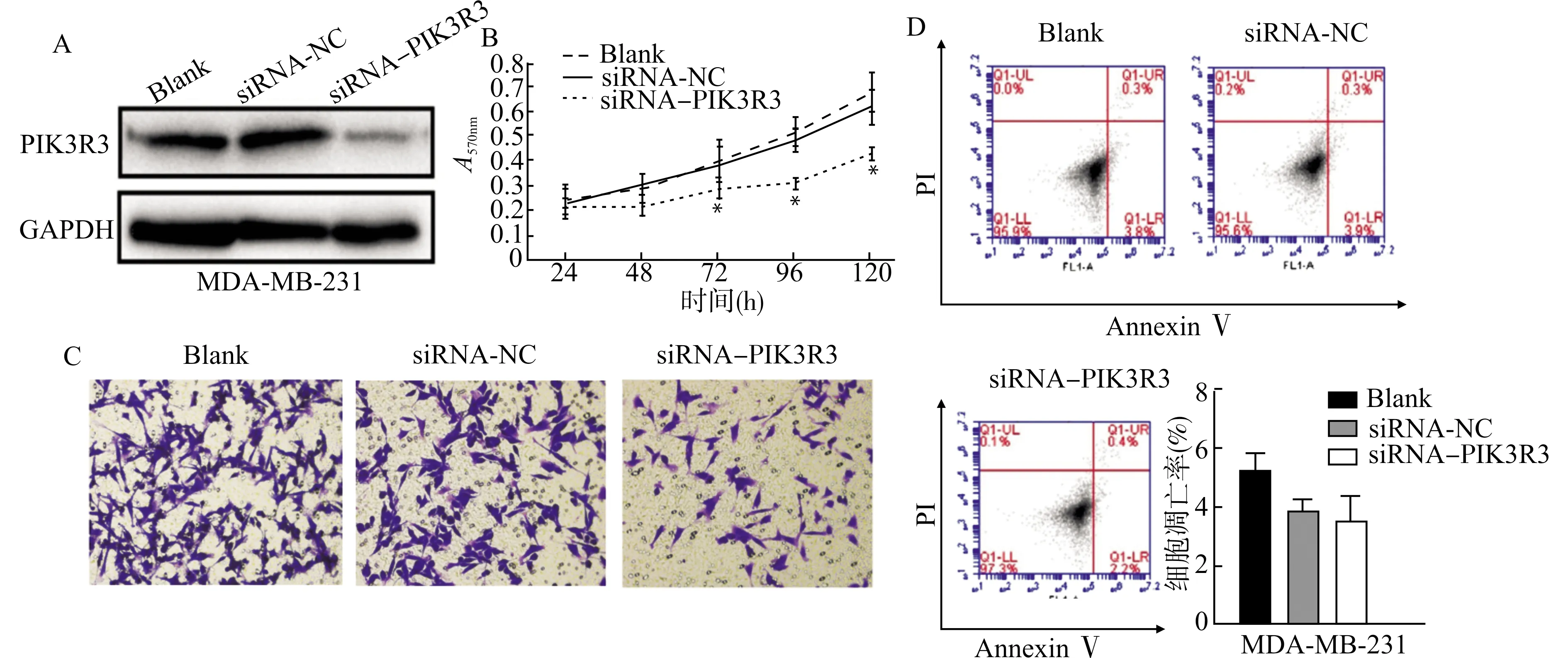
A:siRNA-PIK3R3对MDA-MB-231细胞中PIK3R3蛋白表达的影响;B:MTT法检测各组细胞的生长曲线,与空白对照组比较,*P<0.05;C:下调PIK3R3对人乳腺癌MDA-MB-231细胞迁移能力的改变(结晶紫染色,×200);D:下调PIK3R3对人乳腺癌MDA-MB-231细胞凋亡的影响图2 下调PIK3R3对MDA-MB-231细胞的影响Fig.2 Effect of down-regulating PIK3R3 on MDA-MB-231 cells
2.3 下调PIK3R3对细胞内磷酸化蛋白激酶(p-AKT)、雌激素受体(ERα)、G蛋白偶联雌激素受体1(GPER1)蛋白表达的影响
ERα及GPER1在MDA-MB-231细胞及MCF-7细胞内的表达情况是不一样的,二者在MCF-7细胞内的表达水平明显高于MDA-MB-231细胞(图3A)。在MDA-MB-231细胞及MCF-7细胞内转染针对PIK3R3的siRNA(siRNA-PIK3R3)敲减PIK3R3,并以siRNA-NC组作为对照。采用Western blot检测,结果显示p-AKT没有明显变化。因此我们考虑PIK3R3有可能通过非AKT依赖通路产生影响。与此同时,当降低PIK3R3的表达后,在GPER1低表达的MDA-MB-231细胞中GPER1表达明显增加(图3B),提示下调PIK3R3的表达具有选择性促进GPER1蛋白表达的能力。
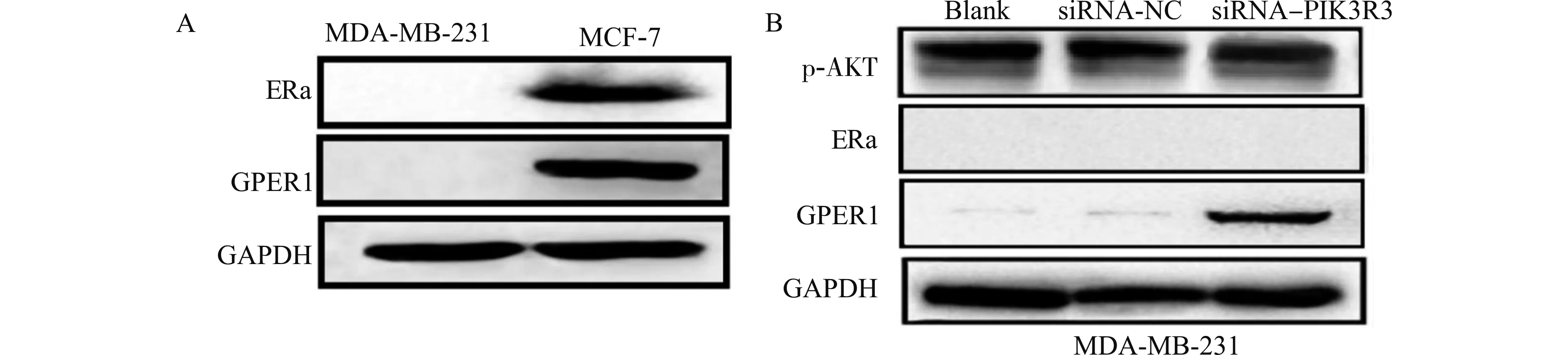
A:ERa及GPER1在MDA-MB-231细胞及MCF-7细胞内的表达;B:PIK3R3低表达后,MDA-MB-231细胞内p-AKT、ERa及GPER1的表达图3 下调PIK3R3对细胞内AKT、ER、GPER蛋白的影响Fig.3 Effect of down-rebulating PIK3R3 on intracellular AKT,ER and GPER proteins
2.4 敲低PIK3R3抑制动物体内肿瘤生长
注射转染siRNA-PIK3R3乳腺癌细胞的小鼠与注射对照细胞的小鼠相比成瘤体积更小,如图4A、B、C所示。此外,与注射siRNA-NC组细胞的小鼠相比较,注射siRNA-PIK3R3细胞的小鼠存活时间更长(图4D)。以上结果说明,PIK3R3在乳腺癌形成中起至关重要的作用。
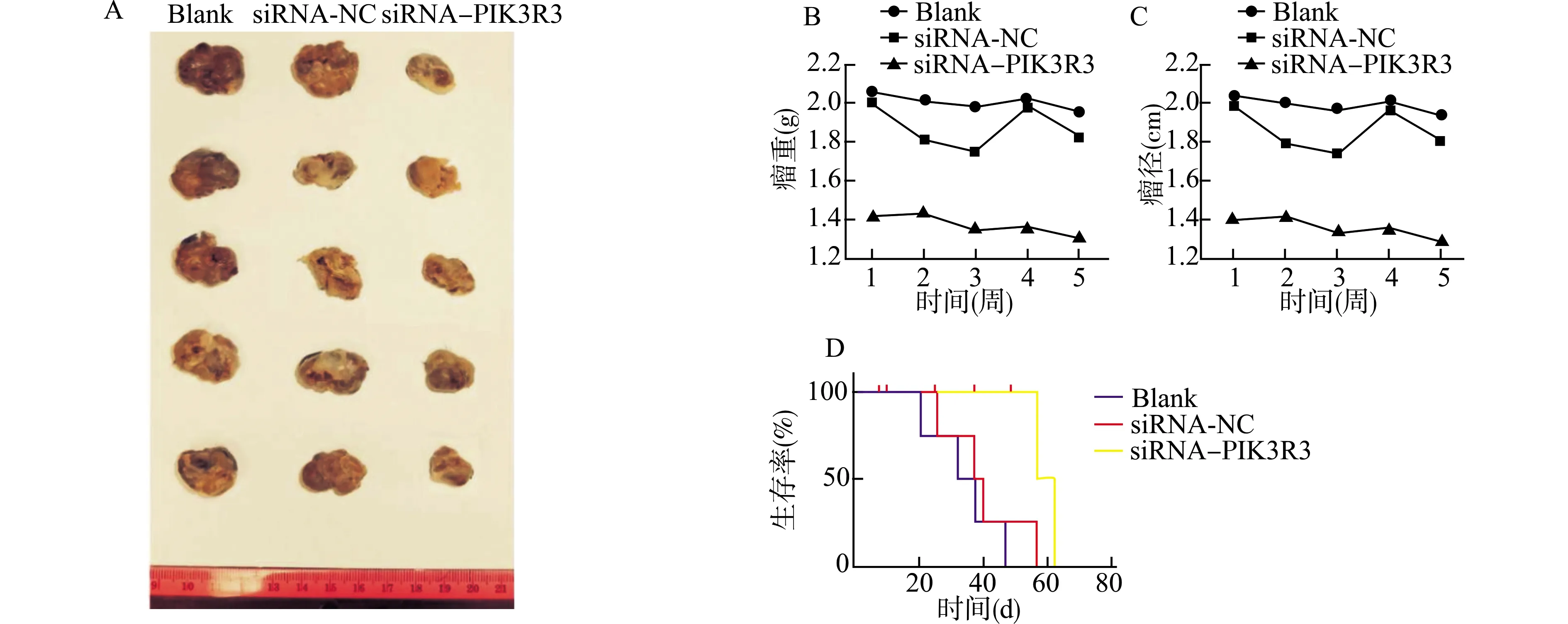
A:注射不同类型MDA-MB-231细胞的小鼠成瘤大小对比;B、C:注射不同类型MDA-MB-231细胞的小鼠瘤体大小及重量对比;D:注射不同类型MDA-MB-231细胞的小鼠生存期对比图4 PIK3R3对动物体内肿瘤组织的影响Fig.4 Effects of PIK3R3 on tumor tissue in animals
3 讨论
2020年世界卫生组织(WHO)最新统计数据显示,乳腺癌已经成为全球女性最常见的癌症类型,全球新发病例超过220万例。人类癌症的特点是异质性,反映了在肿瘤发生过程中大量细胞突变的复杂性和多样性。乳腺癌和大多数癌症一样,是由肿瘤发生过程中获得的多种体细胞突变引起的多种不同疾病的异质集合。查阅大量基础研究资料后发现,在乳腺癌的突变和进展过程中,包含多个信号通路的参与,而PI3K信号通路被多个研究指出在细胞的增殖、分化、凋亡、恶性肿瘤侵袭转移及治疗耐药过程中可被过度激活,从而发挥极其重要的调节作用[17]。
PIK3R3是PI3K蛋白的重要调节亚基之一,高表达于人体部分恶性肿瘤,已有研究证实PIK3R3在消化道恶性肿瘤内显示出较高的表达水平,且其高表达状态具有促进消化道肿瘤细胞增殖、侵袭和转移的能力[15]。同时,我们也观察到在性激素不同水平状态下的乳腺癌PIK3R3表达情况是不一样的,这也意味着PIK3R3可能在乳腺癌生长机制中扮演重要角色[16]。为了进一步探讨PIK3R3与三阴性乳腺癌之间的关系,我们检测了53例三阴性乳腺癌组织内PIK3R3的表达情况,实验结果显示:PIK3R3在三阴性乳腺癌组织中的阳性表达率为60.38%(32/53),明显高于正常组织22.64%(12/53),PIK3R3阳性表达率的高低与肿瘤TNM分期和淋巴结转移有相关性,在Ⅰ~Ⅳ期内PIK3R3阳性率分别为25.0%、47.1%、70.8%,75.0%,呈逐步上升趋势,同时淋巴结转移者PIK3R3阳性表达率72.22%(26/36)高于无淋巴结转移者29.41%(5/17)。Ⅰ期患者的阳性率略高于正常组织内的表达水平,但是差异没有统计学意义,这可能是和乳腺癌的疾病特性有关,乳腺癌发病隐匿,Ⅰ期乳腺癌基本没有任何症状,就诊时很多都已经是Ⅱ甚至是Ⅲ期,Ⅰ期患者比例较少,且Ⅰ期乳腺癌经规范化治疗后,10年生存率可达90%以上,预后较好。这可能是Ⅰ期乳腺癌组织内PIK3R3阳性率不高的主要原因,这个结果提示我们PIK3R3不太适合作为早期乳腺癌的敏感筛查指标。而对于淋巴结阳性的患者,我们发现PIK3R3阳性表达率明显高于淋巴结阴性患者,这个结果和乳腺癌TNM分期的结果一致。在乳腺癌的发生发展过程中,可发生多个等位基因的突变,编码大多数蛋白质的基因是癌基因或肿瘤抑制基因,这取决于它们是通过PI3K途径激活信号传导还是起抑制作用。我们发现PIK3R3阳性表达率在乳腺癌患者中增高,这提示我们,PIK3R3的表达水平和疾病的进展呈正相关,其相关性具有统计学意义。我们以人三阴性乳腺癌细胞株MDA-MB-231作实验对象,进行更深一步的研究。通过体外实验,我们可以观察到,PIK3R3在三阴性乳腺癌细胞株MDA-MB-231中呈高表达状态,进一步使用RNA干扰技术降低PIK3R3在三阴性乳腺癌细胞株MDA-MB-231中的表达。随后通过Transwell迁移小室法,我们发现使用RNA技术干扰PIK3R3表达后,MDA-MB-231细胞在体外运动迁移的能力大幅下降。Soroceanu等[18]证实PIK3R3在神经母细胞瘤内具有促进肿瘤细胞增殖的作用。通过本次实验,我们使用MTT法检测发现,将PIK3R3表达下调以后,可以大幅削弱MDA-MB-231细胞的增殖能力,我们这一结论和Zhou等[19]的结果一致,他们在干扰PIK3R3的表达时,发现PIK3R3同样具有使胃癌细胞增殖受到抑制的作用。现有研究显示,PI3K/Akt信号通路在多种恶性肿瘤细胞内都异常活跃,呈现一种过度激活的状态,并且PI3K/Akt信号通路的下游多种效应分子的活化状态都能受到异常影响,由此推测,将PIK3R3表达上调后,可促进肿瘤细胞的增殖并且抑制肿瘤细胞的凋亡进程。本实验发现,敲减PIK3R3表达后,减弱了MDA-MB-231细胞的增殖能力,而MDA-MB-231细胞的凋亡率并没有受到影响,那么我们猜想,是否可以通过下调PIK3R3的表达进而激活PI3K/Akt以外的信号通路,参与肿瘤细胞的活动呢?
G蛋白偶联雌激素受体(GPER)是一种新型的膜雌激素受体,近年来大量研究结果证实,GPER在多种激素相关肿瘤的发生和演变过程中发挥关键性作用[20]。通过本次实验,我们首次发现在ERα(-)及GPER1(-)的MDA-MB-231细胞中,敲减PIK3R3蛋白的表达后,反而引起GPER1蛋白表达增加。我们在前面实验中发现PIK3R3蛋白对p-Akt影响不大,但是PI3K/Akt信号通路在雌激素介导的细胞学效应中发挥着关键作用[16],现有研究显示GPER1同样可以经由PI3K/Akt信号通路参与细胞内及细胞间的信号转导过程[21],由此我们猜想,PIK3R3蛋白极有可能是GPER1下游非经典PI3K/Akt信号通路中的一个关键位点,它的抑制作用具有导致负反馈GPER1蛋白激活的作用。Yang等[22]研究发现,通过调控Rb蛋白可使PIK3R3参与到细胞周期的调节,而我们实验室前期也通过实验证实高表达PIK3R3 N端24个氨基酸能抑制多种消化道恶性肿瘤细胞的增殖,这提示PIK3R3下游可能存在非PI3K经典途径,经由这一途径可发挥调控细胞增殖、迁移以及细胞凋亡进程的作用。同时,我们在动物实验中也发现注射siRNA-PIK3R3细胞的小鼠成瘤体积小,存活时间更长,说明敲低PIK3R3抑制动物体内肿瘤生长,提示我们降低PIK3R3表达水平构成了乳腺癌生长缓慢的关键机制。
PIK3R3是PI3K家族中重要的调节亚基之一,本研究显示,中、晚期三阴性乳腺癌细胞中PIK3R3的表达较高时,乳腺癌细胞的增殖、迁移等生物学行为增强;降低三阴性乳腺癌细胞中PIK3R3的表达则能明显抑制恶性肿瘤的生长。因此,对PIK3R3进一步研究探索,可能会使其成为治疗三阴性乳腺癌和评估其预后的新靶点,具有研究价值。

