HDAC1
——上皮性卵巢癌化疗耐药及复发的生物标记*
王齐月, 彭明刚, 黎国清, 王泽华, 杨晓新
1华中科技大学同济医学院附属协和医院妇产科,武汉 430022 2武汉大学附属同仁医院(武汉市第三医院)妇产科,武汉 430060
上皮性卵巢癌是女性生殖系统常见的恶性肿瘤,由于早期诊断困难以及化疗耐药,患者的5年生存率仅为35%左右。即使在美国等发达国家,卵巢癌的5年生存率也仅为47%[1]。顺铂或卡铂联合紫杉醇的化疗方案是上皮性卵巢癌化疗的首选,其初次化疗的缓解率可达80%,但仍有相当一部分患者对化疗耐药;而且,即使是初次化疗完全缓解的患者,也可能出现复发,并伴随着无铂间期的缩短,最终发展为耐药复发[2]。因此,亟需研究与卵巢癌化疗耐药及复发相关的分子标记物,以预测其化疗反应性,推动上皮性卵巢癌的个体化治疗。
近年来的研究发现,组蛋白修饰在卵巢癌耐药中发挥重要作用,如组蛋白甲基化和去乙酰化通过调控染色质的开放状态以及DNA甲基化修饰,抑制转录因子与靶基因的结合,从而调控基因表达,调节肿瘤细胞对化疗的反应性[3]。组蛋白乙酰化水平由组蛋白乙酰化酶和组蛋白去乙酰化酶调控。组蛋白去乙酰化酶1(histone deacetylase 1,HDAC1)属于Ⅰ型组蛋白去乙酰化酶,可催化乙酰基团从组蛋白赖氨酸残基上脱落[4]。有研究发现HDAC1高表达与卵巢内膜癌和内膜样癌患者的不良预后相关[5],且在卵巢癌细胞系A2780中抑制HDAC1表达可增加其对顺铂的敏感性[6]。然而上皮性卵巢癌中约70%是高级别浆液性癌,内膜样癌较少,仅占约10%[7],且A2780细胞也不属于浆液性癌细胞[8]。因此,有必要进一步研究上皮性卵巢癌组织中HDAC1表达与化疗耐药的相关性,明确其作为化疗反应性和生存预测指标的可能性。
1 材料与方法
1.1 卵巢癌组织芯片
卵巢癌组织蜡块来自武汉协和医院组织标本库,选取2008年至2013年间在武汉协和医院妇产科经手术切除的上皮性卵巢癌样本,术前未行任何化疗或放疗,术后接受紫杉醇/卡铂3周方案化疗,临床资料完整。化疗耐药组患者定义为初次化疗出现以下情况:①化疗过程中因疾病进展而中断化疗;②完成6个疗程化疗,但未达完全缓解;③完成化疗并达完全缓解,化疗完成后6个月之内复发。化疗敏感组患者定义为:初次化疗后完全缓解,且化疗完成后6个月之内血生化、影像学、临床检查均未提示复发者。共42例符合要求的卵巢癌组织纳入组织芯片,其中敏感组27例,耐药组15例。包埋好的组织芯片蜡块行4 μm连续切片,行苏木精-伊红(HE)染色确认组织为卵巢癌后行HDAC1免疫组化染色。组织样本及患者资料的使用通过医院伦理委员会审核。
1.2 HDAC1免疫组化染色
组织芯片石蜡切片经二甲苯脱蜡后,依次在100%乙醇、95%乙醇、70%乙醇、蒸馏水中浸泡5 min,然后用PBS溶液冲洗。切片加EDTA缓冲液进行微波抗原修复。在3%过氧化氢溶液中室温孵育10 min阻断内源性过氧化物酶。抗原封闭用5% BSA,室温孵育20 min。完成封闭后的切片加抗HDAC1多克隆兔抗(Proteintech Group,美国,货号10197-1-AP,稀释度1∶100),4 ℃过夜;加150μL二抗孵育后用DAB显色,苏木精复染。每个组织随机选取3个视野在高倍镜下观察,对阳性细胞比例和染色深浅进行评分。阳性细胞比例评分:0~5%,0分;6%~33%,1分;34%~67%,2分;68%~100%,3分。染色深浅评分:无阳性染色,0分;淡黄色,1分;黄色或浅棕色,2分;深棕色,3分。每个组织的HDAC1免疫组化评分为以上两项评分的乘积。两位研究者独立评分,意见分歧时,讨论达成一致。
1.3 统计分析
用SPSS 13.0软件进行分析。敏感组和耐药组患者年龄以及HDAC1免疫组织化学评分的比较采用秩和检验,其它临床病理特征的比较采用卡方检验。用Kaplan-Meier法绘制HDAC1高表达和低表达组的无进展生存曲线和总生存曲线,并用Log-rank法检测组间差异。所有检验为双侧,以P<0.05为差异有统计学意义。
1.4 公共数据分析
在GEO数据库(https://www.ncbi.nlm.nih.gov/geo/query/acc.cgi)中搜索卵巢癌高通量mRNA测序数据集,比较HDAC1在化疗敏感肿瘤和化疗耐药肿瘤中的表达及其在浆液性卵巢癌和正常对照组织中的表达。Kaplan-Meier Plotter网站(http://kmplot.com/analysis)分析HDAC1表达与卵巢癌患者无进展生存期和总生存期的相关性[9]。在cBioPortal在线数据库(http://www.cbioportal.org/)中分析卵巢癌中HDAC1的基因组突变情况及其与基因表达水平的相关性。
2 结果
2.1 HDAC1在上皮性卵巢癌中的表达
为了检测HDAC1的表达与卵巢癌化疗耐药的相关性,我们在42例卵巢癌患者的组织芯片中用免疫组织化学法检测了HDAC1的表达水平。可见阳性染色主要位于细胞核,符合HDAC1的亚细胞定位。27例化疗敏感患者和15例耐药患者的年龄、FIGO分期、分化程度以及病理类型的差异无统计学意义(表1),而耐药组卵巢癌组织中HDAC1的蛋白表达水平显著高于化疗敏感组(P<0.01,图1)。
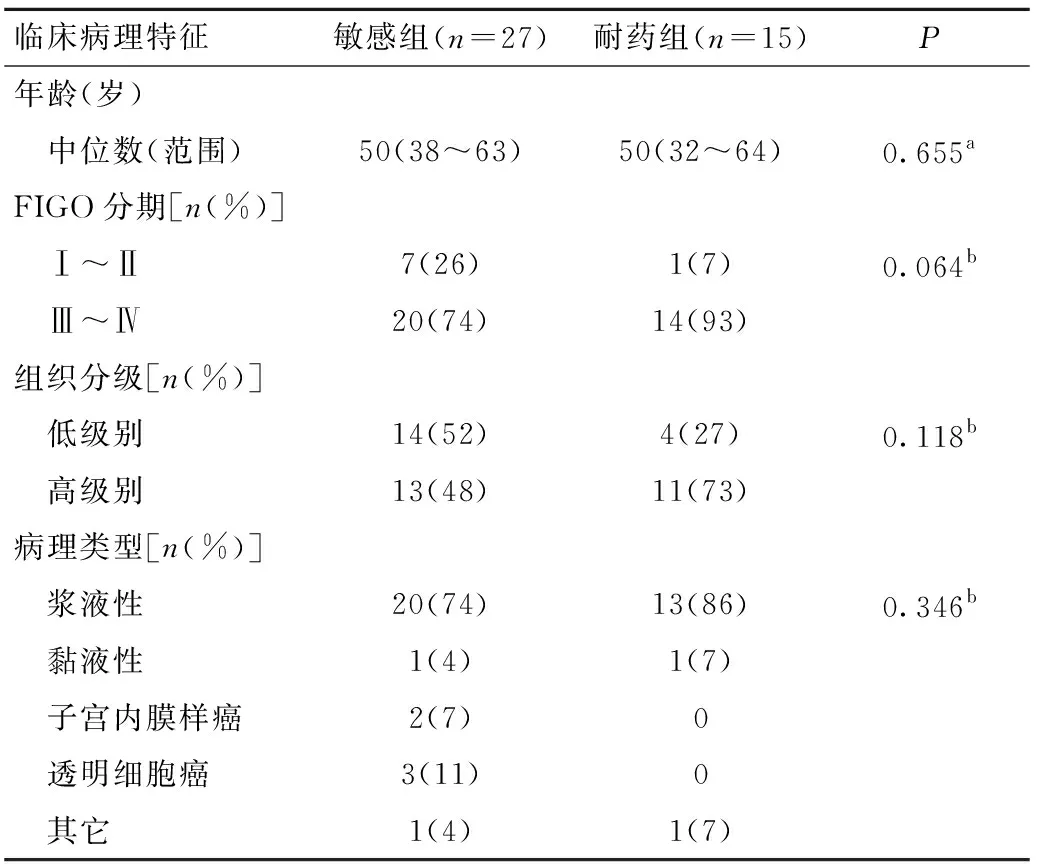
表1 卵巢癌患者的临床病理特征Table 1 The clinicopathological characteristics of ovarian cancer patients
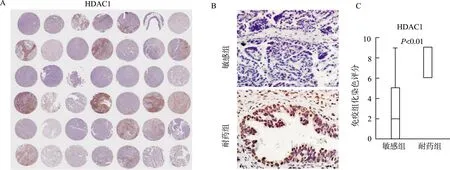
A:染色全景;B:化疗耐药组和敏感组卵巢癌的染色代表性图片(×40);C:化疗耐药组和敏感组卵巢癌的染色评分箱图图1 卵巢癌组织芯片HDAC1免疫组织化学染色Fig.1 Immunohistochemistry staining for HDAC1 in ovarian cancer tissue arrays
2.2 HDAC1表达与上皮性卵巢癌预后的关系
为进一步明确HDAC1与患者生存的相关性,我们将42名患者按照HDAC1表达水平的高低分组:免疫组织化学染色评分>3为高表达组,≤3为低表达组。生存分析显示,HDAC1高表达组患者的无进展生存期和总生存期均显著劣于低表达组患者(P无进展生存<0.01,P总生存=0.021,图2),提示HDAC1高表达预示患者的不良预后。
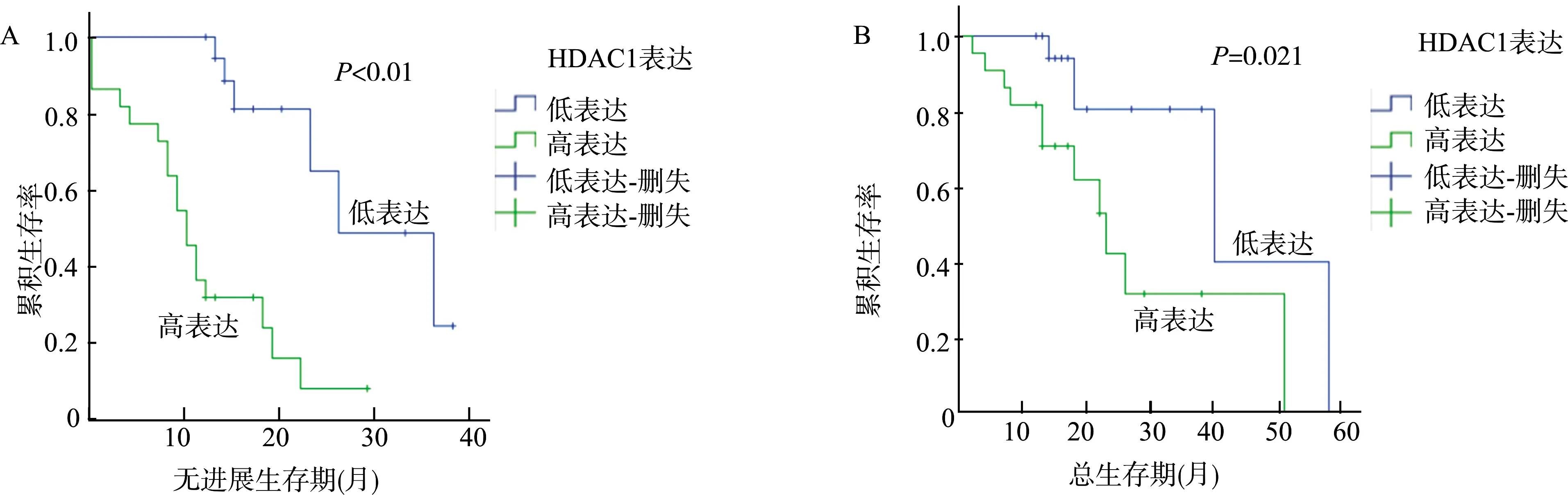
A:无进展生存期;B:总生存期;删失表示无事件(复发或死亡)发生图2 不同HDAC1表达水平卵巢癌患者的生存分析Fig.2 Analysis of the survival in ovarian cancer patients with different expression levels of HDAC1
2.3 公共数据分析HDAC1表达与卵巢癌的关系
为了在其它样本中验证上述结果,我们分析了GEO数据库中卵巢癌相关数据。在GSE12470数据集中,HDAC1在浆液性卵巢癌(n=43)中的表达较正常腹膜组织(n=10)显著升高(P<0.01,图3A)。GSE54388数据集分析也显示了类似的结果,即与正常卵巢上皮相比,HDAC1在浆液性卵巢癌中高表达(P<0.05,图3B)。GSE41499数据集分析显示,在原代卵巢癌细胞中,铂耐药细胞中HDAC1的表达显著高于铂敏感细胞(P<0.05,图3C)。Kaplan-Meier Plotter网站分析显示HDAC1表达与卵巢癌患者(n=1435)无进展生存期以及总生存期均呈显著负相关,高HDAC1表达组患者的复发和死亡风险分别升高27%(HR:1.27,95%CI:1.12~1.44,图3D)和25%(HR:1.25,95%CI:1.10~1.42,图3E)。
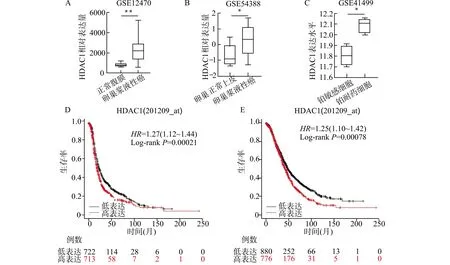
A:在GSE12470数据集中比较10个正常腹膜和43个浆液性卵巢癌组织之间HDAC1的表达差异;B:在GSE54388数据集中比较6个卵巢正常表面上皮和16个浆液性卵巢癌组织之间HDAC1的表达差异;C:在GSE41499数据集中比较4对铂敏感和铂耐药的原代卵巢癌细胞之间HDAC1的表达差异;D:Kaplan-Meier Plotter网站分析HDAC1表达与卵巢癌患者无进展生存期的相关性;E:Kaplan-Meier Plotter网站分析HDAC1表达与卵巢癌患者总生存期的相关性;*P<0.05,**P<0.01图3 公共数据集分析HDAC1在卵巢癌中的表达Fig.3 Analysis of HDAC expression in ovarian cancer using public data sets
为了初步探索HDAC1在卵巢癌中高表达的可能机制,我们在cBioPortal在线数据库(http://www.cbioportal.org/)中分析了卵巢癌患者HDAC1的基因组变异情况。结果显示,约4%卵巢癌发生HDAC1基因组变异,以扩增为主,此外还有少量结构变异、剪接突变、错义突变、深度缺失等(图4A),且基因扩增与HDAC1在肿瘤中的异常高表达相关(图4B)。
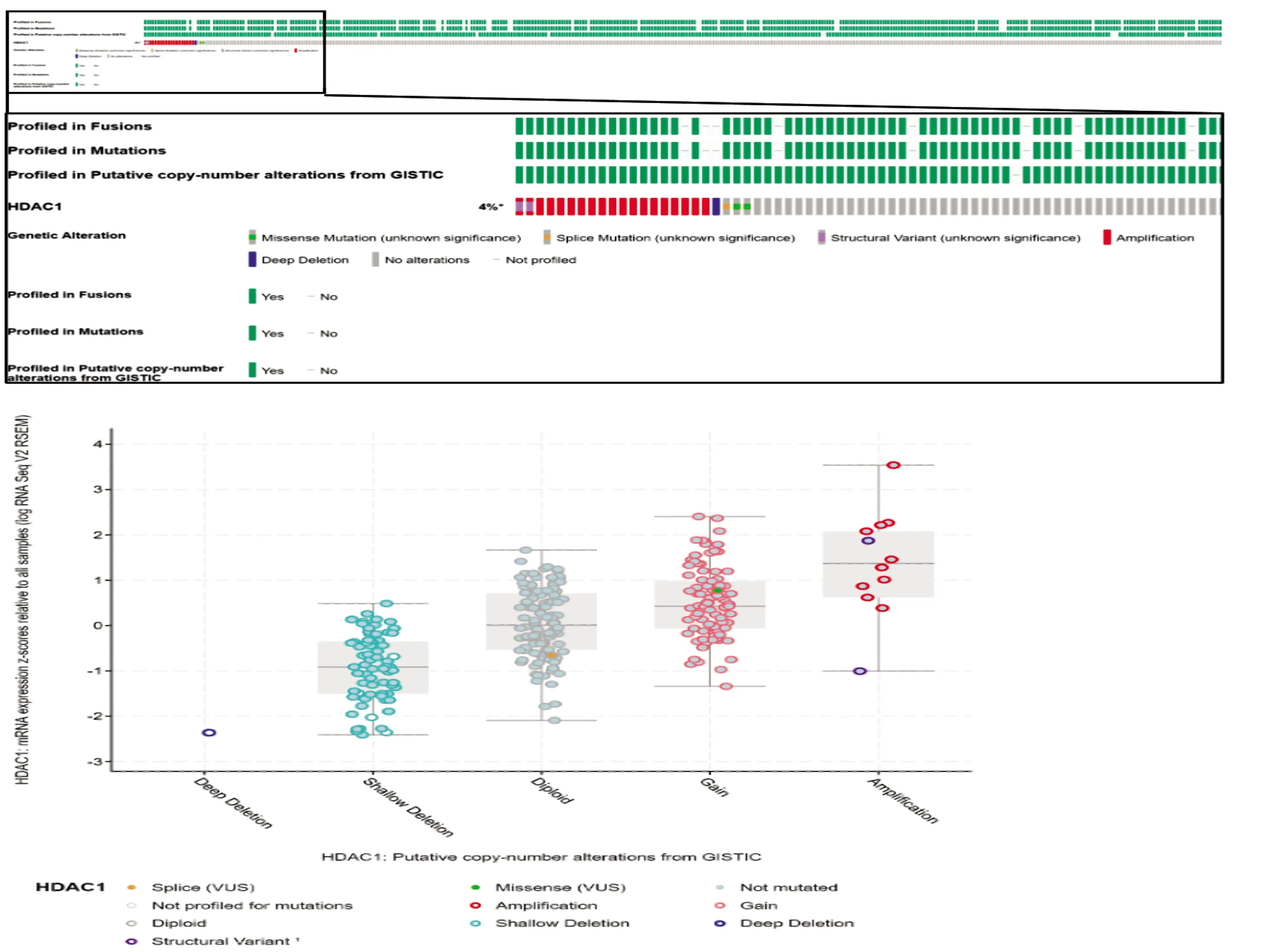
A:基因变异的种类及频率;B:基因变异类型与基因表达水平的相关性图4 cBioPortal数据库分析卵巢癌中HDAC1基因变异Fig.4 Analysis of HDAC1 gene variants in ovarian cancer based on cBioPortal database
3 讨论
尽管近年来很多新药被批准用于上皮性卵巢癌的治疗,但总体来说患者的生存状况并未得到显著改善。分子分型为内膜癌个体化治疗提供了强有力的基础[10],而卵巢癌目前尚无可用于临床的分子标记物。鉴于卡铂联合紫杉醇仍是目前一线化疗方案,本研究针对性地比较了对卡铂/紫杉醇方案化疗耐药和敏感的上皮性卵巢癌组织中HDAC1的表达,发现经免疫组化检测所得HDAC1表达水平与化疗耐药和复发呈显著正相关,其有望被用作上皮性卵巢癌化疗反应性和生存的预测指标。
在本研究所纳入的卵巢癌组织中,浆液性癌占79%,符合上皮性卵巢癌病理类型分布特点[11],同时也提示我们的结论主要适用于浆液性癌。虽然有研究报道HDAC1在卵巢内膜样癌中的表达可用于预测患者的不良预后[5],但我们的样本中仅有2例内膜样癌,因此无法验证HDAC1与卵巢内膜样癌患者生存的相关性。此外,本研究中公共数据集的分析也显示HDAC1在浆液性癌中表达显著增高,且在耐药卵巢癌细胞中表达高于敏感细胞,并与患者的不良预后相关。尽管公共数据集为mRNA表达水平数据,但我们的免疫组织化学检测结果仍然与这些数据所呈现的结果表现出良好的一致性。且基于免疫组化的评估更有利于临床转化。除了相关性研究,还有一些研究阐述了HDAC1参与耐药的机制,包括维持肿瘤干细胞功能[12]、抑制耐药相关基因Bcl-2的表达[13]等。以上结果说明HDAC1高表达与卵巢癌耐药相关,且有作为预测卡铂/紫杉醇化疗耐药的分子标记进行临床转化的潜能。
通过cBioPortal数据库分析我们发现约4%的卵巢癌中存在HDAC1基因变异,且变异类型以基因扩增为主。虽然基因扩增会导致HDAC1表达增加,但4%的频率不足以解释HDAC1在卵巢癌中的高表达。有研究发现microRNA-34a可以靶向结合HDAC1 mRNA,从而抑制其表达及卵巢癌细胞增殖[14]。在肝细胞肝癌中,DNA结合转录因子YY1可增强HDAC1的表达[15]。可见,HDAC1在卵巢癌的高表达可能是由基因水平、转录水平以及转录后水平调控机制共同作用的结果。
除了预测预后,HDAC1用于上皮性卵巢癌患者分层管理的潜在价值可能还在于指导个体化用药——对低HDAC1肿瘤优先选择卡铂/紫杉醇化疗,而对高HDAC1肿瘤可考虑更加积极的治疗。此外,HDAC1抑制或许可用于高HDAC1肿瘤的联合治疗。已有几款HDAC抑制剂被批准用于临床治疗T细胞淋巴瘤以及多发性骨髓瘤[16],但其在卵巢癌中的疗效尚不明确。在细胞和动物实验中,HDAC抑制剂不仅展示出对顺铂的增敏作用,还可使无同源重组修复缺陷的卵巢癌对PARP抑制剂敏感[17];在黑色素瘤中,抑制Ⅰ型HDAC可促进卵巢癌中CD8阳性T细胞的活化[18],并增加黑色素瘤对免疫治疗的反应性[19]。这些证据提示HDAC1检测在指导上皮性卵巢癌个体化治疗中可能具有较好的应用前景。
综上所述,本研究表明高水平的HDAC1免疫组织化学染色信号与上皮性卵巢癌(尤其是浆液性癌)卡铂/紫杉醇化疗耐药和复发显著相关,为开展HDAC1作为肿瘤分型标记的临床转化提供了依据,但其对于化疗敏感性和患者生存的预测作用以及指导个体化治疗的作用还有待在大样本的前瞻性研究中进一步验证。

