钙调蛋白介导内质网应激相关自噬促进肌修复*
史丹丹, 贺细菊, 卢 敏, 刘幸卉, 王汉琴
1湖北医药学院基础医学院,十堰 442000 2湖北医药学院附属随州医院(随州市中心医院)转化医学中心,随州 441300
内质网应激反应(endoplasmic reticulum stress,ERS)是引起特发性炎性肌病骨骼肌功能障碍的一种非免疫介导机制[1]。其是真核细胞一种保护性应激,通过激活未折叠蛋白反应(unfolded protein response,UPR)以减少胞内蛋白异常聚集,从而保护细胞。而长期、严重的ERS则会诱导细胞凋亡或死亡[2]。ERS属于一种骨骼肌的适应性反应,其诱发的UPR信号通路在决定肌细胞命运上起关键作用[3]。但骨骼肌持续而严重的ERS则可通过内质网相关性凋亡途径或自噬溶酶体途径,引起蛋白合成代谢障碍,并直接影响肌肉含量[4-7]。
肌炎患者肌细胞高表达MHC-Ⅰ分子,而高表达的MHC-Ⅰ分子可引起肌纤维内部持续的UPR[6],持续的UPR可能引起肌组织免疫耐受的缺失,但参与调节这种免疫耐受缺失的机制尚不明确。UPR将导致Ca2+代谢异常[7-8],Ca2+作为骨骼肌细胞兴奋-转录偶联的关键分子[9],即Ca2+-钙调蛋白(calmodulin,CaM)依赖性信号传导(例如,通过CaM依赖性磷酸酶、钙调神经磷酸酶、CaM依赖性激酶CaMKⅡ、CaMKⅣ等)可调节肌肉中活性基因表达,其代谢异常将触发一系列生化反应,影响细胞的生存和代谢[10]。那么,骨骼肌Ca2+/CaM信号是否参与UPR引起的自身免疫耐受的缺失?内质网作为肌细胞内重要的细胞器,是肌纤维Ca2+储存和蛋白质合成、折叠、组装的主要场所。多种生理和病理条件下,其代谢紊乱、失衡会直接导致ERS的发生[7,11]。但是,目前Ca2+/CaM信号通路与骨骼肌损伤ERS相关性自噬的关系尚缺乏研究。我们推测,肌损伤后,内质网应激活跃,钙调蛋白可能介导ERS引起细胞自噬而调节肌修复。为此,本研究利用心毒素(CTX)肌肉注射诱导急性小鼠肌损伤内质网应激模型,并以衣霉素(tunicamycin,TM)化学诱导C2C12细胞分化的肌管ERS,然后采用CaM激动剂/拮抗剂,人为激活/抑制CaM信号,检测损伤后ERS-UPR反应关键通路分子、ERS相关性自噬关键分子的表达,以期阐明Ca2+/CaM信号对内质网应激引起细胞自噬的影响及其机制。
1 材料与方法
1.1 实验动物及样品准备
选取6~8周清洁级C57BL/6(B6)小鼠,购自湖北医药学院实验动物中心。分别采用3种方式建模:①单侧胫骨前肌注射CTX 50 μL(50 μg/mL,Sigma公司)制备野生小鼠肌损伤内质网应激模型,未注射一侧作为对照;②采用TM[Cell Signaling Technology(CST)公司]腹腔注射1 mg/kg(5 mg/mL)制备小鼠内质网应激模型;③采用CTX肌肉注射配合TM腹腔注射制备野生小鼠肌损伤模型。小鼠分别在损伤后第0、4、7天处死。摘取小鼠胫骨前肌,4%多聚甲醛固定,石蜡包埋,肌组织横向切片(4 μm),苏木精-伊红染色,观察比较肌组织内炎性细胞渗出、肌纤维再生情况。另使用CTX制备野生小鼠肌损伤内质网应激模型,并于损伤后第2、5天,即取材前48 h腹腔注射CALP1(100 μL,50 μg/mL,TOCRIS公司)或R24571(150 μL,25 μg/mL,Santa Cruz公司)干预肌组织CaM活性,人为激活/抑制CaM信号。所有实验内容均获得湖北医药学院动物伦理委员会批准。收集损伤胫骨前肌,用于RNA和蛋白分析。
1.2 CaM化学干扰分化肌管
C2C12细胞(CRL-1772,ATCC公司)常规培养,当细胞生长于接近70%~80%汇合后,改用分化培养液(含2%马血清)诱导72 h,将细胞分化为多核肌管。之后,TM(1 μg/mL)刺激诱导肌管内质网应激,添加R24571(1.5 μmol/L)或CALP1(10 μmol/L)以调节培养体系中CaM活性,刺激24 h后收集细胞,分别提取RNA和蛋白,待用。
1.3 qRT-PCR检测损伤肌UPR信号通路相关分子mRNA表达
分别于0、4、7 d摘取小鼠胫骨前肌,收集CaM化学干扰分化肌管后的细胞,检测肌损伤后肌组织内及应用化学干扰CaM后损伤肌管细胞内UPR信号通路相关分子的mRNA表达。Trizol(Thermo Fisher Scientific公司)法提取肌组织或细胞总RNA,使用cDNA合成试剂盒(Thermo Fisher Scientific公司)逆转录。实时荧光定量PCR使用特定引物,SYBR荧光染料/ROX标记的qPCR混合液试剂盒(Thermo Fisher Scientific公司),BIO-RAD CFX96 touch荧光定量PCR仪(Bio-Rad公司),根据说明书配制PCR反应液,采用两步法PCR扩增标准程序。检测各组肌组织UPR信号通路相关分子(BiP、XBP1-S和ATF6)的mRNA表达情况(引物序列见表1),用GAPDH作为内参对照。结果用Bio-Rad CFX Manager Software v3.1(Bio-Rad公司)软件分析。引物序列根据GenBank上小鼠碱基序列,由上海生工生物技术有限公司合成。采用2-ΔΔCt法确定特定荧光域值对应循环数的Ct值,对每个目标进行基因定量。实验重复至少3次,取平均值。

表1 qRT-PCR引物序列Table 1 Primer sequences for qRT-PCR
1.4 Western blot检测UPR-自噬通路关键分子表达
全蛋白提取采用蛋白提取试剂盒(南京凯基生物公司),以BCA测定试剂盒(南京凯基生物公司)测定蛋白质含量后分装。蛋白提取物煮沸3~5 min,经6%~12%SDS-PAGE电泳分离后转膜,用TBST配制含5%脱脂奶粉的封闭液分别稀释抗GAPDH抗体(1∶4000,杭州弗德生物公司)、抗eIF2α抗体(1∶1000,CST公司)、抗p-eIF2α抗体(1∶1000,CST公司)、抗IRE1α抗体(1∶1000,CST公司)、抗p-IRE1α抗体(1∶1000,CST公司)、抗ATF6抗体(1∶1000,CST公司)、抗LC3Ⅱ/Ⅰ抗体(1∶1000,CST公司),一抗4 ℃孵育过夜,次日TBST洗膜,用相应辣根过氧化物酶(HRP)标记二抗(杭州弗德生物公司)室温孵育1.5 h,最后以ECL发光法检测蛋白表达情况,用Image J软件进行分析。
1.5 统计学方法
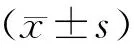
2 结果
2.1 急性损伤肌组织HE染色观察肌组织损伤情况
构建易于观察、可控制、可复制的动物损伤模型是研究骨骼肌损伤的首要环节[12]。本研究最初选用3种不同方法构建了肌损伤小鼠模型,通过HE染色结果,可以观察到与对照组(control组)比较,单纯胫骨前肌注射心毒素(CTX组)和CTX肌内注射联合衣霉素(CTX+TM组)腹腔注射小鼠均于损伤后4 d出现胫骨前肌肌纤维坏死和溃变,且伴大量炎性细胞浸润;损伤肌纤维逐渐被中央核的再生肌纤维替代,且在损伤后7 d肌纤维再生显著,炎性细胞渗出明显减少(图1)。与其他两组不同,衣霉素腹腔注射(TM组)小鼠则表现为炎性渗出与再生均不明显。与正常对照组比较,TM组则可见肌细胞间隙增大,偶有炎性细胞渗出(图1)。这说明单纯CTX注射和CTX联合TM注射均可引起典型的肌肉损伤。
图1 3种小鼠肌损伤模型苏木精-伊红染色结果(标尺=50 μm)Fig.1 HE staining for three mouse models of muscle injury(scale bar=50 μm)
2.2 qRT-PCR检测损伤肌UPR关键分子mRNA水平
为了确认UPR在肌组织损伤再生修复过程中是否被激活,采用实时荧光定量PCR(qRT-PCR)检测肌损伤后4、7 d各组胫骨前肌UPR关键分子Bip、ATF6和XBP1-S mRNA水平。结果显示:与control组相比,损伤后4 d,CTX组和CTX联合TM注射组Bip、ATF6和XBP1-S mRNA水平均显著上调;CTX组UPR关键分子mRNA水平随再生修复过程而逐渐下降;而TM组Bip和ATF6 mRNA水平则随损伤修复而逐渐升高(图2)。
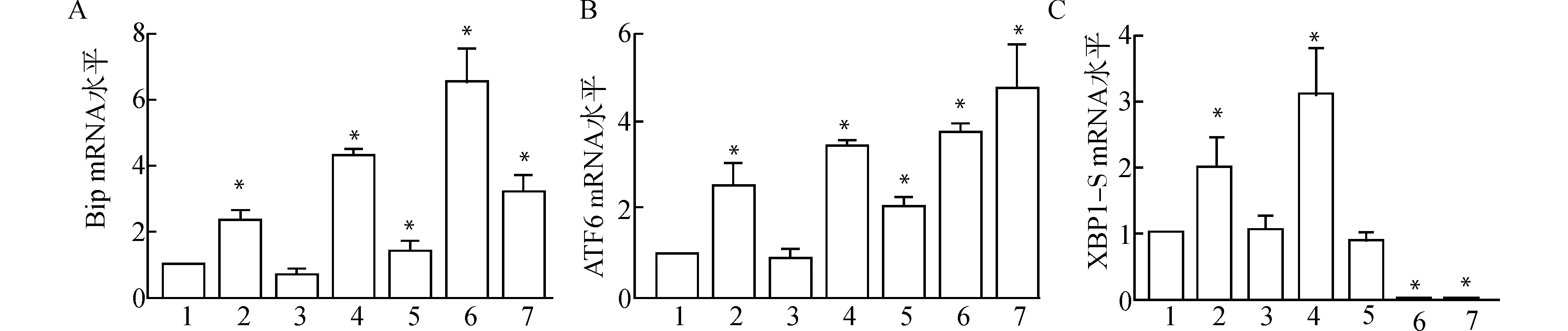
1:control;2:CTX d4;3:TM d4;4:CTX+TM d4;5:CTX d7;6:TM d7;7:CTX+TM d7;A:Bip mRNA水平;B:ATF6 mRNA水平;C:XBP1-S mRNA水平;与control组比较,*P<0.05图2 损伤后各组肌组织UPR信号通路相关分子mRNA水平Fig.2 The mRNA levels of UPR pathway related molecules in muscle tissues after injury
2.3 CaM对肌损伤后肌内UPR标志物mRNA表达水平的影响
为了探究Ca2+/CaM信号是否参与肌损伤后UPR标志物表达,我们选用CTX诱导肌损伤模型,取材前48 h腹腔注射CaM激动剂CALP1或抑制剂R24571干预肌组织CaM活性水平,人为激活/抑制Ca2+/CaM信号通路,qRT-PCR检测肌损伤后4、7 d各组胫骨前肌UPR关键分子mRNA水平。结果显示(图3):与control组比较,CTX诱导肌损伤后4 d,Bip、ATF6和XBP1-S mRNA水平显著上调(均P<0.05);损伤后7 d转录水平下调,除XBP1-S与control组无差异外,Bip和ATF6转录水平仍显著高于control组(P<0.05)。与CTX组比较,不论肌损伤后4 d还是7 d,CALP1处理均可上调损伤肌内UPR标志物mRNA水平,R24571均可降低损伤肌内UPR标志物mRNA水平(P<0.05)。这提示Ca2+/CaM信号可能参与了肌损伤后UPR标志物的表达。

1:control;2:CTX d4;3:CTX+CALP1 d4;4:CTX+R24571 d4;5:CTX d7;6:CTX+CALP1 d7;7:CTX+R24571 d7;A:Bip mRNA水平;B:ATF6 mRNA水平;C:XBP1-S mRNA水平;与control组比较,*P<0.05;与同时点CTX组比较,#P<0.05图3 CaM干扰影响损伤肌组织内UPR标志分子mRNA表达Fig.3 CaM interference affects the mRNA expression of UPR marker molecules in injured muscle
2.4 CaM对内质网应激肌管内UPR信号相关分子mRNA表达水平的影响
为了进一步分析Ca2+/CaM信号对肌细胞本身内质网应激下活化的UPR信号的影响,在TM刺激分化的肌管中,我们采用CaM激动剂CALP1或抑制剂R24571人为激活/抑制Ca2+/CaM信号,qRT-PCR检测各组肌管内UPR关键分子mRNA水平。结果表明(图4):与马血清(horse serum,HS)诱导分化的肌管比较,TM诱导ERS后,UPR标志分子Bip、ATF6和XBP1-S的mRNA水平显著上调;与TM组比较,CALP1处理均可上调ERS肌管UPR标志物mRNA水平,R24571则可下调其mRNA水平。这些结果提示:Ca2+/CaM信号参与了肌损伤内质网应激后UPR信号相关分子表达的调整。
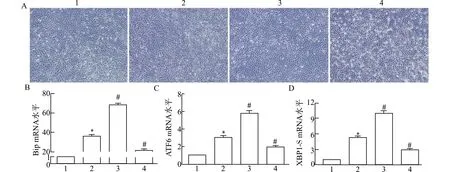
1:HS;2:TM;3:TM+CALP1;4:TM+R24571;A:各组肌细胞形态(×40);qRT-PCR检测各组肌管内UPR关键分子Bip(B)、ATF6(C)和XBP1-S(D)mRNA水平;与HS组比较,*P<0.05;与TM组比较,#P<0.05图4 CaM干扰影响TM刺激分化肌管中UPR信号相关分子mRNA表达Fig.4 CaM interference affects the mRNA expression of UPR pathway related molecules in differentiated myotubes stimulated by TM
2.5 CaM对损伤肌UPR-自噬通路关键分子表达的影响
为探究Ca2+/CaM信号是否介导损伤肌内质网应激相关自噬,采用CTX诱导B6小鼠肌损伤,于取材前48 h腹腔注射CaM激动剂CALP1或抑制剂R24571人为激活/抑制Ca2+/CaM信号,Western blot检测内质网应激UPR-自噬通路关键分子eIF2α、IRE1α和ATF6的表达情况。结果显示(图5):与对照组比较,肌损伤4 d后,UPR-自噬通路关键分子eIF2α、IRE1α磷酸化显著增加,ATF6表达明显上调(P<0.05),除ATF6外,其上调趋势持续至损伤后7 d;CALP1或R24571处理可进一步促进或抑制此反应(均P<0.05)。这提示,Ca2+/CaM信号与内质网应激UPR-自噬通路存在相关性,参与了UPR引起的自噬。
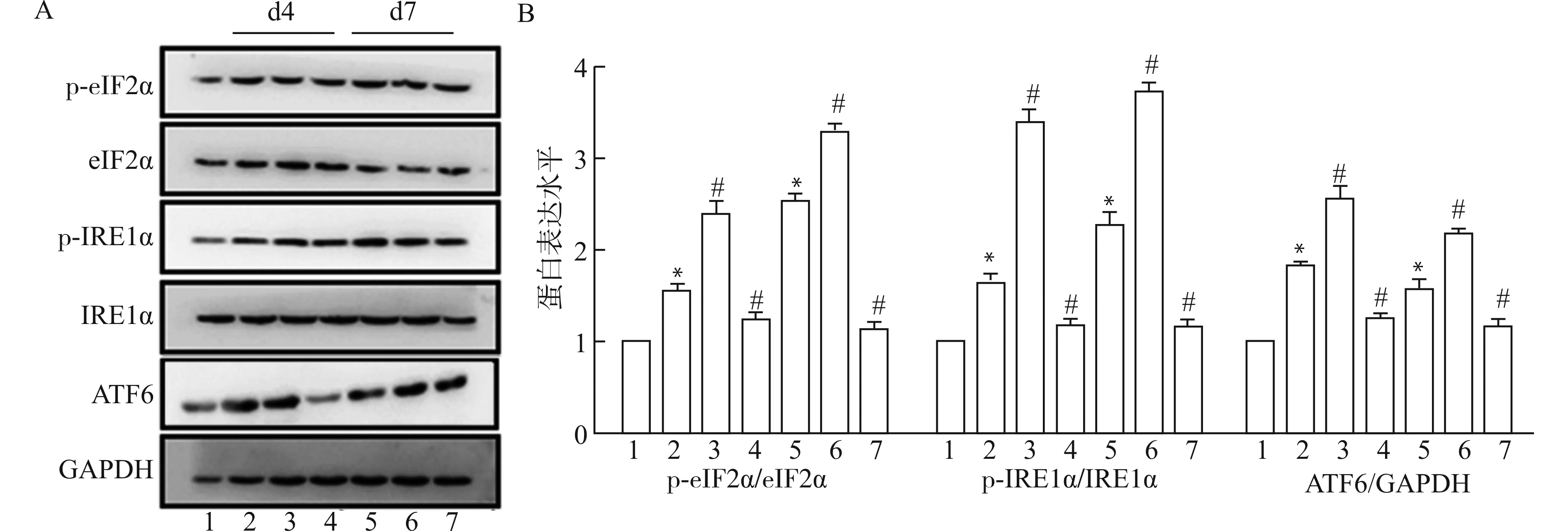
1:control;2:CTX d4;3:CTX+CALP1 d4;4:CTX+R24571 d4;5:CTX d7;6:CTX+CALP1 d7;7:CTX+R24571 d7;A:Western blot检测CaM干扰后损伤肌UPR-自噬通路关键分子eIF2α、IRE1和ATF6的表达;B:蛋白灰度值统计图;与control组比较,*P<0.05;与同时点CTX组比较,# P<0.05图5 CaM干扰影响损伤肌UPR-自噬通路关键分子Fig.5 CaM inference affects the expression of key molecules of UPR-autophagy pathway in injured muscles
2.6 CALP1对内质网应激肌管自噬蛋白的影响
为进一步明确Ca2+/CaM信号是否对内质网应激肌管自噬蛋白表达有影响,在TM刺激下,采用CaM激动剂CALP1人为激活Ca2+/CaM信号,Western blot检测各组肌管内ERS相关自噬关键分子eIF2α、IRE1α和ATF6及自噬蛋白LC3的表达。结果(图6)显示:TM诱导肌细胞ERS后,肌管内ERS相关自噬关键分子eIF2α、IRE1α磷酸化增加,ATF6及自噬蛋白LC3的表达显著增多,CALP1处理可进一步增强此效应。这提示肌细胞发生内质网应激时,可能通过启动ERS相关性自噬来促进肌修复。
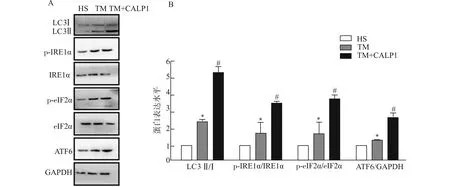
A:Western blot检测CALP1干扰后内质网应激肌管内UPR-自噬通路关键分子LC3、eIF2α、IRE1和ATF6的表达;B:蛋白灰度值统计图;与HS组比较,*P<0.05;与TM组比较,#P<0.05图6 CALP1影响内质网应激肌管自噬蛋白的表达Fig.6 CALP1 impacts the expression of autophagy proteins in ERS myotubes
3 讨论
肌肉损伤研究的基础是构建出一种简便、稳定、高效的肌损伤模型[12]。结合苏木精-伊红染色镜检和qRT-PCR结果综合分析,本研究后续实验选择CTX肌内注射建立骨骼肌损伤内质网应激模型。Ca2+/CaM信号在免疫和炎症反应中的作用已被广泛研究,并且临床中使用的抗炎钙调蛋白拮抗剂也有一定的进展,然而肌肉损伤后Ca2+/CaM信号是否参与UPR引起的自身免疫耐受的缺失罕有研究。
内质网应激是骨骼肌的一种适应性机制[6]。在生理或病理情况下,肌纤维可能存在蛋白合成需求增加、钙离子代谢异常或者错误折叠蛋白聚集,肌纤维的内质网稳态失衡,导致UPR启动,以缓解内质网应激并保证肌细胞的生存,而持续激活的UPR可启动凋亡、炎症等信号通路,导致肌组织产生异常病理改变[4-6]。本研究利用CTX诱导肌损伤,检测内质网应激诱发的UPR标志分子Bip、ATF6和XBP1-S mRNA水平。可见其于损伤后4 d明显上调,随修复而逐渐消退,初步证实UPR在肌组织损伤再生修复过程中是被激活的。这与前人报道是一致的[13-15]。由此可见,内质网应激激活的UPR可促进肌肉修复。同时,UPR的及时消退有利于组织修复完成以及炎症的消退。
为明确Ca2+/CaM信号对肌细胞内质网应激下活化的UPR信号的影响,本研究进一步利用肌损伤内质网应激的体内外模型,采用CALP1和R24571干扰肌内CaM活性。结果表明,与对照组比较,肌损伤后,Bip、ATF6和XBP1-S mRNA水平显著上调;与单纯损伤组比较,CALP1处理可上调损伤肌内UPR标志物mRNA水平,R24571可下调损伤肌内UPR标志物mRNA水平。自噬在维持骨骼肌稳态和功能方面起重要调控作用[16-17],ERS时诱发的UPR信号通路参与了肌细胞自噬的调控过程[4,6]。C2C12细胞来源于骨骼肌卫星细胞,可在2%马血清作用下诱导分化形成肌管,是理想的研究肌细胞发育分化的模型[18]。因此体外实验选择C2C12细胞分化肌管。在持续的促炎环境中,激活的UPR信号分子有助于抑制肌纤维的免疫功能[14]。那么Ca2+/CaM信号是否参与骨骼肌损伤内质网应激UPR相关性自噬以破坏UPR引起的自身免疫耐受成为关注的焦点。而我们检测到肌损伤后,内质网应激相关性自噬3条通路关键性分子eIF2α、IRE1α磷酸化水平和ATF6蛋白表达水平均显著变化,提示应用CaM干扰剂可以引起通路变化和影响自噬标志物LC3Ⅱ/Ⅰ水平。
综上,急性肌损伤后内质网应激活跃,CaM信号参与了UPR,其可能通过调节ERS相关性自噬缓解肌损伤以促进肌修复的过程。但在此过程中,具体将通过下游哪些信号影响和调节自噬还需进一步的实验验证。

