内源性逆转录病毒基因HRES1/p28的表达与系统性红斑狼疮临床特征的相关性*
许敏玲, 陈 桃, 蔡 琪
南方医科大学附属小榄医院风湿免疫科,中山 528415
系统性红斑狼疮(systemic lupus erythematous,SLE)是一种慢性的自身免疫性疾病,表现为T淋巴细胞、B淋巴细胞、巨噬细胞和树突状细胞的功能异常,并有自身抗体的产生。流行病学研究和全基因组关联分析都显示了SLE具有显著家族遗传倾向[1]。在人类基因组上广泛存在与逆转录病毒同源的DNA序列,被命名为人类内源性逆转录病毒(human endogenous retroviruses,HERVs)序列。大部分HERVs序列大约在1000万年~5000万年前开始出现在人类基因组中,这些内源性逆转录病毒序列不产生感染性病毒,过去这些序列被认为是垃圾DNA。然而,越来越多的研究证实它们的异常表达与肿瘤、自身免疫性疾病等相关[2-4]。HERVs序列活化产生的蛋白质可能在自身免疫性疾病如SLE的发病中起重要作用[4-6]。在众多HERVs序列中,HRES1(HTLV-I-related endogenous retroviral sequence,HRES1)是首个被发现的可表达病毒蛋白的序列,也是大多数HERVs的原型。与其它HERVs序列不同,HRES1序列仅有1个拷贝,位于人类染色体1q42。在HRES1正反义序列中具有多个开放读码框。其中正义链上具有编码28 kD核蛋白(HRES1/p28)的转录子;而在反义链中HRES1序列可编码Rab4a基因,被命名为HRES1/Rab4。近年来在SLE患者血清中发现了HRES1/p28的表达增加[7],患者血清与HRES1/p28表达的同源多肽具有交叉抗原反应[8-10]。然而,HRES1/p28的表达与SLE病情严重程度的相关性仍然未知,尤其在中国汉族人群中,尚未见任何相关报道。本研究通过检测SLE患者外周血单核细胞(peripheral blood monouclear cell,PBMC)中HRES1/p28基因转录水平,探索汉族人群SLE患者HRES1/p28基因转录水平改变与临床表征的相关关系,为SLE的诊断、治疗、预后判断等提供线索。
1 材料与方法
1.1 研究对象
研究对象为2016年11月至2019年12月间南方医科大学附属小榄医院门诊和住院收治的SLE患者,共计47例,所有病例均符合1997年美国风湿病学会(ARA)修订的SLE诊断标准。所有SLE患者均进行了常规临床症状调查、检测指标的测定,并根据2000年改进的SLE疾病活动指数(SLE-DAI-2000)评分法评价SLE患者疾病活动程度[11]。其中活动期患者20例,诊断依据为典型的临床表现、异常的实验室指标及SLE-DAI≥10分;非活动期患者17例,SLE-DAI为5~9分;缓解期患者10例,SLE-DAI为0~4分。另选取13例健康体检者的抗凝外周静脉血标本作为对照组,均排除SLE、其他自身免疫性疾病和慢性炎症性疾病,其中女性12例,男性1例,年龄(32.3±5.2)岁,性别、年龄结构与入组SLE患者无显著差异。研究对象全部知情同意并签署知情同意书,医院伦理委员会批准开展此项研究。
1.2 临床资料
采集每位患者的病史、体检和实验室检查资料,见表1。其中临床表现记录关节炎、盘状皮损、蝶形红斑、光敏、肾脏损害、血管炎等。实验室检查包括血细胞分析、尿液分析、自身抗体[包括抗核抗体(ANA)、抗dsDNA抗体、抗Sm抗体]以及IgG、C3和C4。根据临床表现和实验室检查判断是否存在皮肤、关节和肾脏损害。合并皮肤损害定义为至少有1项皮肤病变指标(包括盘状皮损、蝶形红斑、光敏);合并关节损害定义为至少有1项关节病变的临床指标(包括关节疼痛、僵硬、变形及周围软组织肿胀等症状,或关节病变的影像学诊断);合并肾脏损害定义为至少有1项异常检测指标(包括血肌酐、血尿素、尿红细胞和尿蛋白)。

表1 入组SLE患者的临床表征Table 1 Demographic and clinical characteristics of SLE patients
1.3 外周血淋巴细胞的分离和RNA提取
抽取SLE患者和正常人外周血6 mL,EDTA抗凝,取4 mL缓慢加入淋巴细胞分离液(达科为公司产品)中,采用Ficoll密度梯度离心法分离中间层PBMC,转入离心管,-80 ℃保存备用。细胞总RNA的提取采用Qiagen RNA mini kit试剂盒(科海生物提供),根据说明书进行,抽提的总RNA以DNaseⅠ消化,再以氯仿-异丙醇提取,得到的RNA以DEPC水溶解。用紫外分光光度计测定RNA浓度及纯度,用凝胶电泳法检测RNA的完整性。
1.4 HRES1/p28基因表达的检测
将提取总的RNA使用反转录试剂盒(日本TaKaRa公司)进行反转录。取1 μL提取的RNA以Oligo dT进行逆转录。反应条件为:42 ℃ 60 min,75 ℃ 15 min,反转录生成的cDNA于-80 ℃保存备用。使用SYBR试剂(日本TaKaRa公司)进行实时定量PCR反应,采用7500 Real-time PCR System(美国ABI公司)检测HRES1/p28基因的转录水平,以β-actin为内参照。引物由上海生工生物工程技术服务有限公司合成。HRES1/p28:正向引物5′-GGAAGAGGAGATGGGCTACG-3′;反向引物5′-CAGGGAAATCGGGACTCAG-3′,产物193 bp。β-actin:正向引物5′-GCACCACACCTTCTACAATGAGC-3′;反向引物5′-GGATAGCACAGCCTGGATAGCAAC-3′,产物156 bp。PCR反应扩增条件:94 ℃预变性5 min,50个循环(94 ℃,变性30 s;55 ℃,退火30 s;72 ℃,延伸30 s)。每轮PCR反应重复2次。根据待测标本的Ct值,以β-actin为内参照,采用相对定量法,以2-ΔΔCt表示标本中HRES1/p28基因相对表达量。为了显示与正常健康对照组的变化比例,所有HRES1/p28相对表达量值被除以正常对照组的均值,进行标准化计算。
1.5 酶联免疫吸附试验法(ELISA)测定血浆中细胞因子浓度
取EDTA抗凝外周血,离心取上清,-80 ℃分装保存。采用双抗体夹心ELISA法检测细胞因子(包括IFNγ、IP-10、TNFα、IL-1β),试剂盒购自荷兰HyCult Biotechnology公司。严格按照试剂盒说明书进行检测,设立双标准曲线计算待测样本中各细胞因子浓度。
1.6 统计学分析
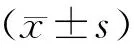
2 结果
2.1 HRES1/p28基因在SLE患者和健康对照组PBMC的转录水平
反转录PCR显示HRES1/p28基因在健康对照组和SLE患者组的PBMC细胞中均有表达。通过定量PCR测定HRES1/p28基因的转录水平,与健康对照组相比,SLE患者的转录水平增高至146.3%,差异有统计学意义(P=0.004,图1)。利用ROC曲线评价HRES1/p28基因转录水平对SLE诊断的意义,结果显示ROC曲线下面积为(0.751±0.088)(P<0.01),提示HRES1/p28基因转录水平测定对SLE具有诊断意义(图2)。

图1 荧光定量PCR检测SLE患者PBMC的HRES1/p28基因转录水平Fig.1 Quantification of the HRES1/p28 mRNA expression in the PBMCs isolated from SLE patients using real-time PCR

图2 HRES1/p28基因转录水平对诊断SLE的ROC曲线分析Fig.2 ROC curve analysis of the HRES1/p28 mRNA expression level in SLE patients
2.2 SLE患者PBMC的HRES1/p28基因转录水平与SLE活动指数的关系
按病情活动指数将患者分为3组:缓解组(SLE-DAI 0~4分),非活动组(SLE-DAI 5~9分)和活动组(SLE-DAI≥10分)。SLE活动组的HRES1/p28基因相对转录水平显著高于健康对照组、缓解组以及非活动组(均P<0.01,图3A),而非活动组、缓解组和健康对照组之间差异无统计学意义(P>0.05)。将SLE组PBMC的HRES1/p28基因相对转录水平与SLE活动指数制作散点图(图3B),显示二者具有正相关关系(Pearson相关系数为0.678,P<0.01)。

A:不同SLE活动指数患者HRES1/p28基因转录水平的比较;B:线性回归分析SLE活动指数与HRES1/p28基因转录水平的相关关系图3 SLE病情活动度与PBMC细胞HRES1/p28基因转录水平的关系Fig.3 Relationship between SLE-DAI and the HRES1/p28 mRNA expression level in the PBMCs
2.3 HRES1/p28基因转录水平与血浆细胞因子浓度的关系
利用ELISA测定健康对照组和SLE组血浆IFNγ、IP-10、TNFα、IL-1β的浓度。如图4所示,健康对照组和SLE组的细胞因子浓度差异均无统计学意义(均P>0.05)。然而,根据测定HRES1/p28基因转录水平的中位数值将健康对照组和SLE组进一步分为HRES1/p28高表达组和低表达组,我们发现SLE患者中HRES1/p28高表达组的血浆IP-10和TNFα浓度均显著高于RES-1/p28低表达组(均P<0.01)。对SLE患者和健康对照组的整体数据进行Pearson相关分析显示血浆IP-10和TNFα浓度与HRES1/p28转录水平的相关性具有统计学意义(P<0.01,图5),提示HRES1/p28转录水平与血浆IP-10和TNFα浓度呈正相关关系。为了进一步比较SLE患者中不同细胞因子浓度与HRES1/p28转录水平的关联度,我们进行多元线性回归分析。多元线性回归显示具有良好的拟合优度(确定系数R2=0.533),影响SLE患者HRES1/p28转录水平的主要细胞因子依次为血浆IP-10、TNFα和IFNγ浓度(偏相关系数分别为0.553、0.369和0.345,均P<0.05,表2)。

依HRES1/p28表达中位数值将健康对照组和SLE组进一步分为HRES1/p28高表达组和低表达组,分别利用两独立样本t检验比较组间血浆细胞因子IFNγ(A)、IP-10(B)、TNFα(C)、IL-1β(D)的浓度;a:健康对照组与SLE组比较图4 血浆中细胞因子浓度与PBMC中HRES1/p28转录水平的相关性Fig.4 Relationship between plasma cytokine levels and the HRES1/p28 mRNA expression level in the PBMCs

图5 线性回归分析血浆细胞因子IP-10(A)、TNFα(B)与PBMC表达HRES1/p28的相关性Fig.5 Linear regression analysis between plasma IP-10(A)/TNFα(B) levels and the HRES1/p28 mRNA expression level in the PBMCs

表2 多元线性回归分析SLE患者HRES/p28转录水平与不同血浆细胞因子的关联度Table 2 Association between concentration of different serum cytokines and the HRES1/p28 mRNA expression level analyzed by multiple linear regression
2.4 SLE患者临床表征与HRES1/p28基因转录水平的关系
将SLE患者按照多系统损害的特征和抗体检测结果进行分层研究,探讨HRES1/p28基因转录水平改变是否存在特异性的改变。如表3所示,根据临床特征归类和抗体阳性指标进行比较,结果显示SLE组中具有关节病变特征的患者,其PBMC细胞的HRES1/p28基因转录水平显著高于无关节病变的患者(P<0.01),肾脏损害阳性组也显著高于阴性组(P<0.01)。抗dsDNA、抗Sm抗体、补体和IgG的阳性患者PBMC细胞的HRES1/p28基因转录水平与阴性患者差异无统计学意义(均P>0.05)。
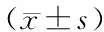
表3 不同临床表征分组患者HRES1/p28 mRNA表达的差异Table 3 Differences in the HRES1/p28 mRNA expression between the subgroups of SLE patients classified with specific clinical manifestation
3 讨论
SLE属于多因素复杂性的疾病,其病因复杂,涉及多种环境和遗传因素,然而其遗传本质至今尚不清楚。有研究认为,免疫系统表观遗传稳态的紊乱可引起基因异常表达,进一步引发免疫功能紊乱和加剧免疫性疾病的发生发展[1,12]。HERVs序列源于病毒,表达的蛋白与病毒蛋白具有一定相似性。病毒感染形成的抗体与内源性表达的HERVs蛋白可形成交叉免疫反应。因此,HERVs序列活化可能在自身免疫性疾病如SLE的发病中起重要作用[4,13-15]。以往的研究在SLE患者的器官和血清中发现了内源性逆转录病毒成分的抗原、抗体[3,8];电镜观察SLE患者的器官可发现逆转录病毒颗粒[1];而逆转录病毒成分可以诱导出SLE样的免疫异常[5]。这些研究结果提示HERVs的活化表达是SLE发病的重要机制之一。
HRES1序列属于HERVs,但具有一定的独特性。HRES1基因序列活化也可能参与SLE的发病过程。近年研究中多个证据显示HRES1与SLE相关,其中包括:①HRES1编码蛋白p28(HRES1/p28)被发现与SLE的自身免疫反应有关,52%的SLE患者血清被发现具有抗HRES1的抗体,而在正常人群中仅有3.6%的阳性率[2,8,10];②HRES1的反义链可编码HRES1/Rab4蛋白,可调节CD4的细胞表面表达,HRES1/Rab4蛋白在SLE患者中表达显著增加[16];③有研究显示HRES1的长末端重复序列(LTR)和启动子区域的多态性与SLE相关[7,17];④HRES1位于SLE相关基因的热点区域(染色体1q42)[18]。
本研究发现在分离的PBMC细胞中,SLE患者的HRES1/p28转录水平较健康对照组显著增高(P<0.01),结果与既往在SLE患者B淋巴细胞所发现的HRES1/p28表达增高一致[7]。然而,由于HRES1/p28序列编码的病毒样蛋白特异性低,表达量少,无法检测[16,19],现有研究仅发现转录水平的表达增加。SLE患者中HRES1/p28的表达水平增高,可能与抗HRES1的自身抗体形成有关[7]。位于HRES1基因的LTR是HRES1重要的启动子区域,研究显示,SLE患者在HRES1基因LTR上的低甲基化与HRES1/p28的表达水平增高有关[7]。近年来的研究结果表明,免疫细胞DNA的普遍低甲基化参与自身免疫的发生,与SLE的发病密切相关。SLE的病情与DNA甲基化水平、DNA转甲基酶表达和促分裂原活化蛋白激酶系统活性相关[1,14,20]。本研究发现SLE活动指数与HRES1/p28的转录水平具有一定的正相关关系,活动期的表达显著高于非活动期,进一步提示HRES1/p28的表达与SLE的病情相关。SLE患者组织损伤和功能失调被认为主要通过免疫复合物的沉积,并诱导多种活性介质(譬如细胞因子)的产生。我们发现HRES1/p28转录水平增高不但与SLE活动指数呈正相关,还与趋化因子IP-10、TNFα具有显著的正相关关系。趋化因子IP-10又称干扰素诱导蛋白,是由IFNγ诱导T细胞、B细胞、巨噬细胞、树突细胞等分泌,具有促进炎症细胞和淋巴细胞募集、介导多种细胞因子的作用。在HRES1/p28 mRNA的高表达组IP-10显著增高,而IFNγ也具有增高的趋势。针对汉族人群中的SLE患者的细胞因子检测中也发现以IP-10增高最为显著[21]。血浆细胞因子的浓度与多种因素有关,既往研究显示血浆IP-10、TNFα的浓度与SLE病情活动情况有关[22]。与上述结果一致,本研究发现SLE病情活动状态与细胞因子IP-10、TNFα的增高具有显著的相关性,并与HRES1/p28 mRNA水平的增高也显著相关。我们推测HRES1/p28的过度表达可能促进抗HRES1/p28自身抗体的形成,诱发免疫应答和细胞因子释放,是SLE发病机制之一。HRES1/p28过度表达相关的SLE可能具有特定的临床特征。对SLE的临床资料进行分层分析,我们比较皮肤损害、关节病变、肾脏损害和不同抗体阳性分类,结果发现关节损害、肾脏损害与HRES1/p28的表达相关。既往研究显示,SLE患者血清中抗HRES1自身抗体与抗RNP抗体的出现具有相关关系,而抗HRES1抗体阳性的SLE患者往往呈现Sm、Ro、La抗体阴性[8],提示抗HRES1自身抗体产生可能是SLE的独立病因之一。此外,在HRES1单核苷酸多态型(SNP)研究中也发现,HRES1基因型在SLE患者中分布具有显著的倾向性。不同的基因型与SLE患者的临床表现具有一定的相关关系[23]。HRES1的位点653C/1259C基因型与肾脏损害具有相关关系,而与神经系统损害、皮肤损害、关节损害无关[17,24-25]。HRES1的表达具有显著的组织和细胞特异性,不同组织细胞的HRES1表达差异可能是导致系统选择性损害的原因。
虽然越来越多的研究显示HRES1与SLE的发生具有密切的联系,然而HRES1的表达调控错综复杂,抗HRES1抗体的形成需要不同的基因背景和环境条件。有关HRES表达与SLE关系仍不清楚。本研究在汉族人群中证实了在SLE患者中HRES1的转录水平增高,并且与SLE的病情活动程度、血浆细胞因子水平具有正相关关系,而且主要发生在具有关节病变和肾脏损害的SLE患者中。然而,HRES1的转录水平与蛋白表达,抗HRES1/p28抗体的相关关系,以及组织差异性等问题仍有待进一步的研究。

