HBeAg对单核细胞来源树突状细胞TLR4及MAPK信号通路的影响
燕飞 汤永志 朱坚胜 陈华忠 朱敏 刘均艳
尽管乙肝疫苗已得到有效推广和应用,但全球HBV感染患者仍有约2.5亿例[1]。肝脏是HBV感染的主要靶器官,慢性肝炎可最终发展为纤维化、肝硬化,甚至发生肝细胞癌(hepatocellular carcinoma,HCC)[2]。然而,由于感染肝细胞中存在稳定的共价封闭环状DNA,HBV很难实现完全根除[3]。研究表明,HBV感染后,机体针对HBV的先天免疫反应和CD8+T细胞反应失调,引起抗病毒免疫反应受损,是导致病毒无法清除并持续感染的重要原因[4]。慢性HBV感染患者的多种免疫功能出现异常,如细胞毒性T淋巴细胞功能下降、调节性T细胞功能增强、树突状细胞(dendritic cell,DC)和自然杀伤细胞功能异常等。DC是一种抗原呈递细胞,可以通过多种模式识别受体、捕捉病毒及其成分,进而产生大量抗病毒细胞因子,然后进行交叉呈递并启动病毒特异性细胞毒性T细胞[5-6]。机体感染HBV后,DC功能下降的机制包括HBV逃避DC的识别、被DC摄取加工以及在抗原呈递过程中发生功能障碍。不同研究发现,持续感染HBV后,DC表面共刺激因子表达降低,异源刺激能力下降[7]。Toll样受体(toll-like receptor,TLR)是DC表面最具特征性模式识别受体之一,是先天性免疫屏障的重要组成部分,对入侵病原体产生防御性炎症反应。TLR家族成员包括TLR1~TLR11,其中TLR4在肝病进展中起重要作用[8-9]。单核细胞来源树突状细胞(monocyte-derived dendritic cells,MoDC)和髓样树突状细胞(myeloid dendritic cell,mDC)均表达细胞外及细胞内的TLR,并能识别、结合TLR的特异性配体,促进DC的成熟和炎性因子的分泌。HBeAg在HBV慢性感染过程中起重要作用,可能对HBV感染患者的免疫应答起调节作用。本研究通过分离健康者单核细胞并将其与刺激因子共培养诱导为MoDC后,检测HBeAg对MoDC表面TLR4及下游丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路蛋白及功能的影响,现将结果报道如下。
1 材料和方法
1.1 主要试剂 重组人粒细胞集落刺激因子(recombinant human granulocyte colony stimulating factor,rhGMCSF;批号:P04141)、重组白细胞介素-4(recombinant interleukin-4,rhIL-4;批号:P05112)均购自美国 R&D公司,细胞增殖与毒性检测试剂盒(批号:G3582)购自美国 Promega公司,重组 HBeAg(批号:HBV-272)购自美国 Prospec公司,脂多糖(lipopolysaccharide,LPS;批号:916374)购自美国Sigma公司,RPMI1640培养基(批号:SH30809.01)购自美国 Hyclone 公司,FBS(批号:16140063)购自美国Gibco公司,人淋巴细胞分离液(批号:GHSB 85-2001)购自上海华精生物高科技有限公司,抗人 CD11c-PE(批号:MHCD11C04)、抗人FITC-人类白细胞抗原(human leukocyte antigen,HLA)-DR(批号:11-9956-42)均购自美国 Ebioscience公司,TLR4一抗(批号:ab13556)购自英国Abcam公司,磷酸化细胞外信号调节激酶1/2(phosphorylated extracellular signal-regulated kinase 1/2,pERK1/2)、磷酸化c-Jun氨基末端激酶(phosphorylated c-Jun N-terminal kinase,pJNK)蛋白、磷酸化 p38(phosphorylated p38,pp38)一抗(批号:4370、4668、9212)均购自美国 Cell Signaling公司,甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)蛋白一抗(批号:D110016-0100)购自上海生工生物工程股份有限公司,丝裂霉素C(批号:ROCHE 107409)购自美国Sigma公司,IL-12、IL-6的 ELISA检测试剂盒(批号:F01380、F01310)均购自上海西唐生物科技有限公司。
1.2 方法
1.2.1 DC体外诱导分化与MoDC表型鉴定 将新鲜分离的健康者外周血缓慢加入盛有淋巴细胞分离液的离心管中,经梯度离心法获得单核细胞,用RIPA1640洗涤细胞,弃上清液获得人外周血单个核细胞,用RIPA1640悬浮细胞后放入37℃、5% CO2孵箱培养2 h,获得贴壁细胞,即单核细胞。加入含20% FBS的RIPA1640及rhGM-CSF 750 U/ml+rhIL-4 870 U/ml细胞培养液,每2 d换液并补充rhGM-CSF、rhIL-4,7 d后收集悬浮细胞。在光镜和电镜下观察细胞形态,采用流式细胞术鉴定细胞表型。
1.2.2 细胞分组 将诱导培养至第8天的MoDC分为HBeAg组(加入浓度为5 mg/L的HBeAg)及对照组(不加HBeAg),培养24 h;再加入浓度为1 mg/L的LPS刺激MoDC成熟,收集培养至第9天悬浮细胞进行以下各项检测。
1.2.3 MoDC表面TLR4及MAPK信号通路蛋白表达检测 采用Western blot法。收集各组培养9 d的MoDC,使用细胞裂解液裂解细胞、提取蛋白并测定蛋白浓度后,等量上样,经过聚丙烯酰胺凝胶电泳转至聚偏二氟乙烯膜,加入Western封闭液后,加入相应一抗,4℃孵育过夜,洗涤后加入相应二抗,室温孵育2 h后洗涤,使用ECL发光液显影、定影。蛋白条带使用UVI凝胶成像系统成像,Quantlty one软件测定各组蛋白灰度值。
1.2.4 MoDC刺激同种异基因淋巴细胞增殖能力检测采用同种异基因混合淋巴细胞反应试验。采用上述方法获得另一正常人的外周血单个核细胞并收集悬浮细胞,加入含20% FBS的RIPA1640悬浮细胞,即淋巴细胞。收集培养至第9天的MoDC并用丝裂霉素C处理,即刺激细胞。MoDC 与淋巴细胞按 1∶5、1∶10、1∶20的比例分别置于96孔板,每组设置3个复孔,于37℃、5% CO2环境中培养4 d。培养结束前4 h,每孔加入20 μl细胞增殖与毒性检测试剂,在37℃、5% CO2的细胞培养箱中孵育4 h,在490 nm处读取吸光度值。刺激指数=(吸光度值HBeAg组-吸光度值本底)(/吸光度值无HBeAg组-吸光度值本底)。
1.2.5 MoDC分泌下游细胞因子(IL-12、IL-6)水平检测 采用ELISA法。收集各组培养9 d的MoDC上清液,按照ELISA试剂盒操作说明书检测IL-12、IL-6水平。
1.3 统计学处理 采用SPSS 25.0统计软件。计量资料以表示,组间比较采用两独立样本t检验,P<0.05为差异有统计学意义。
2 结果
2.1 MoDC形态及表型鉴定 外周血单核细胞经刺激因子诱导7 d后在光境下呈簇状生长,大部分细胞脱落,悬浮生长,表面不规则,见图1a(插页);在电镜下细胞表面粗糙不规则,有大量长短、粗细不一的树枝样突起,呈现典型的DC形态,见图1b(插页)。加入rhGM-CSF、rhIL-4诱导培养 7 d的悬浮细胞中CD11c/HLA-DR 双阳性表达率为(86.20±1.85)%,明显高于未加 rhGM-CSF、rhIL-4组的(9.01±1.12)%,差异有统计学意义(P<0.05),见图2(插页)。
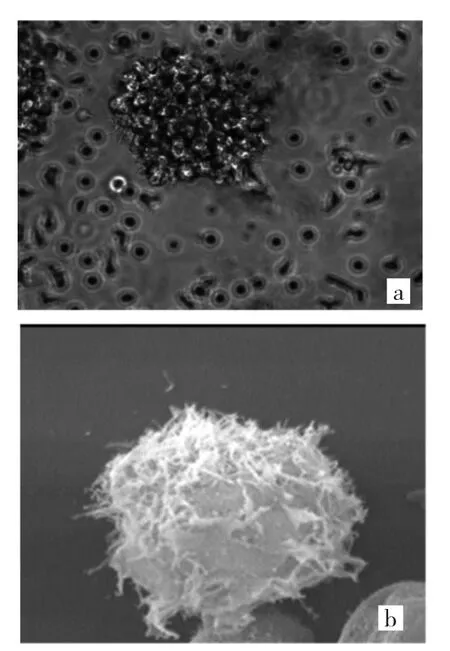
图1 单核细胞来源树突状细胞(MoDC)形态观察(a:光镜下所见,×400;b:电镜下所见,×3 820)
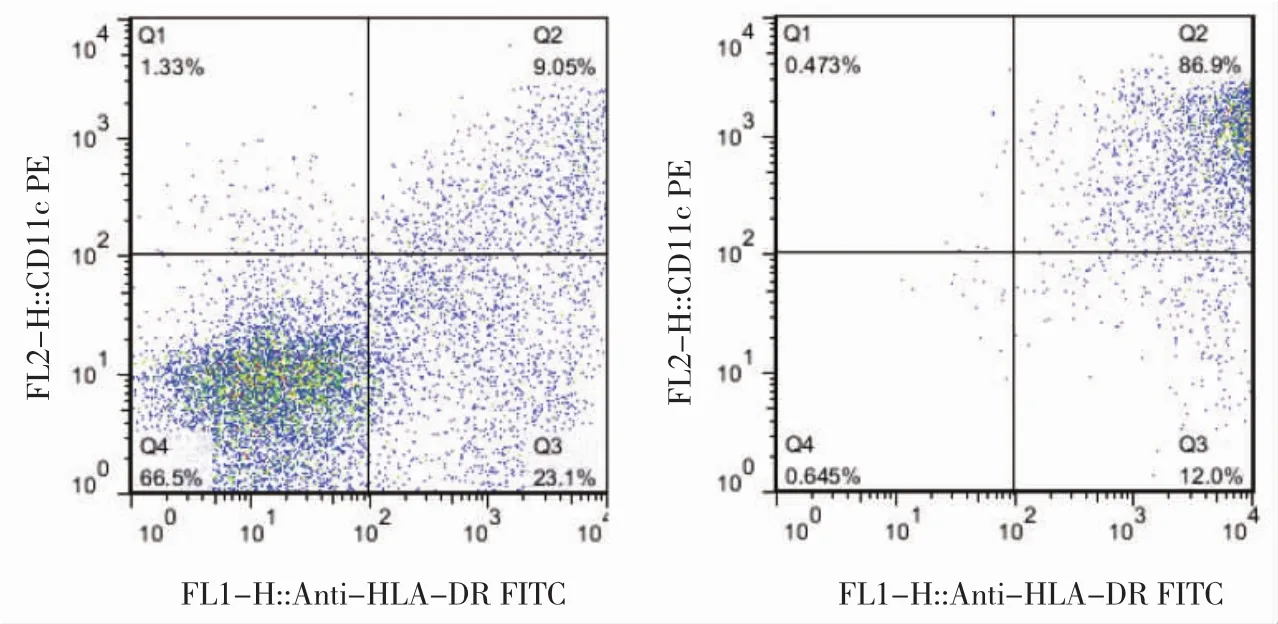
图2 树突状细胞(DC)表面CD11c/人类白细胞抗原(HLA)-DR双标流式表型[a:单纯培养的悬浮细胞;b:重组人粒细胞集落刺激因子(rhGM-CSF)联合重组白细胞介素-4(rhIL-4)培养7 d的悬浮细胞]
2.2 HBeAg对MoDC表面TLR4及MAPK信号通路蛋白表达的影响 HBeAg刺激组 TLR4、pp38、pJNK、pERK1/2蛋白表达均明显低于对照组,差异均有统计学意义(均P<0.05),见图3和表1。
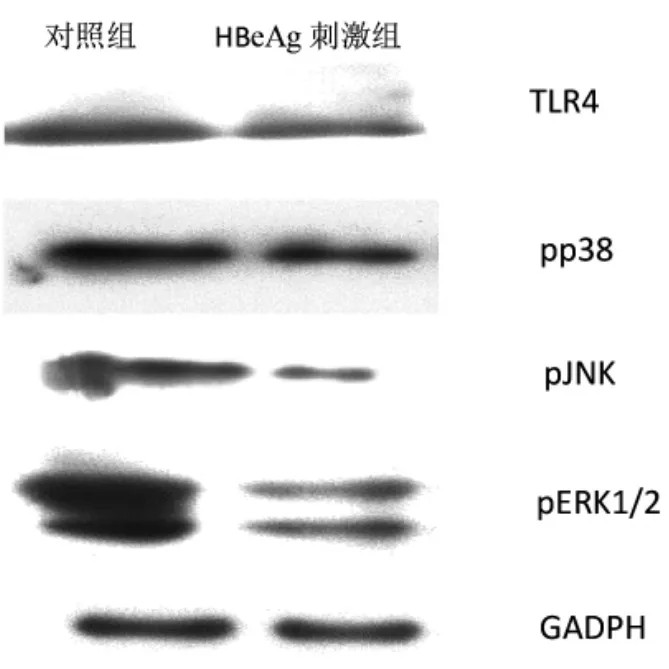
图3 HBeAg刺激组与对照组单核细胞来源树突状细胞(MoDC)表面 Toll样受体 4(TLR4)及丝裂原活化蛋白激酶(MAPK)信号通路蛋白表达的电泳图(pp38为磷酸化p38;pJNK为磷酸化c-Jun氨基末端激酶;pERK1/2为磷酸化细胞外信号调节激酶1/2;GADPH为甘油醛-3-磷酸脱氢酶)
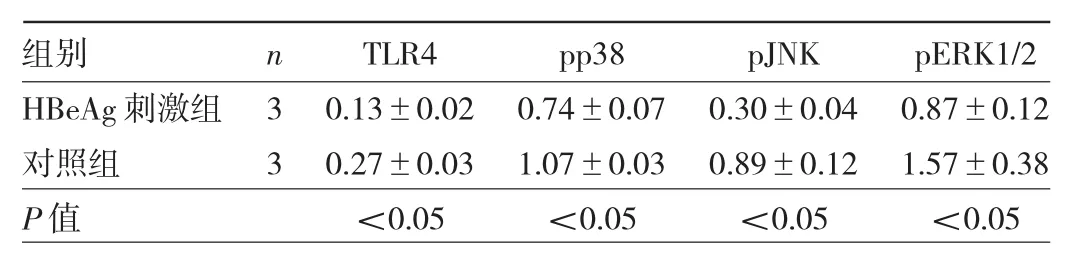
表1 HBeAg刺激组与对照组MoDC表面TLR4及MAPK信号通路蛋白表达比较
2.3 HBeAg对MoDC刺激同种异基因淋巴细胞增殖能力的影响 加入不同比例的MoDC后,HBeAg刺激组MoDC刺激指数均明显低于对照组,差异均有统计学意义(均 P<0.05),见表2。
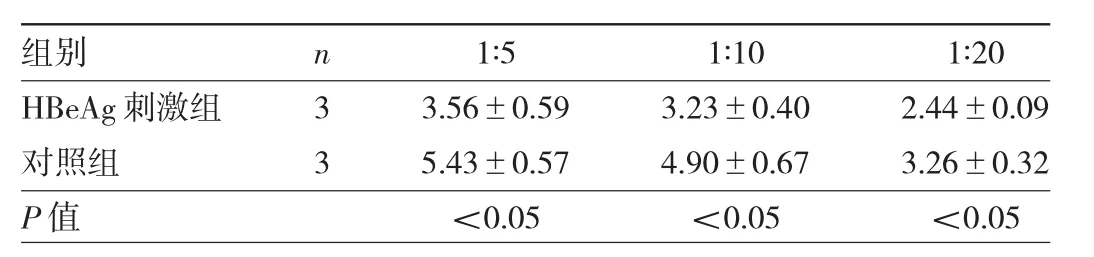
表2 HBeAg刺激组与对照组加入不同比例MoDC的刺激指数比较
2.4 HBeAg对MoDC分泌 IL-12、IL-6水平的影响HBeAg刺激组MoDC分泌IL-12、IL-6水平均明显低于对照组,差异均有统计学意义(均P<0.05),见表3。

表3 HBeAg刺激组与对照组MoDC下游细胞因子水平比较(μg/L)
3 讨论
中国是HBV中度流行地区,HBV的治疗是我国面临的严峻挑战之一。部分患者经历急性HBV感染后无法清除病毒,而持续感染状态可能进一步导致慢性肝脏疾病[10]。机体感染HBV后的病情发展变化是由病毒和宿主的免疫系统相互决定的[11]。研究发现,HBV感染后完全清除病毒的患者表现出明显的特异性T细胞及体液免疫反应,而慢性感染者则表现为免疫反应受损[12-13]。目前普遍认为免疫反应受损或减弱是引起HBV慢性感染的关键原因。肝细胞不能通过已知的信号通路有效识别HBV,提示可能存在HBV免疫逃避机制[14]。研究表明,HBV可以抑制固有免疫细胞功能,使其免疫反应减弱[15-16]。慢性HBV感染者T细胞数量减少、免疫功能低下,导致机体对HBV难以产生有效的免疫应答反应,被认为是HBV感染慢性化的重要机制之一[17-19]。相关研究表明,慢性HBV感染可以被功能完整的免疫系统清除,也可能通过激活肝细胞和免疫细胞功能来抑制HBV的复制[20]。因此在体内激活针对HBV的特异的T淋巴细胞反应可能是改变慢性HBV感染状态的关键。
DC具有将外源性抗原呈递到主要组织相容性抗原(major histocompatibility complex,MHC)Ⅱ类细胞进一步激活CD4+T细胞的独特能力,并将这些抗原消化为短肽呈递到MHC Ⅰ类细胞中激活CD8+T细胞[21]。成熟的DC有效启动T细胞反应,与其表面共刺激分子(CD80、CD86)、MCH Ⅱ表达增加和分泌 IL-12、TNF-α等细胞因子增多具有密切关系。目前可以通过观察成熟DC产生生物活性IL-12的能力作为判断DC疫苗临床有效性的一个直接指标,因为它具有在体内激活效应T细胞的能力,可促进保护性Th1细胞的分化。有报道称,慢性乙肝患者DC功能受损,则激活T细胞能力减弱,细胞因子分泌减少[7],DC表面CD80、CD86、HLA-DR表达与HBV DNA呈负相关,且DC的功能与HBeAg血清学转换密切相关[22]。因此,DC表面共刺激因子表达及分泌细胞因子能力下降,激活T细胞能力降低,可能是导致HBV慢性感染的重要原因之一。
在HBV生命周期中,HBeAg对病毒感染、复制和共价闭环DNA的形成并不是必需的,但却被认为是一种重要的免疫调节剂,能促进病毒的持续感染[19,23]。多项研究表明,HBeAg通过调节宿主免疫应答,在HBV慢性感染的建立和进展中发挥重要作用[24]。有研究提示HBV可能通过HBeAg引起DC功能缺陷,导致DC针对HBV免疫耐受[25]。现在不同的研究显示,HBeAg可抑制T淋巴细胞的增殖[26],下调IFN-γ的表达来调节免疫应答[27],使HBV感染后无法被机体清除,更利于HBV的持续感染。本实验也得出类似结果,将健康者MoDC经HBeAg作用后,其刺激同种异基因淋巴细胞增殖能力明显减弱,分泌IL-12、IL-6明显减少。
TLR是一种模式识别受体,是先天免疫的重要组成部分。John等[28]研究发现,敲除小鼠肝细胞表面TLR4基因后,肝脏持续暴露于来自肠道共生细菌的内毒素中,激活CD8+T细胞的能力明显减弱。Wu等[29]发现通过激活小鼠mDC表面的TLR4可以抑制HBV的复制。慢性HBV感染者DC表面与TLR4通路激活相关的共刺激因子CD40、CD80以及共刺激OX40L的表达明显减少;与健康者相比,TLR激动剂刺激慢性HBV患者外周循环DC后,其体外成熟能力以及分泌IL-12p70和TNF-α的能力受损[30]。某动物实验发现,TLR4通过MyD88依赖信号通路激活下游信号通路,包括NF-κB、MAPK和PI-3K/AKT通路,使得促炎细胞因子分泌增加,进而抑制HBV复制[31]。Nakagawa等[32]研究表明,MAPK的激活对DC的成熟及炎症因子的分泌也有重要作用。通过激活TLR4、MAPK可减少HBV的复制,HBV可通过下调TLR表达和减弱细胞信号通路来对抗TLR4的作用。有文献报道含有编码HBV的重组杆状病毒的肝细胞系存在HBeAg时,pp38和TNF-α的表达明显降低[30]。临床研究发现,HBeAg(-)的慢性乙肝患者与 HBeAg(-)的 HBV 携带者相比,自然杀伤细胞中普遍缺乏p38 MAPK激活[33]。通过HepG2.2.15细胞实验同样发现,激活ERK1/2通路可抑制HBV复制[34]。本实验发现,HBeAg与MoDC共培养后,其表面 TLR4、pp38、pJNK、pERK1/2 蛋白表达均明显降低,IL-12、IL-6等细胞因子分泌减少,同时刺激淋巴细胞增殖能力减弱,这提示HBeAg可通过抑制MoDC表面TLR4及下游MAPK信号通路的表达,进而抑制MoDC的免疫功能。
综上所述,HBeAg能降低MoDC表面TLR4及下游MAPK信号通路传导,减少IL-12、IL-6分泌,减弱其刺激淋巴细胞增殖能力。该结果为HBV免疫耐受的机制带来了新的见解,为设计新的免疫治疗策略提供了一定基础,提示可通过改变HBV相关抗原引起的免疫功能抑制来改变DC的功能,恢复机体对病毒的有效免疫应答,进而改变HBV持续感染状态。

